亨氏马尾藻醇提取物及其不同溶剂萃取物的抗氧化活性研究
2016-09-10卢虹玉李梅婷章超桦
吴 慧,卢虹玉,李梅婷,章超桦
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,国家贝类加工技术研发分中心(湛江),南海生物资源开发与利用协同创新中心,广东湛江 524088)
亨氏马尾藻醇提取物及其不同溶剂萃取物的抗氧化活性研究
吴慧,卢虹玉,李梅婷,章超桦*
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,国家贝类加工技术研发分中心(湛江),南海生物资源开发与利用协同创新中心,广东湛江 524088)
研究了亨氏马尾藻95%乙醇提取物不同溶剂级分的体外抗氧化活性。采用Folin-Ciocalteu法测定亨氏马尾藻醇提取物(总提取物)以及石油醚萃取物、乙酸乙酯萃取物、正丁醇萃取物和水萃取物五个部位的总酚含量,并通过DPPH·、ABTS+·清除及ORAC三种方法评价五种提取物的抗氧化活性。结果表明,乙酸乙酯萃取物的总酚含量最高,为(12.71±0.02) mg GAE/g(没食子酸当量)。在不同抗氧化测定方法中,亨氏马尾藻醇提取物及其不同溶剂萃取物均表现出不同程度的抗氧化活性。其中,乙酸乙酯萃取物抗氧化活性较强,其DPPH和ABTS半数清除率分别为(0.89±0.01) mg/mL和(0.73±0.03) mg/mL,ORAC值达到(1803.78±81.37) μmol TE/g。
亨氏马尾藻,抗氧化活性,ORAC,总酚
自由基是机体的代谢产物,正常的生理状态下,自由基的形成和清除处于动态平衡,发挥着重要的生理作用。但是,机体内过量的自由基具有强氧化性,损害机体组织和细胞,进一步导致机体衰老并且诱发各种疾病,而抗氧化剂能保护机体免受自由基诱导的氧化损伤[1-2]。由于合成的抗氧化剂对机体存在一定程度的损害,因此,从植物中提取有效的抗氧化物质成为目前抗氧化剂发展的趋势。植物中多糖、多酚类、黄酮类等化合物能够清除过量自由基,表现较强抗氧化活性[3]。随着近年对海洋资源的开发利用研究,海洋藻类在天然抗氧化剂方面的研究与开发成为国内外的研究热点和趋势。
马尾藻是褐藻中的一类海藻,种类丰富,广泛分布于沿海地区。由于独特且复杂的海洋环境,马尾藻中积累了丰富的次生代谢产物,如多糖、多酚、甾醇等,前期研究表明,马尾藻提取物具有显著的抗氧化活性[4]。亨氏马尾藻是一种广泛分布于福建省和广东省沿海地带的海藻,资源丰富[5]。目前研究表明,亨氏马尾藻成分丰富复杂,具有抗肿瘤和降血脂等生物活性[6-8],近年来的研究热点集中在多糖方面,对其所含其它化学成分鲜见报道。本研究采用多种方法评价亨氏马尾藻的醇提物(总提取物)及其不同极性溶剂萃取物的抗氧化能力和自由基清除能力,为促进海藻资源在海洋天然抗氧化剂中的开发利用提供理论依据。
1 材料与方法
1.1材料与仪器
亨氏马尾藻2015年5月采自广东湛江硇洲岛,洗净风干,粉碎-20 ℃储藏备用;没食子酸标准品纯度≥98%,Tauto公司;二苯代苦味酰基(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)Sigma公司;Trolox纯度≥98%,东京化成工业株式会社;荧光素二钠盐、2,2-偶氮双-(2-甲基丙脒)-二盐酸盐(AAPH)均为Solarbio公司;抗坏血酸国药集团化学试剂;福林酚试剂北京鼎国生物技术有限公司;无水乙醇、无水碳酸钠、过硫酸钾、磷酸氢二钾、磷酸二氢钠、正丁醇、乙酸乙酯、正丁醇均为市售分析纯;实验用水为蒸馏水。
RT-34粉碎机荣聪精密科技有限公司;N-1000V-W旋转蒸发仪日本EYELA公司;UV2550紫外分光光度计日本岛津;Varioskan Flash全自动酶标仪、96孔细胞培养板、微量移液器均为美国Themo公司。
1.2实验方法
1.2.1样品溶液的提取和制备称取亨氏马尾藻粉500 g,用95%乙醇按料液比1∶10进行室温浸泡提取3次,依次浸泡12、24、48 h,过滤,合并滤液,减压浓缩得总提取物11.18 g。将总提物加6倍蒸馏水混悬后,以相同体积的石油醚进行萃取后得到石油醚萃取物,水相再依次用乙酸乙酯、正丁醇进行萃取,每种溶剂分别萃取3次,合并萃取液浓缩干燥后分别得到石油醚萃取物2.32 g,乙酸乙酯萃取物1.83 g,正丁醇萃取物3.01 g,水萃取物3.31 g。取总提物以及各不同溶剂萃取物20 mg,用不同溶剂定容至10 mL(水萃取物用超纯水,其他用无水乙醇),得到浓度为2 mg/mL的母液,分别用相应溶剂稀释,得到浓度为1、0.8、0.6、0.5、0.4、0.2、0.25、0.2、0.125、0.0625 mg/mL的待测样品溶液。
1.2.2总酚含量的测定采用Folin-Ciocalteu法[9]。根据文献简述如下:吸取质量浓度5~60 μg/mL的没食子酸标准品溶液20 μL,加入800 μL 1 mol/L福林酚乙液,振荡混匀反应5 min后,加入2 mL 12% Na2CO3溶液,混匀,室温避光放置60 min,在760 nm处测定吸光度。重复三次,取平均值。以没食子酸质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,标准曲线方程为:y=0.0186x+0.0215,R2=0.9997。将样品稀释到适当浓度,按照相同的测定方法,测得吸光度值,根据没食子酸标准曲线,求出样品总酚含量,以没食子酸当量(mg GA/g干基)计。
1.2.3清除DPPH自由基能力的测定参照文献[10],吸取质量浓度为0.2、0.4、0.6、0.8、1 mg/mL的总提取物以及不同溶剂萃取物待测溶液2 mL,分别加入5×10-5mol/L DPPH乙醇溶液2 mL,迅速混匀,室温暗处反应30 min后,以相应溶剂作为空白对照,在517 nm处测定吸光度A1。以相应溶剂代替样品溶液测定吸光度A0,以相应溶剂代替DPPH溶液测定吸光度A2。VC作为阳性对照。样品的抗氧化程度以对DPPH的清除率表示,清除率越大,抗氧化性越强,反之,则越弱。清除率按以式(1)计算:
DPPH·清除率(%)=[1-(A1-A2)/A0]×100
式(1)
1.2.4清除ABTS+·自由基能力的测定参照文献[11],将2.45 mmol/L K2S2O8溶液和7.0 mmol/L ABTS溶液等体积混匀后,室温避光反应16 h,得到ABTS+自由基储备液。用相应溶剂将ABTS+自由基储备液稀释,使其吸光度值在波长734 nm处达到0.700±0.020,得到ABTS+自由基使用液。吸取质量浓度为2、1、0.5、0.25、0.125 mg/mL的各待测样品溶液40 μL于96孔板,分别加入160 μL ABTS+自由基使用液,混匀,室温反应8 min,在734 nm处测定吸光度A1。以相应溶剂代替样品溶液测定吸光度A0,以相应溶剂代替ABTS+自由基使用液测定吸光度A2。VC作为阳性对照,样品对ABTS+的清除率按公式(1)计算。
1.2.5氧自由基吸收能力测定(ORAC)参照文献[12-14],将Trolox、AAPH和样品溶解于磷酸盐缓冲液(pH=7.4)中。取96孔板,依次加入20 μL稀释到适当浓度的样品溶液后,每孔加入160 μL荧光素钠盐溶液,混匀后37 ℃恒温培养30 min后,迅速加入20 μL 153 nmol/L AAPH(现配现用),立即进行荧光测定。设置时间间隔2.5 min,持续时间90 min,激发波长485 nm,发射波长538 nm,每次测定前震荡8 s。不同浓度的Trolox(6.25~100 μmol/L)为阳性对照,磷酸盐缓冲液为空白对照组(不加样品),另设一组自身荧光对照组(不加AAPH)。将测得的数据输入到Origin8.6中,采用积分法计算荧光衰退曲线下面积。抗氧化剂作用下荧光衰退曲线面积(AUC样品)和荧光自然衰退面积(AUC空白)之差net-AUC即抗氧化保护面积。以Trolox标准品浓度为横坐标,net-AUC为纵坐标,绘制标准曲线,计算netAUC样品,ORAC值以Trolox当量表示(μmol TE/g)。

表1 亨氏马尾藻不同溶剂提取物的总酚含量

表2 不同溶剂提取物对DPPH·和ABTS+·的半数清除率IC50(mg/mL)
注:同一行不同字母表示有显著差异(p<0.05)。
1.2.6数据处理采用Origin8.6进行实验数据处理,每次实验测定重复3次,实验结果以平均值±标准差表示。
2 结果与讨论
2.1总酚含量
酚类物质通常存在于植物中,并且拥有抗氧化等多种生物活性,卢虹玉[15-16]等报道过硇洲马尾藻与全缘马尾藻中的多酚含量在0.01~2 mg GAE/g之间。亨氏马尾藻总提物以及不同溶剂萃取物的总酚含量见表1。亨氏马尾藻中总酚含量在3~13 mg GAE/g之间,高于硇洲马尾藻与全缘马尾藻的酚含量。由表1可知,亨氏马尾藻95%醇提物以及不同极性溶剂萃取物之间的总酚含量存在差异。不同极性部位的总酚含量依次为:乙酸乙酯萃取物>石油醚萃取物>总提物>正丁醇萃取物>水萃取物。亨氏马尾藻的酚类物质主要集中在中等偏小的极性部位。
2.2DPPH·清除能力
DPPH在醇溶液中形成稳定的紫色自由基,在517 nm处有最大吸收,遇到自由基清除剂时,自由基浓度降低,紫色变浅,褪为淡黄色,吸光度值变小,以吸光度值的变化程度体现抗氧化能力[17]。
由图1和表2可知,亨氏马尾藻95%乙醇提取物以及不同溶剂萃取物对DPPH·均表现出清除作用,并且在实验浓度范围内呈现一定的量效关系,随样品浓度的增加,清除能力增强。由图1可以看出,在实验浓度范围内,石油醚萃取物和乙酸乙酯萃取物对DPPH·清除效果相当,IC50分别为(0.94±0.03) mg/mL和(0.89±0.01) mg/mL,而总提物和正丁醇萃取物对DPPH·的清除率基本一致,清除率显著(p<0.05)低于石油醚和乙酸乙酯萃取物,水萃取物的IC50为(2.11±0.11) mg/mL,清除作用最弱。质量浓度为1 mg/mL时,亨氏马尾藻95%乙醇提取物对DPPH·的清除率为40.46%,远高于萱藻1.25 mg/mL 95%乙醇提取物对DPPH·的清除率26.63%[18],但是与VC相比,亨氏马尾藻醇提物及不同溶剂萃取物对DPPH·的清除效果均不及VC。
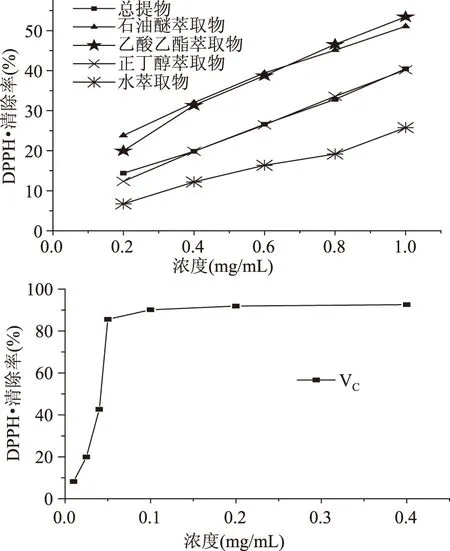
图1 不同溶剂提取物对DPPH·的清除率Fig.1 DPPH radical scavenging activity of different solvent extracts from S. henslowianum
2.3ABTS+·清除能力
样品的抗氧化能力以ABTS+·的清除率表示,清除率越高,表示抗氧化能力越强。
由图2和表2可知,亨氏马尾藻95%乙醇提取物以及不同溶剂萃取物对ABTS+·均表现出不同程度的清除作用,而且随着样品浓度增加,对ABTS+·的清除率越大,不同极性部位对ABTS+·的清除率随浓度的变化率存在差异。低浓度时,总提物及不同极性部位的ABTS+·清除率相近,随着浓度的增加,总提物的清除率显著增强,可能是因为总提取物里成分复杂,除了酚类物质以外,还含有其他抗氧化物质,并且对ABTS有较强的清除作用[19],乙酸乙酯萃取物次之,可能与该部位含有较高含量的酚类化合物有关。其中,总提物和乙酸乙酯萃取物的IC50分别为(0.65±0.02) mg/mL和(0.73±0.03) mg/mL,虽显著高于VC的IC50(0.055±0.02) mg/mL,但在浓度为2 mg/mL时,仍然表现较高ABTS+·清除率,分别可以达到97.88%和81.07%。石油醚萃取物和正丁醇萃取物对ABTS的清除作用相当,IC50分别为(1.22±0.10) mg/mL和(1.29±0.14) mg/mL。水萃取物对ABTS自由基的清除作用最弱。

表3 不同溶剂提取物的ORAC值
注:不同字母表示有显著差异(p<0.05)。
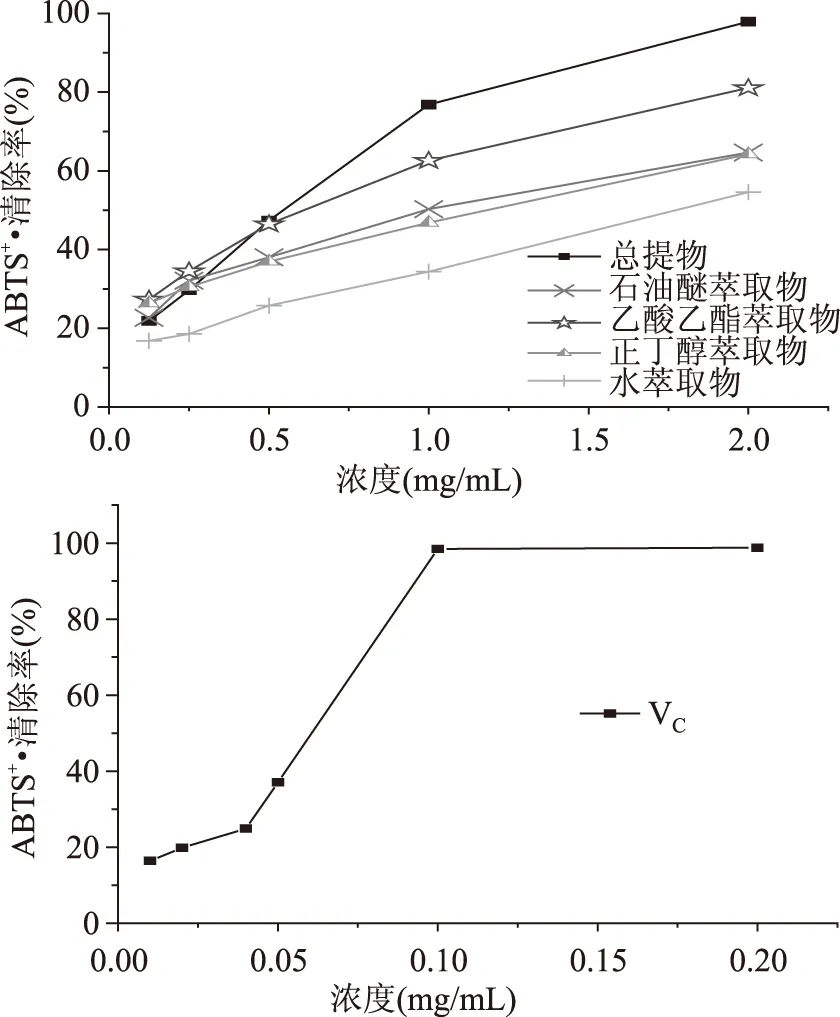
图2 不同溶剂提取物对ABTS+·的清除率Fig.2 ABTS+ radical scavenging activity of different solvent extracts from S. Henslowianum
2.4ORAC测定结果
ORAC方法,又称为氧自由基吸收能力或抗氧化能力指数,是评价总抗氧化能力的方法之一,以AAPH热分解产生过氧自由基,荧光素钠剂(简称FL)为荧光指示剂,Trolox为定量标准进行的分析方法。ORAC值越高,抗氧化能力越强。
由不同浓度Trolox的荧光衰退曲线得到图3中相应的Trolox浓度-效应曲线。从表3可知,亨氏马尾藻不同溶剂提取物的ORAC值大小依次为:乙酸乙酯萃取物>正丁醇提取物>石油醚萃取物=总提物>水萃取物。其中,乙酸乙酯萃取物为(1803.78±81.37) μmol TE/g,显著高于醇提取物以及其他溶剂萃取物的ORAC值,远高于文献[14]报道中铜藻(68.74±7.3) μmol TE/g和面条藻(66.15±10.10) μmol TE/g的ORAC值,表现出较强氧自由基吸收能力。
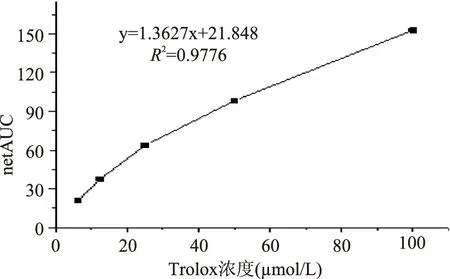
图3 Trolox浓度-netAUC曲线Fig.3 Different concentrations of Trolox-netAUC curve
3 结论
通过研究亨氏马尾藻95%乙醇提取物及不同极性溶剂萃取物的总酚含量并测定其体外抗氧化活性,结果表明亨氏马尾藻不同极性部位的总酚含量在3~13 mg GAE/g之间,并且对DPPH·、ABTS+·有一定的清除能力,ORAC值在1000~2000 μmol TE/g范围内。其中,以乙酸乙酯萃取物的总酚含量最高,抗氧化活性较强,极性最大的水萃取物总酚含量最低,抗氧化活性始终最弱。而酚类物质作为抗氧活性的主要物质,酚类物质含量越高,其抗氧化活性越强,由此表明亨氏马尾藻的酚类物质和其他抗氧化活性物质主要集中在乙酸乙酯这种中等极性部位,因此,亨氏马尾藻乙酸乙酯萃取物具有开发天然抗氧化物的潜力,可作为分离亨氏马尾藻抗氧化成分的重点研究部位,进而促进亨氏马尾藻海藻资源的有效利用。
[1]Circu M L,Aw T Y. Reactive oxygen species,cellular redox systems,and apoptosis[J]. Free Radical Biology Medicine,2010,48(6):749-762.
[2]Dudonne S,Vitrac X,Coutiere P,et al. Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC Assays[J]. Agricultural and Food Chemistry,2009,57(5):1768-1774.
[3]郑瑞生. 植物中抗氧化活性成分及其提取技术的研究[J].食品工业科技,2011,32(11):459-467.
[4]Liu Lei,Heinrich Michael,Myers Stephen,et al. Towards a better understanding of medicinal uses of the brown seaweedSargassumin traditional Chinese medicine:A phytochemical and pharmacological review[J]. Journal of Ethnopharmacology,2012,142(3):591-619.
[5]曾呈奎,陆保仁. 墨角藻[M]. 北京:科学出版社,1983:212-213.
[6]谌素华,王维民,刘辉,等. 亨氏马尾藻化学成分分析及其营养学评价[J]. 食品研究与开发,2010,31(5):154-156.
[7]李春莲.低分子量亨氏马尾藻岩藻聚糖硫酸酯的制备及抗肿瘤活性研究[D]. 湛江:广东海洋大学,2011.
[8]Cuong H D,Thuy T T T,Huong T T,et al. Structure and hypolipidaemic activity of fucoidan extracted from brown seaweedSargassumhenslowianum[J]. Natural Product Research,2014,29
(5):411-415.
[9]Silva J K,Cazarin C B B,Colomeu T C,et al. Antioxidant activity of aqueous extract of passion fruit(Passifloraedulis)leaves:Invitroandinvivostudy[J]. Food Research International,2013,53(2):882-890.
[10]魏玉西,于曙光. 两种褐藻乙醇提取物的抗氧化活性研究[J]. 海洋科学,2002,26(9):49-51.
[11]张小娜,邹先伟,李莹,等. 茯砖茶不同溶剂提取物抗氧化活性研究[J]. 中国医药导报,2014,11(10):9-13.
[12]何秋彤,余以刚,李聪聪,等. 20种市售凉茶类植物饮料抗氧化性的比较研究[J]. 食品科学,2011,32(7):47-51.
[13]刘文旭. 草莓酚类物质分离纯化、生物活性和结构的研究[D]. 南京:南京农业大学,2012.
[14]Ishimoto H,Tai A,Yoshimura M,et al. Antioxidative properties of functional polyphenols and their metabolites assessed by an ORAC assay[J]. Bioscience,Biotechnology,and Biochemistry,2012,76(2):395-399.
[15]卢虹玉,刘义,吉宏武,等. 全缘马尾藻褐藻多酚的抗氧化和抗肿瘤细胞增殖作用研究[J]. 现代食品科技,2013,29(4):702-705.
[16]卢虹玉,陈晓敏,殴小蕾,等. 硇洲马尾藻(S.Naozhouense)褐藻多酚的抗凝血活性研究[J]. 天然产物研究与开发,2013,25(2):249-252.
[17]许亚如. 褐藻多酚的抗氧化活性研究[D].宁波:宁波大学,2014.
[18]栾莎. 萱藻(Scytosiphonlomentaria)抗氧化生物活性研究[D].青岛:中国海洋大学,2012.
[19]霍丽妮,廖艳芳,陈睿,等. 狐狸尾不同极性溶剂提取物体外抗氧化活性研究[J]. 中国实验方剂学杂志,2011,17(23):155-158.
Antioxidant properties of ethanol extractv and its different solvent fractions fromSargassumhenslowianum
WU Hui,LU Hong-yu,LI Mei-ting,ZHANG Chao-hua*
(College of Food Science and Technology,Guangdong Ocean University,Guangdong Province Key Laboratory of Aquatic Products Processing and Safety,Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,National Research and Development Branch Center for Shellfish Processing(Zhanjiang),South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center,Zhanjiang 524088,China)
In this research,antioxidant activitiy of different fractions from ethanol crude extracts ofS.henslowianumwas investigatedinvitro. The total phenolic contents of the 95% ethanol crude extracts and their four solvent fractions(viz.,petroleum ether(PE),ethyl acetate(EA),n-butanol and aqueous)were determined by Folin-Ciocalteu,and their antioxidant properties were evaluated using three assays including 1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl(DPPH),2,2′-Azinobis-(3-ethylbenzthiazoline-6-sulphonate(ABTS)radical scavenging and oxygen radical absorbance capacity. The results showed that EA fraction had the highest content of total phenolics(12.71±0.02 mg gallic acid equivalents/g). All five fractions fromS.henslowianumexhibited the antioxidant activity. EA fraction exhibited strongest antioxidant activities among all the fractions,which the values of IC50based on DPPH· and ABTS+· were(0.89±0.01)mg/mL and(0.73±0.03)mg/mL respectively,and the values of ORAC was(1803.78±81.37) μmol Trolox equivalents/g.
S.henslowianum;antioxidant activitity;ORAC;phenols
2015-10-22
吴慧(1990-),硕士研究生,研究方向:海洋生物资源利用,E-mail:wh-fly@outlook.com。
章超桦(1956-),博士,教授,研究方向:水产品及高值化利用,E-mail:zhangch2@139.com。
国家“863”项目(2013AA092902)。
TS254.4
A
1002-0306(2016)10-0171-05
10.13386/j.issn1002-0306.2016.10.026
