BAFF-BAFFR及信号转导分子参与佐剂性关节炎的免疫反应及芍药苷-6′-O-苯磺酸酯的作用
2016-09-10贾晓益孙晓静杨雪枝赵英杰
徐 澍,魏 芳,贾晓益,孙晓静,杨雪枝,赵英杰,常 艳,魏 伟
BAFF-BAFFR及信号转导分子参与佐剂性关节炎的免疫反应及芍药苷-6′-O-苯磺酸酯的作用
徐澍,魏芳,贾晓益,孙晓静,杨雪枝,赵英杰,常艳,魏伟
目的 观察佐剂性关节炎(AA)大鼠炎症不同时期脾脏B淋巴细胞刺激因子(BAFF)及其受体(BAFFR)表达变化以及芍药苷-6′-O-苯磺酸酯(CP-25)对其的影响。方法采用完全弗氏佐剂制备大鼠AA模型,随机分为正常组、AA组、CP-25(25、50、100 mg/kg)组、甲氨蝶呤(0.5 mg/kg)组、白芍总苷(50 mg/kg)组、芍药苷(50 mg/kg)组,造模后第17~31天给药。ELISA法检测外周血BAFF水平;免疫组织化学法、流式细胞术、Q-PCR和Western blot法检测CP-25对脾脏BAFFR表达的影响;Western blot法检测脾脏肿瘤坏死因子相关因子2(TRAF2)蛋白的表达。结果 与正常组比较,炎症反应期(D9)、炎症初期(D16)、炎症高峰期(D23)及炎症缓解期(D30)模型大鼠血清BAFF水平和脾脏BAFFR mRNA及蛋白表达均增加。与AA组比较,CP-25(25、50、100 mg/kg)体内给药明显下调AA大鼠脾脏BAFFR mRNA及蛋白表达。体外BAFF刺激后,大鼠脾脏细胞TRAF2及BAFFR蛋白表达显著增加,CP-25(1×10-6mol/L)明显降低TRAF2及BAFFR蛋白的表达。结论 CP-25发挥炎症免疫调节作用可能与其抑制AA大鼠BAFFR受体及TRAF2信号分子表达有关。
类风湿关节炎;佐剂性关节炎;CP-25;BAFF;BAFFR;TRAF2
网络出版时间:2016-4-19 11:04:48 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160419.1104.016.html
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节的慢性炎症为特征,以滑膜炎为病理基础,最终导致软骨基质和软骨下骨的侵蚀。B淋巴细胞刺激因子(B cell activating factor,BAFF)是肿瘤坏死因子超家族成员之一,主要来源于树突状细胞、单核细胞、巨噬细胞、中性粒细胞等。BAFF对于B淋巴细胞是一个重要的体内平衡的细胞因子,有助于调节固有免疫和适应性免疫应答[1]。在RA患者的血清和滑液中已检测到BAFF水平增高;实验室前期研究[2-4]表明,BAFF过表达促进T细胞应答,提示BAFF过表达可能促进RA的发生发展。肿瘤坏死因子相关因子2(tumor necrosis factor receptor-associated factor,TRAF2)是TRAF家族中主要成员之一。研究[5]表明,RA患者外周血单核细胞或实验性关节炎免疫组织中BAFFR和TRAF2 mRNA表达均明显增加,提示RA的发生发展可能与高表达的BAFFR通过TRAF2参与调控下游抗凋亡信号通路有关。安徽医科大学临床药理研究所对白芍总苷(total glucosides of paeony,TGP)中的活性成分芍药苷(paeoniflorin,Pae)进行了结构修饰,合成了新型活性单体药物-芍药苷-6′-O-苯磺酸酯(CP-25)。该实验通过建立大鼠佐剂性关节炎(adjuvant-induced arthritis,AA)模型,明确BAFF和BAFFR在AA大鼠病程中的变化以及CP-25对BAFFR和TRAF2表达的作用。
1 材料与方法
1.1材料 SD大鼠,雄性,(180±20)g,SPF级,购自安徽医科大学实验动物中心。所有动物饲养于安徽医科大学实验动物中心屏障环境中。卡介苗(成都生物制品研究所有限责任公司,批号:20123007);TGP(提取自芍药根部,是本所研发的第一个被批准上市的抗炎免疫调节药);Pae;CP-25(本所药化室提供,纯度大于98%);CD45R荧光抗体(美国eBioScience公司);兔来源BAFFR一抗(美国Santa Cruz公司);FITC-小鼠抗兔二抗(美国 Proteintech公司);PV6000通用两步法试剂盒、DAB显色液、苏木精(中国中杉金桥生物技术有限公司);超敏ECL发光显色试剂盒、逆转录试剂盒(美国Thermo Scientific公司);扩增试剂盒(美国Promega公司)。PCR引物序列:BAFFR F:5′-ACCCAGCAG AACCAGACACTAC-3′,R:5′-AACGACCTCAAAAAT-GGAATGT-3′;GAPDH F:5′-ACAGCAACAGGGTGGTGGAC-3′,R:5′-TTTGAGGGTGCAGCGAACTT-3′。
1.2大鼠AA模型的制备及分组 将卡介苗80℃水浴灭活1 h,与高压灭菌的石蜡充分研磨混匀,制成10 g/L完全弗氏佐剂(complete freund adjuvant,CFA),于每只SD大鼠右后足跖皮内注射 CFA 0.1 ml致炎,造模当天为D0。造模成功大鼠随机分为模型组、CP-25(25、50、100 mg/kg)组、甲氨蝶呤(methotrexate,MTX)(0.5 mg/kg)组、TGP(50 mg/ kg)组,Pae(50 mg/kg)组,另设正常组。CP-25、TGP、Pae按照10 ml/kg体重灌胃给药,每天1次;MTX按照10 ml/kg体重灌胃给药,每3 d 1次。
1.3指标观察及方法
1.3.1AA大鼠临床表现 观察大鼠致炎后,根据其关节局部的炎症反应以及全身表现症状,将AA模型分为炎症反应期(D9)、炎症初期(D16)、炎症高峰期(D23)以及炎症缓解期(D30)[6]。
1.3.2AA大鼠外周血BAFF水平 采用ELISA法分别在炎症不同时期(D9、D16、D23、D30)检测AA大鼠外周血BAFF水平变化。在炎症不同时期AA大鼠股静脉取血,静置1 h后离心(3 000 r/min离心15 min),取外周血上清液,-80℃保存待测。采用ELISA试剂盒测定其BAFF水平。
1.3.3AA大鼠脾脏BAFFR表达 采用流式细胞术分别在炎症不同时期(D9、D16、D23、D30)检测AA大鼠脾脏 BAFFR表达。在炎症不同时期,将AA大鼠麻醉后颈部脱臼处死,取脾脏常规制备脾脏悬液、室温2 000 r/min离心10 min即得脾脏细胞。每管加入100μl细胞悬液,加入CD45R、BAFFR一抗,并设阴性组和同型组。37℃孵育30 min后,2 000 r/min离心10 min,弃上清液,加入100μl PBS重悬,加入FITC标记的山羊抗兔荧光二抗,37℃孵育30 min。加入300μl PBS重悬,上机检测。
1.3.4AA大鼠脾脏BAFFR蛋白免疫组织化学分析 按照聚合物免疫组化检测系统中的相关要求检测各组大鼠脾脏BAFFR蛋白表达。取大鼠脾脏组织,常规制备组织切片。脱蜡、水化、组织抗原修复后,3%H2O2去离子水孵育5 min阻断内源性过氧化物酶。滴加BAFFR一抗,4℃孵育过夜;PBS洗涤后滴加通用型IgG抗体-HRP多聚体,37℃孵育15 min;PBS洗涤;应用DAB溶液显色。苏木精复染、脱水、透明、封片、镜检。阳性物质呈棕褐色颗粒状。另设阴性对照实验。采集200倍视野图像,利用Image-Pro Plus分别对各切片中免疫组化染色阳性表达进行半定量分析,测定脾脏组织中BAFFR蛋白染色平均光密度(mean optical density,MOD)值后进行统计学分析。
1.3.5AA大鼠脾脏BAFFR mRNA水平变化分析
4.1 X向纸瓦楞管只发生可控稳定的手风琴变形模式,而Y向纸瓦楞管有稳态渐进屈曲、欧拉失稳、角撕裂、横向剪切4种变形模式;几何参数和压缩速率对X向纸瓦楞管的手风琴变形模式几乎没有影响,但能影响Y向纸瓦楞管稳态渐进屈曲和3种非理想变形模式的占比。
常规步骤抽提脾脏总RNA,根据逆转录试剂盒及扩增试剂盒中的相关步骤,利用Q-PCR法检测脾脏BAFFR mRNA水平变化,内参蛋白为GAPDH。对所得结果采用ΔΔCt法进行分析。
1.3.6AA大鼠脾脏BAFFR蛋白及TRAF2蛋白表达分析 常规裂解脾脏组织(RIPA∶PMSF=99∶1),提取总蛋白。取15μl蛋白样品上样,SDSPAGE凝胶电泳分离蛋白,湿法转移蛋白至PVDF膜,在含5%脱脂牛奶的TPBS中室温封闭2 h。放入含BAFFR、TRAF2一抗的稀释液中(浓度1∶400)4℃过夜,次日加入1∶40 000释度的辣根过氧化物酶标记的二抗室温孵育2 h。ECL试剂盒显影,结果用Image Quant Las Mini凝胶成像系统扫描存盘,采用ImageJ软件进行分析。
1.3.7CP-25体外对BAFF刺激的大鼠脾脏细胞BAFFR和TRAF2蛋白的表达的影响 将正常大鼠麻醉后颈部脱臼致死取脾脏常规制备脾脏悬液、室温2 000 r/min离心10 min即得脾脏细胞。用含10%胎牛血清的DMEM重悬细胞,调整细胞数为5 ×107个/ml。铺6孔板,每孔加1 ml细胞悬液。分别用LPS及BAFF刺激脾脏细胞(LPS终浓度4μg/ ml,BAFF终浓度500 ng/ml),同时给予CP-25(终浓度1×10-6mol/L),在37℃,5%CO2无菌环境下培养72 h,取脾脏细胞进行Western blot实验,检测其BAFFR和TRAF2蛋白的表达。
1.4统计学处理 采用SPSS 19.0软件进行分析,数据以¯x±s表示,组间比较采用单因素方差分析(One-Way ANOVA)。
2 结果
2.1炎症不同时期AA大鼠的临床表现 大鼠致炎后约1 d,致炎侧足爪明显肿胀;D7~D9时致炎侧足爪肿胀明显,D14~D16出现继发病变:对侧足爪及前肢发生多发性关节肿胀,大鼠出现活动障碍,鼻部开始充血,双耳炎症结节出现,尾部炎症结节出现;D21~D23继发性炎症达到高峰,大鼠足爪肿胀度达峰值,鼻部充血严重,双耳及尾部出现大量炎症结节;致炎D28~D30,足爪及关节肿胀开始消退,鼻部充血减轻,双耳及尾部严重结节消退。CP-25(50、100 mg/kg)能显著减轻大鼠继发侧足爪肿胀程度,减少双耳及尾部炎症结节数量。见图1。

图1 炎症高峰期AA大鼠足爪肿胀及 CP-25的影响A:正常组;B、C:AA组;D:CP-25(25 mg/kg);E:CP-25(50 mg/ kg);F:CP-25(100 mg/kg)
2.2炎症不同时期AA大鼠外周血上清液BAFF水平变化 ELISA法结果显示,与正常组比较,炎症反应期(D9)AA大鼠外周血上清液BAFF水平明显增高(F=1.990,P<0.05),炎症初期(D16)、高峰期(D23)、及缓解期(D30)大鼠外周血上清液BAFF水平高于正常大鼠,但差异无统计学意义。见图2。
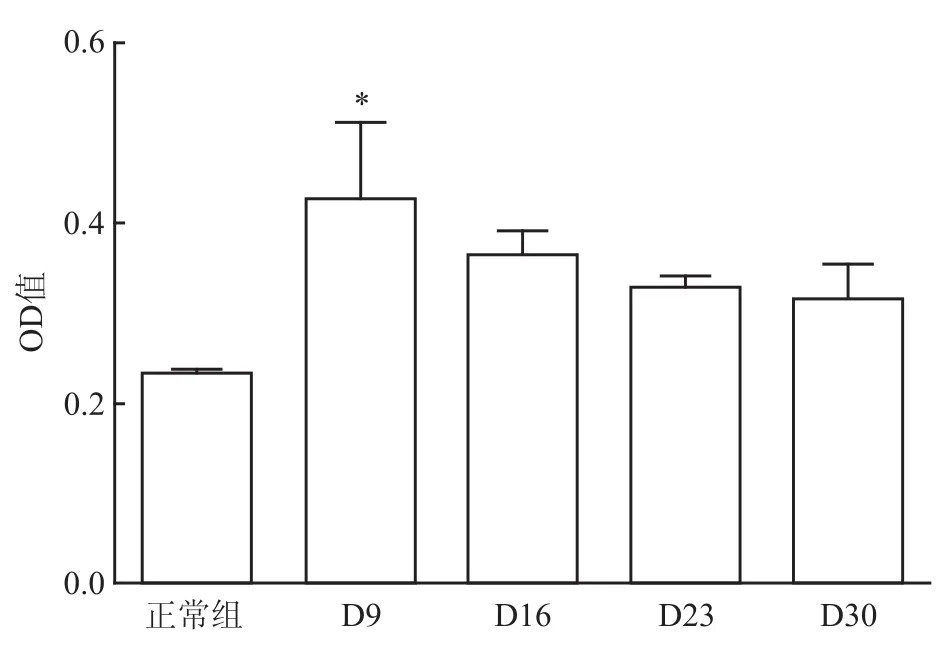
图2 炎症不同时期AA大鼠外周血上清液BAFF水平变化与正常组比较:*P<0.05

图3 炎症不同时期 AA大鼠脾脏 BAFFR表达变化A:阴性对照组;B:正常组;C:D9;D:D16;E:D23;F:D30;与正常组比较:*P<0.05
2.4CP-25体内给药对AA大鼠脾脏BAFFR表达的影响
2.4.1免疫组化结果分析 免疫组化染色切片中,细胞核呈蓝紫色,BAFFR呈浅黄至棕褐色。结果显示,正常组大鼠脾脏BAFFR低表达;与正常组大鼠比较,AA组大鼠脾脏BAFFR表达明显增高,CP-25(25、50、100 mg/kg)给药后降低脾脏BAFFR表达(F=40.570,P<0.01)。见图4。
2.4.2Q-PCR结果分析 Q-PCR结果显示,与正常组比较,AA组大鼠脾脏BAFFR mRNA水平显著增高(P<0.01);CP-25(25、50、100 mg/kg)给药均能不同程度降低大鼠脾脏 BAFFR mRNA水平(F= 39.342,P<0.01)。见图5。
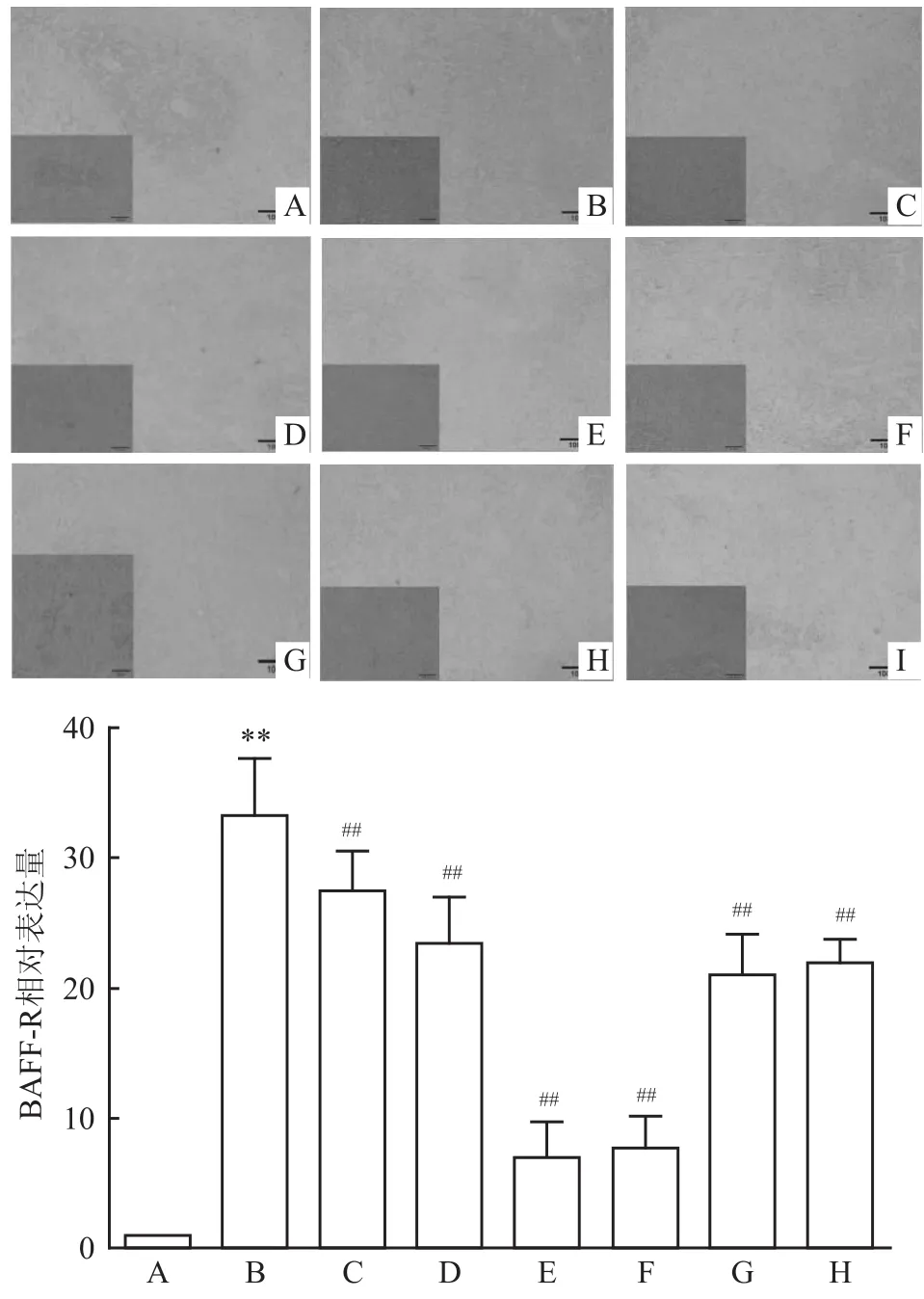
图4 CP-25对 AA大鼠脾脏组织 BAFFR表达的影响 ×200A:正常组;B:AA组;C:CP-25(25 mg/kg)组;D:CP-25(50 mg/ kg)组;E:CP-25(100 mg/kg)组;F:MTX(0.5 mg/kg)组;G:TGP(50 mg/kg)组;H:Pae(50 mg/kg)组;I:阴性对照组;与正常组比较:**P<0.01;与 AA组比较:##P<0.01

图5 CP-25对AA大鼠脾脏BAFFR mRNA表达的影响A:正常组;B:AA组;C:CP-25(25 mg/kg)组;D:CP-25(50 mg/ kg)组;E:CP-25(100 mg/kg)组;F:MTX(0.5 mg/kg)组;G:TGP(50 mg/kg)组;H:Pae(50 mg/kg)组;与正常组比较:**P<0.01;与AA组比较:##P<0.01
2.4.3Western blot结果分析 采用Image J软件对Western blot结果进行分析。实验结果显示,AA模型大鼠脾脏BAFFR表达较正常组显著增加(P<0.01);CP-25(25、50、100 mg/kg)给药不同程度降低大鼠脾脏BAFFR表达(F=928.337,P<0.01)。见图6。
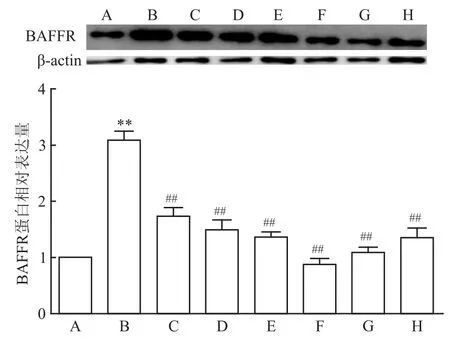
图6 CP-25对 AA大鼠脾脏组织 BAFFR蛋白表达的影响A:正常组;B:AA组;C:CP-25(25 mg/kg)组;D:CP-25(50 mg/ kg)组;E:CP-25(100 mg/kg)组;F:MTX(0.5 mg/kg)组;G:TGP(50 mg/kg)组;H:Pae(50 mg/kg)组;与正常组比较:**P<0.01;与AA组比较:##P<0.01
2.5CP-25体外对BAFF刺激的大鼠脾脏细胞TRAF2和BAFFR蛋白表达的影响 Western blot结果显示,BAFF刺激后,脾脏细胞 TRAF2及BAFFR蛋白表达明显增高;CP-25(1×10-6mol/L)给药后,TRAF2蛋白表达显著降低(F=355.522,P<0.01);BAFFR蛋白表达显著降低(F=9.801,P<0.01)。见图7。
3 讨论
RA是一种主要以慢性炎性滑膜炎为主的自身免疫病,其发病机制尚不清楚。研究[7]表明,以T、B淋巴细胞为主的淋巴细胞在RA的发生发展中起到重要作用。TGP是从芍药根部提取的有效部位,其主要成分为Pae。TGP可以抑制丝裂原活化蛋白激酶信号通路活化,影响成纤维滑膜细胞(fibroblastlike synoviocytes,FLS)的EP受体-G蛋白-cAMP信号转导[8],抑制FLS增殖,抑制白细胞介素-1、肿瘤坏死因子-α、前列腺素E2等细胞因子产生,抑制抗体分泌,调节AA大鼠辅助性T细胞1/辅助性T细胞2和辅助性T细胞17/调节性T细胞平衡[9];Pae能够调节G蛋白-AC-cAMP信号转导通路,下调促炎细胞因子IL-2和TNF-α,上调抗炎细胞因子IL-4和TGF-β,抑制CIA大鼠B淋巴细胞增殖,降低血清中免疫球蛋白水平,降低BAFF/BAFFR表达[10],并通过调节 BAFF/BAFFR介导的 PI3K/Akt/mTOR信号通路以抑制B淋巴细胞功能[11]。CP-25是在Pae结构上6位羟基与苯磺酰基缩合成酯而得到的新型活性单体药物。实验室前期研究显示:CP-25绝对生物利用度较Pae有明显提高,CP-25的吸收高于Pae,消除慢于Pae,分布广于Pae(实验数据待发表)。本实验成功建立AA模型,结果显示,CP-25整体给药显著改善AA大鼠整体和关节的炎症免疫反应(实验数据待发表)。在此基础上,探讨CP-25对AA大鼠的治疗作用以及可能机制。本研究表明,体内、外给予CP-25明显降低AA大鼠BAFFR的mRNA及蛋白表达,降低TRAF2信号分子的蛋白表达,提示CP-25可能通过抑制BAFFR及TRAF2信号分子发挥免疫调节作用。

图7 体外 CP-25对 BAFF刺激的大鼠脾脏细胞 TRAF2和 BAFFR蛋白表达的影响1:对照组;2:LPS(4μg/ml);3:BAFF(500 ng/ml);4:BAFF+ CP-25(1×10-6mol/L);与对照组比较:**P<0.01;与 LPS组比较:##P<0.01
BAFF是肿瘤坏死因数家族成员之一。作为B淋巴细胞存活因子,BAFF适当的表达可以促进自身反应性B淋巴细胞的存活[12]。BAFF在RA患者关节中异常表达,并且关节中BAFF水平高于血清中BAFF水平。AA大鼠的巨噬细胞和树突状细胞中BAFF高表达,提示 BAFF可能与淋巴细胞上相应的受体结合,介导了抗原提呈细胞诱导T淋巴细胞的活化和功能[4]。BAFFR主要表达于幼稚和记忆B细胞,并通过启动选择性核因子-κB(nuclear factor-κB,NF-κB)途径,通过上调抗凋亡蛋白增强B淋巴细胞存活。本实验结果表明:与正常大鼠比较,AA大鼠在炎症的不同时期(D9、D16、D23、D30),外周血BAFF水平增高,脾脏BAFFR mRNA及蛋白表达增加,提示BAFF/BAFFR的异常表达可能参与了AA大鼠炎症的发生发展。体内给予CP-25明显降低AA大鼠脾脏BAFFR mRNA及蛋白的表达,提示CP-25抑制炎症反应可能与调节BAFFR的表达有关。
TRAF家族在肿瘤坏死因子诱导的细胞存活信号通路中作为核心分子,可以调节NF-κB及JNK信号通路,在细胞增殖、分化、凋亡,骨重建以及对细胞因子的激活/抑制方面起到重要作用[13]。TRAF2作为TRAF家族重要成员之一,参与 NF-κB非经典通路的调控及负反馈环节,与B淋巴细胞增殖、存活、分化和抗体产生有密切联系。当肿瘤坏死因子受体2激活时,TRAF2大量募集下游NF-κB转录因子,激活非经典NF-κB信号通路,促进细胞抗凋亡,从而诱导免疫反应,促进自身免疫疾病的发展[14]。研究[15]表明,TRAF2在BAFF-BAFFR及下游信号通路的调控,特别是在B细胞的存活、活化及功能方面发挥重要作用。实验结果显示,与正常组比较,体外BAFF刺激后,脾脏细胞TARF2蛋白表达显著增加;CP-25(10-6mol/L)给药后,TRAF2蛋白表达明显降低。提示CP-25可能通过抑制 BAFF-BAFFRTRAF2分子信号调节免疫细胞功能,发挥抗炎免疫调控作用。
综上所述,T、B淋巴细胞功能异常与RA发生发展密切相关。BAFF在促进淋巴细胞存活、活化、增殖过程中具有重要作用。CP-25作为一种新型活性单体药物,对大鼠AA有明显治疗作用,其机制可能与其抑制AA大鼠淋巴细胞BAFFR表达以及TRAF2信号蛋白表达有关。
[1] Moisini I,Davidson A.BAFF:a local and systemic target in autoimmune diseases[J].Clin Exp Immunol,2009,158(2):155-63.
[2] Wei F,Chang Y,WeiW.The role of BAFF in the progression of rheumatoid arthritis[J].Cytokine,2015,76(2):537-44.
[3] Chang Y,Jia X,Sun X,et al.APRIL promotes proliferation,secretion and invasion of fibroblast-like synoviocyte from ratswith adjuvant induced arthritis[J].Mol Immunol,2015,64(1):90-8.
[4] Chang Y,Sun X,Jia X,et al.Expression and effects of B-lymphocyte stimulator and its receptors in T cell-mediated autoimmune arthritis[J].Int Immunopharmacol,2015,24(2):451-7.
[5] Raghav SK,Gupta B,Agrawal C,etal.Expression of TNF-alpha and related signalingmolecules in the peripheral blood mononuclear cells of rheumatoid arthritis patients[J].Mediators Inflamm,2006,2006(3):12682.
[6] 宋珊珊,张玲玲,魏 伟.实验性关节炎动物模型建立及病理机制研究进展[J].中国药理学通报,2011,27(12):1648-53.
[7] Moulin V,Andris F,Thielemans K,et al.B lymphocytes regulate dendritic cell(DC)function in vivo:increased interleukin 12 production by DCs from B cell-deficientmice results in T helper cell type 1 deviation[J].JExp Med,2000,192(4):475-82.
[8] Chen JY,Wu H X,Chen Y,et al.Paeoniflorin inhibits proliferation of fibroblast-like synoviocytes through suppressing G-proteincoupled receptor kinase 2[J].Planta Med,2012,78(7):665-71.
[9] 张玲玲,魏 伟,汪庆童,等.芍药苷对胶原性关节炎大鼠滑膜细胞G蛋白偶联信号的调节作用[J].中国药理学通报,2008,24(3):330-5.
[10]Chang Y,Wu Y,Wang D,et al.Therapeutic effects of TACI-Ig on ratswith adjuvant-induced arthritis via attenuating inflammatory responses[J].Rheumatology(Oxford),2011,50(5):862-70.
[11]Li P P,Liu D D,Liu Y J,etal.BAFF/BAFFR involved in antibodies production of rats with collagen-induced arthritis via PI3KAkt-mTOR signaling and the regulation of paeoniflorin[J].JEthnopharmacol,2012,141(1):290-300.
[12]Fabienne Mackay,Jennifer L,Gommerman.The Role of the BAFF and Lymphotoxin Pathways in B Cell Biology[M].Molecular Biology of B Cells(Second Edition),2015:251-76.
[13]Wang Y,Zhang P,Liu Y,et al.TRAF-mediated regulation of immune and inflammatory responses[J].Sci China Life Sci,2010,53(2):159-68.
[14]李 影,陈镜宇,张玲玲,等.肿瘤坏死因子受体相关因子参与炎症免疫调节的研究进[J].中国药理学通报,2015,31(9):1206-10.
[15]Gardam S,Sierro F,Basten A,et al.TRAF2 and TRAF3 signal adapters act cooperatively to control the maturation and survival signals delivered to B cells by the BAFF receptor[J].Immunity,2008,28(3):391-401.
Conclusion CP-25 play important roles in immune regulation in AA rats through reducing the expression of BAFFR and TRAF2 in spleen.
Paeoniflorin-6′-O-tosylate ameliorate the immune response in adjuvant arthritis rat through BAFF-BAFFR downstream signalmolecule
Xu Shu,Wei Fang,Jia Xiaoyi,et al
(Institute of Clinical Pharmacology,AnhuiMedical University,Key Laboratory of Anti-inflammatory and Immune Medicine,Ministry of Education,Hefei 230032)
Objective To observe the expression profile of splenic B lymphocyte stimulating factor receptor(BAFFR)in adjuvant arthritis(AA)rats during the inflammation course of arthritis and the effects of Paeoniflorin-6′-O-tosylate(code:CP-25).Methods AA ratswere prepared using complete freund′s adjuvantand were divided into 8 groups randomly,including normal,AA,CP-25(25,50,100 mg/kg),methotrexate(0.5 mg/kg),total glucosides of paeony(TGP)(50 mg/kg),and paeoniflorin(Pae)group(50 mg/kg),and treated these groups from d17 to d31 after preparation of AA model.BAFF levels in peripheral blood were detected by ELISA;the expression of BAFFR during the inflammation course of AA rat in spleen was detected by flow cytometry.The effect of CP-25 on BAFFR in spleen was investigated through immunohistochemistry,Q-PCR and Western blot.The expression of tumor necrosis factor receptor associated factor(TRAF2)in rat spleen were detected by Western blot.Results Compared with the normal,the levels of BAFF in serum were increased in d9,d16,d23 and d30 AA model and the expressions of BAFFRmRNA and protein also increased obviously.CP-25(25,50,100mg/kg)could decrease the expression of BAFFRmRNA.In vitro,with the stimulation of BAFF,the expressions of TRAF2 and BAFFR in splenocyte were increased apparently,and CP-25(1×10-6mol/L)could decrease their expression significantly.
rheumatoid arthritis;adjuvant-induced arthritis;CP-25;BAFF;BAFFR;TRAF2
R 967
A
1000-1492(2016)05-0643-07
2016-02-22接收
国家自然科学基金资助项目(编号:81330081、81573443、31200675)
安徽医科大学临床药理研究所、抗炎免疫药物教育部重点
实验室、安徽抗炎免疫药物协同创新中心,合肥 230032
徐 澍,男,硕士研究生;
常 艳,女,副教授,硕士生导师,责任作者,E-mail:yychang@ahmu.edu.cn;
魏 伟,男,教授,博士生导师,责任作者,E-mail:wwei@ ahmu.edu.cn
