多重实时PCR检测腹膜透析相关性腹膜炎致病菌的应用分析
2016-09-10燕雯雯沈继录李晓峰吴永贵
燕雯雯,沈继录,李晓峰,吴永贵
多重实时PCR检测腹膜透析相关性腹膜炎致病菌的应用分析
燕雯雯1,沈继录2,李晓峰1,吴永贵1
目的 探讨多重实时PCR(RT-PCR)检测腹膜透析相关性腹膜炎(PDAP)致病菌的应用价值。方法 收集70例患者的腹透液标本,分别行传统细菌培养与荧光染料法细菌通用引物RT-PCR检测。根据70例样本培养结果及相关参考文献,选取最常见的6种PDAP致病菌作为检测菌,设计各检测菌特异引物,分别采用单一及多重荧光探针法RTPCR,针对通用RT-PCR法检出的阳性样本进行检测。结果
70例标本中传统培养46例阳性,阳性率为65.71%;通用RT-PCR法57例阳性,阳性率为81.43%,两种检测方法阳性率差异有统计学意义(P<0.05)。在6种常见致病菌检测中,对通用RT-PCR法检出的57例阳性样本行单一及多重RT-PCR检测,两者均检出38例样本在6种检测菌范围内,两种方法检测结果一致,1例RT-PCR结果与培养结果不符,剩余19例菌种在6种检测菌范围以外。通用RT-PCR可在4~6 h内明确是否存在细菌感染;针对6种致病菌的检测,单一RT-PCR可在6~9 h内完成,多重RT-PCR仅需3 h即可明确菌种。结论 与传统培养法比较,RT-PCR方法有较高灵敏性和特异性,多重RT-PCR因可同时检测多种致病菌,较单一RT-PCR更加迅速、简便、经济。
腹膜透析相关性腹膜炎;致病菌;实时荧光PCR;传统培养
网络出版时间:2016-4-19 11:04:48 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160419.1104.046.html
腹膜透析相关性腹膜炎是腹膜透析最常见的急性并发症及患者退出的重要原因。2010年国际腹膜透析协会指南(ISPD)认为血培养为腹膜透析相关性腹膜炎(peritoneal dialysis-associated peritonitis,PDAP)明确致病菌的最佳方式,单中心培养阴性率不应高于20%[1];而我国目前培养阳性率仅50.7%~69.9%[2-3],远低于标准。因此,如何快速、精准的检出致病菌是PDAP诊疗的关键问题之一。实时聚合酶链式反应(RT-PCR)是目前用于病原菌检测的最热门技术之一,有高灵敏度、特异性强、快速、简便以及可定量模板浓度等优点,已被广泛的应用于生物遗传、基因诊断、微生物分型鉴定等多个领域,并取得良好效果[4-6]。该实验旨在通过RT-PCR与传统培养在PDAP致病菌检出率的对比及单一、多重RT-PCR对PDAP常见的6种致病菌检出率的对比分析,初步探讨多重RT-PCR在临床检测PDAP致病菌中的应用价值。
1 材料与方法
1.1病例资料 收集2014年1月~2015年7月因PDAP入住安徽医科大学第一附属医院肾内科的患者腹透液标本。参照2010年ISPD指南[1],符合以下3条标准中的2条即可诊断为腹膜炎:①腹痛、腹透出液浑浊、伴或不伴发热;②透出液中白细胞计数大于100×106/L,中性粒细胞比例大于0.50;③透出液中培养有病原微生物生长。满足①与②诊断标准者作为本研究病例共70例,其中男33例,女37例,年龄18~73(49.94±13.11)岁,透析龄1~171(43.94±31.95)个月。
1.2方法
1.2.1传统细菌培养 可疑PDAP患者入院时即刻抽取腹透流出液(以首袋出现浑浊的透出液最佳,6 h内送检),送检腹透液常规,同时用血培养瓶(需氧及厌氧)留取透出液16~20 ml送检细菌培养。另留取250 ml透出液分装并行离心(4 000 r/ min、10 min)处理,弃上清液,保留沉淀分装至1.5 m l无菌离心管中,置于-80℃冰箱保存用于后续模板DNA制备。
1.2.2腹透液细菌DNA提取 按照HiPure Plasmid EF Micro Kit微量 DNA提取试剂盒操作步骤从标本中提取细菌DNA,用无菌双蒸水溶解后,用紫外线分光光度仪测吸光度(optical density,OD),计算OD260/OD280,在1.7~2.0范围内,说明DNA纯度较高。
1.2.3通用RT-PCR实验 参考文献[7],针对细菌16SrRNA基因保守片段,选用一对通用引物,上游引物序列为:5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物序列为:5′-ACGGCTACCTTGTTACGACTT-3′。使用SYBR Green 1荧光染料法进行检测,设立金黄色葡萄球菌的标准菌株DNA提取液为阳性对照,无菌DEPC水为阴性对照,每个样本设置3个重复孔以验证可重复性。反应体系为20μl,反应条件为:95℃预变性5 min;循环反应:95℃、10 s,60℃、33 s(收集荧光,循环40次);溶解曲线:95℃、15 s,60℃、60 s,95℃、15 s(收集荧光)。结果判定:在对照孔表达良好的前提下,荧光信号存在指数扩增期,且阳性扩增信号的最小拷贝数(CT值)≤32及溶解曲线呈现单峰,则判为PCR阳性。
1.2.4单一RT-PCR实验 参考文献[8-10]及本实验病例培养结果,确立6种细菌作为检测菌种,使用荧光探针法PCR进行检测,荧光探针法试剂购自常州博闻迪医药科技有限公司(各菌种引物及探针序列见表1),设立含各试验菌种靶基因片段的质粒为阳性对照,无菌DEPC水为阴性对照,反应体系为25μl,反应步骤设置如下:95℃预变性3 min;95℃变性10 s,58℃复性延伸40 s(收集荧光,循环40次)。结果判定:在对照孔表达良好的前提下,荧光信号若存在指数扩增期,且Ct值≤37则判为PCR阳性。
1.2.5多重RT-PCR实验 将6种检测菌分为两组:表皮葡萄球菌、金黄色葡萄球菌和溶血性葡萄球菌为一组,草绿色链球菌、大肠埃希菌和铜绿假单胞菌为一组。针对6种细菌分别设计一对通用引物及荧光探针(表2)。按上述分组行多重RT-PCR反应条件优化,建立适宜的反应体系和反应条件。设立含各细菌靶基因片段质粒为阳性对照,无菌DEPC水为阴性对照,反应体系为20μl,反应步骤设置如下:95℃预变性30 s;95℃变性5 s,60℃复性延伸32 s(收集荧光,循环50次)。结果判定:在对照孔表达良好的前提下,相应荧光通道收集的荧光信号出现指数扩增期,且Ct值≤37则判为PCR阳性。
1.3统计学处理 采用SPSS 16.0软件进行分析,计量资料以¯x±s表示,计数资料采用配对Χ2检验。
2 结果
2.1传统培养 70例样本中,腹透液培养的阳性率为 65.71%(46/70),革兰阳性球菌占71.74%(33/46),革兰阴性杆菌占28.26%(13/46);其中表皮葡萄球菌9例、金黄色葡萄球菌3例、溶血葡萄球菌10例、草绿色链球菌6例、大肠埃希菌5例、铜绿假单胞菌3例、肺炎克雷伯杆菌2例,头部葡萄球菌头部亚种、屎肠球菌、华纳葡萄球菌、腐生葡萄球菌、解没食子酸链球菌、产酸克雷伯杆菌、少动鞘氨醇单胞菌、深红沙雷氏菌均为1例。

表1 单一 RT-PCR各试验菌种引物及探针序列

表2 多重 RT-PCR各试验菌种引物及探针序列
2.2单一及多重RT-PCR
2.2.1通用 RT-PCR 70例样本中,通用RT-PCR检出57例阳性;46例培养阳性的样本中RT-PCR检出44例阳性,2例阴性;24例培养阴性的样本中,通用RT-PCR检测出13例阳性,11例为阴性;以培养法为金标准,通用RT-PCR阳性率为 81.43%(57/ 70),敏感性为95.65%(44/46),特异性为45.83%(11/24),假阳性率54.17%(13/24),假阴性率4.34%(2/46),行Χ2检验,两者阳性率比较差异有统计学意义(P=0.007)。扩增曲线见图1。
2.2.2单一RT-PCR 针对通用RT-PCR检出的57例阳性样本,行单一RT-PCR检测,检出38例样本菌种在6种检测菌范围内,1例与培养结果不符;19例单一RT-PCR检测未明确致病菌。部分扩增曲线见图2、3。
2.2.3多重RT-PCR 针对通用RT-PCR检出的57例阳性样本,行多重RT-PCR检测,检出38例样本菌种在6种检测菌范围内,1例与培养结果不符;19例多重RT-PCR检测未明确致病菌。本实验中6种检测菌的分布与单一RT-PCR检测结果一致,其中表皮葡萄球菌11例、金黄色葡萄球菌3例、溶血性葡萄球菌10例、草绿色链球菌6例、大肠埃希菌5例、铜绿假单胞杆菌3例;部分扩增曲线见图4。
3 讨论
目前检测PDAP致病菌的主要方式为血培养,尽管培养法较为准确,但耗时长,敏感性低,易受细菌生理条件、数量和抗生素使用等限制,致使常规培养阳性率较低。传统培养阳性率为65.71%,其中革兰阳性球菌占71.74%,仍以表皮葡萄球菌、金黄色葡萄球菌、大肠杆菌等为主,这与其他腹透中心近几年PDAP培养阳性率及细菌分布基本相符[9-10],但仍远低于ISPD指南中阳性率大于80%的建议。临床上在明确致病菌前,先给予经验性广谱抗生素治疗,但对于PDAP最佳初始治疗方案的选择目前国际上暂无明确共识[11];且长时程的超广谱抗菌素的使用可能改变细菌耐药性、增加二重感染及腹膜硬化等风险。如何快速灵敏的检出致病菌,指导抗生素的使用,是及时控制感染、保护腹膜功能的关键。
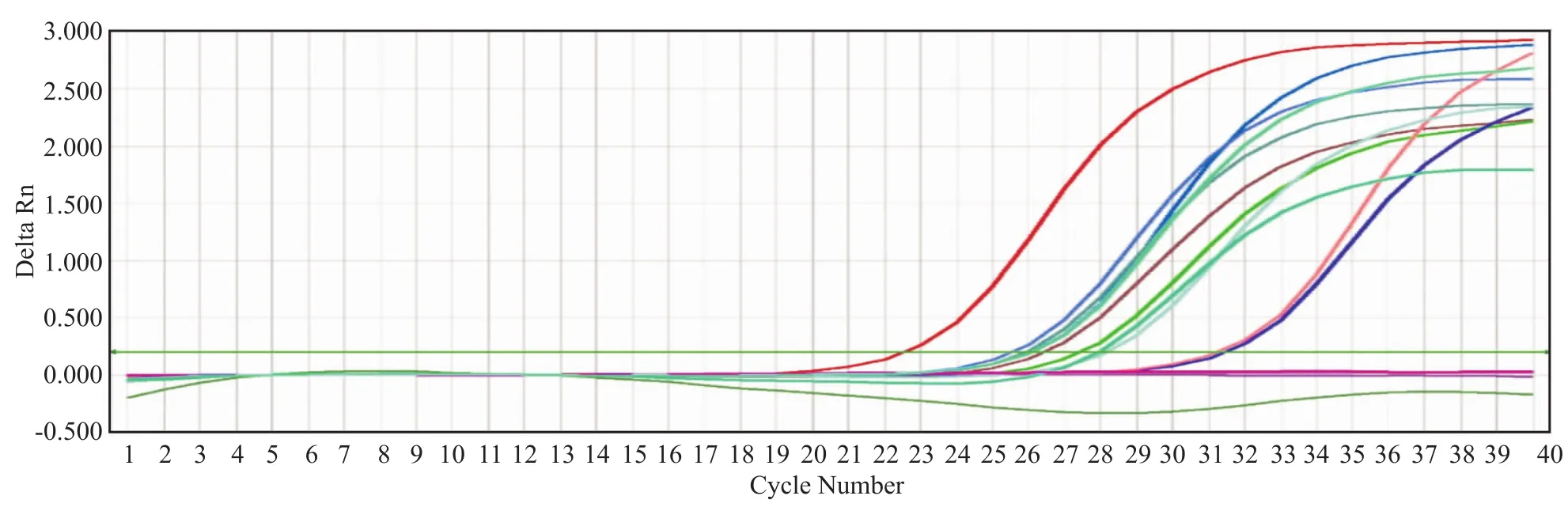
图1 腹透液样本通用 RT-PCR扩增图

图2 表皮葡萄球菌阳性样本单一 RT-PCR扩增曲线
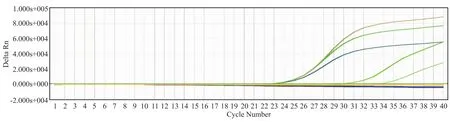
图3 金黄色葡萄球菌阳性样本单一RT-PCR扩增曲线

图4 腹透液样本多重 RT-PCR扩增曲线
PCR对于病原微生物的检测不依赖于微生物表型标记、酶学等方法,而是直接对于微生物保守基因片段进行特异扩增,因此更加快速灵敏特异。实验中70例样本,通用RT-PCR阳性率为81.43%,与传统培养阳性率比较,两者差异有统计学意义。以传统培养为金标准,通用RT-PCR敏感性为95.65%,特异性为 45.83%,具有较高的灵敏度。且通用RT-PCR在4~6 h内即可明确有无细菌感染,较传统培养耗时明显缩短。实验中,对于46例培养阳性的样本中有2例通用RT-PCR反复检测3次均为阴性,考虑可能在培养过程中样本被污染,或在样本原液保存、DNA提取及保存过程中DNA被破坏、分解,亦或是样本中存在抑制PCR反应的物质,在细菌DNA被提取后该抑制作用仍然存在。有文献[12-13]报道,在血液、粪便、尿液中存在PCR反应的抑制物,如脂多糖、肝素能干扰Taq聚合酶的作用;这种抑制可减小PCR的灵敏度,提高假阴性结果;改变样本保存温度、模板DNA浓度及提取方法可减少抑制作用,但不能完全消除。对于24例培养阴性的样本,有13例通用RT-PCR阳性,这可能与PCR技术的高灵敏度相关,在样本所含的细菌量极少时,传统培养检出的难度增大,但PCR通过指数扩增可检出含量极少的细菌。此外,其还可对已使用过抗生素样本、苛养菌、疑难菌株、死菌、生化反应及形态改变的细菌进行鉴定。因荧光染料法PCR无特异性,只要出现扩增即可收集到荧光,若操作过程中有极少量的DNA、气溶胶等污染均可出现非特异性扩增,提高假阳性率;但暂无更为有效的检验手段,用以明确这13例样本是否存在假阳性的可能。
与染料法PCR不同的是探针法PCR在保证普通PCR高灵敏度的基础上,在反应体系中添加了探针,增加了实验的特异性,用于鉴定细菌种类比染料法更为可靠。在探针法PCR的57例样本中,两种RT-PCR均检出38例样本,其中1例传统培养结果为金黄色葡萄球菌,RT-PCR结果为溶血性葡萄球菌,考虑可能在样本培养过程中混入金黄色葡萄球菌,大量繁殖并作为优势菌抑制其他细菌生长所致;其余19例样本可能因实验检测范围较窄,致病菌种类不在检测范围内,后期实验中可扩大菌群检测范围,以便更大程度上明确菌种。该试验中单一RT-PCR完成6种致病菌检测所用时间为6~9 h,而多重RT-PCR仅需2~3 h即可完成。且单一RT-PCR需对同一样本反复检测,不但工作量大幅增加,检测周期延长,同时增加了失误概率及样本污染、样品生物危害等风险,对检测结果的可靠性亦有影响[14]。多重RT-PCR虽在时效性及操作简便等方面有明显优势,但其要求多个不同靶基因片段同时扩增,因而在引物设计、反应条件的优化、反应体系的配置等环节均需反复试验,建立最佳反应条件,以期最大程度上避免非特异性扩增及片段间的竞争性扩增,实现高效灵敏、特异性强的扩增反应,具有一定难度。
与传统培养法比较,RT-PCR技术鉴定病原菌具有较高的灵敏度,且检测周期明显缩短。多重RT-PCR因可同时检测多种致病菌,比单一RT-PCR检测更迅速、简便,且更节约成本;在PDAP细菌鉴定中有一定的临床应用价值,有望与传统培养相结合成为全面、客观认识PDAP致病菌的新途径。
[1] Li PK,Szeto CC,Piraino B,etal.Peritonealdialysis-related infections recommendations:2010 update[J].Perit Dial Int,2010,30(4):393-423.
[2] 黎 伟,杨桢华,廖蕴华,等.腹膜透析相关性腹膜炎的菌谱及其耐药性分析[J].广东医学,2013,34(14):2227-9.
[3] 刘 华,杨 敏,高小夏,等.腹膜透析相关性腹膜炎的致病菌及其耐药性分析[J].江苏医药,2014,40(11):1309-11.
[4] PaolucciM,LandiniM P,Sambri V.Conventional andmolecular techniques for the early diagnosis of bacteraemia[J].Int JAntimicrob Agents,2010,36 Suppl2:S6-16.
[5] 侯瑞生,王 丽,张 勤,等.多重PCR技术及其在病原体检测中的应用[J].中华全科医学,2011,9(8):1288-90.
[6] 陈明洁,方 倜,柯 涛,等.多重PCR—一种高效快速的分子生物学技术[J].武汉理工大学学报,2005,27(10):33-6.
[7] Dabiri H,AzimiRad M,Tavafzadeh R,etal.Bacteriologic study of cirrhotic patients with non-neutrocytic ascites[J].Gastroenterol Hepatol Bed Bench,2014,7(4):224-9.
[8] 雷 蕾,刘冠贤,黄成文,等.腹膜透析相关性腹膜炎239例次致病菌菌谱及药敏分析[J].广东医学,2014,35(5):729-31.
[9] 赵 珉,戴 宏,沈继录,等.132例腹膜透析相关性腹膜炎病原菌及其耐药性分析[J].中国感染与化疗杂志,2015,15(3):236-43.
[10]张连云,刘向东,张 燕,等.68例次持续性非卧床腹透腹膜炎临床分析[J].中国实用医学,2010,5(18):131-3.
[11]Barretti P,Doles JV,Pinotti D G,et al.Evidence-based medicine:An update on treatments for peritoneal dialysis-related peritonitis[J].World JNephrol,2015,4(2):287-94.
[12]沈克锋,杨 默,江千里.血液和骨髓标本中常见PCR反应抑制物的探究与分析[J].中国实验血液学杂志,2014,22(3):842-6.
[13]Toye B,WoodsW,Bobrowska M,etal.Inhibition of PCR in genital and urine specimens submitted for chlamydia trachomatis testing[J].JClin Microbiol,1998,36(8):2356-8.
[14]张平平,王浩然,郭兆彪,等.多重生物检测技术研究进展[J].军事医学,2012,36(9):713-7.
Application analysis ofmultiplex real-time PCR assays for detection of pathogenic bacterium in peritoneal dialysis-associated peritonitis
Yan Wenwen1,Shen Jilu2,Li Xiaofeng1,et al
(1Dept of Nephrology,2Dept of Clinical Laboratory,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
Objective To estimate the clinical value of bacterial detection in peritoneal dialysis-associated peritonitis(PDAP)by multiplex real-time polymerase chain reaction(RT-PCR).Methods Seventy peritoneal dialysate specimenswere collected,conventional bacterial culture and SYBR Green RT-PCR detection of the bacterial universal primerswere used respectively.According to references and the bacterial culture results of these 70 specimens,six common bacteria of PDAP were selected in this assay,multiplex and monoplex RT-PCR were used respectively to exam the positive specimens by SYBR Green RT-PCR detection.Results The positive rate of traditional culture among the 70 caseswas65.71%.The SYBR Green RT-PCR detection results showed that70 specimens total positive rate was 81.43%,and there was statistical difference between the twomethods(P<0.05).In the detection of these 6 common pathogenic bacteria,both multiplex and monoplex RT-PCR assays found 38 cases of positive samples among the 57 specimens detected by SYBRGreen RT-PCR.The results of the twomethodswerecompletely identical.One of the positive samples examined by RT-PCR was different form classical bacterial culture,and the remaining 19 cases failed to clear strains of pathogenic bacteria.SYBRGreen PCR for detecting pathogenic bacteria could show results in 4~6 hours,and in the experiments of the 6 common bacteria,monoplex RTPCR could be finished in 6~9 hours,butmultiplex RT-PCR just needed atmost3 hours.Conclusion Compared with the traditional culturemethod,all of the three RT-PCR assays are sensitive,specific,and more rapidly.The multiplex RT-PCR can detect several kinds of bacteria simultaneously,bemore practical,convenient and economical than that of themonoplex RT-PCR.
peritoneal dialysis-associated peritonitis;pathogenic bacteria;real-time polymerase chain reaction;bacteria cultures
R 459.51;R 372
A
1000-1492(2016)05-0712-06
2016-02-22接收
安徽省自然科学基金资助(编号:1408085MH183)
安徽医科大学第一附属医院肾内科,合肥 230022
燕雯雯,女,硕士研究生;
吴永贵,男,教授,主任医师,博士生导师,责任作者,E-mail:wuyonggui@medmail.com.cn
