陆地棉低毒Bt基因对棉铃虫抗性的遗传效应分析
2016-09-09陈旭升狄佳春
陈旭升,狄佳春,赵 亮
(江苏省农业科学院 经济作物研究所/农业部 长江下游棉花与油菜重点实验室,江苏 南京 210014)
陆地棉低毒Bt基因对棉铃虫抗性的遗传效应分析
陈旭升,狄佳春,赵 亮
(江苏省农业科学院 经济作物研究所/农业部 长江下游棉花与油菜重点实验室,江苏 南京 210014)
以Bt低毒表达的陆地棉种质系WG-20为试验材料,与若干Bt高毒表达的抗虫棉品系配制杂交组合,对其F1的Bt毒蛋白表达量、生物学抗虫性进行了分析。结果显示: Bt低毒表达性状对高毒表达性状表现为显性,生物学抗虫性也是低抗性状对抗级性状表现为显性,即低毒Bt基因对高毒Bt基因表现为显性抑制现象; Bt高毒表达材料之间杂交组合的F1则呈现Bt高毒表达,生物学抗性表达规律也是如此,即高毒Bt基因间不存在同源Bt基因表达的沉默现象。
陆地棉;低毒Bt基因;抗虫性;遗传效应
我国棉花的生产与消费在国计民生中的地位举足轻重。鳞翅目害虫一直严重危害棉花生产。从20世纪80年代末至90年代初,棉铃虫在我国主产棉区持续性大暴发,给棉花生产造成了灾难性的损失,仅1997年在长江流域棉区净减产就约达10万t,黄河流域棉区净减产则高达152万t,造成的经济损失近100亿元[1]。传统的作物育种技术无法从根本上解决抗棉铃虫的难题。而自20世纪90年代以来,转基因技术通过导入外源抗虫基因再结合传统育种技术,在棉花抗虫育种方面取得了巨大成功。转基因抗虫棉除对棉铃虫等鳞翅目害虫具有显著的抑制与毒杀作用外,还可以降低棉铃虫等害虫的虫口基数,从而使棉花受棉铃虫的危害大大降低。同时,种植抗虫棉,因大大减少了棉田农药喷施,使高温季节棉农中毒概率急剧下降,不但保护了棉田生态环境,也有效地保障了棉农在棉田作业中的生命安全[2-4]。
相关研究业已表明:转基因抗虫棉的抗性维系,一方面取决于Bt毒蛋白的表达剂量,另一方面取决于棉花群体的抗虫性纯度[5-6]。Bt基因低毒蛋白的表达易诱导鳞翅目昆虫产生抗性,从而可能使棉花抗虫性体系崩塌。因此,我国转基因棉花品种的生产应用安全性评价,对抗虫棉毒蛋白的表达量极为关注,并作为一个品种能否通过安全性评价的重要依据。本研究以一个高产但Bt基因低毒表达的陆地棉品系WG-20为试验材料,将其与Bt高毒表达的抗虫棉品系进行杂交,分析了杂交后代毒蛋白表达的遗传效应与生物学抗虫性,旨在为转基因抗虫棉的遗传育种与生产安全应用提供参考依据。
1 材料与方法
1.1试验材料
本实验采用5个抗虫棉种质系:WG-20、SM-14、L1138、SM037、K047,其中WG-20为Bt低毒表达亲本,其余为Bt高毒表达亲本。然后配制5个杂交组合:SM-14×WG-20、WG-20×L1138、SM037×WG-20、SM037×L1138、SM037×K047。
1.2试验方法
1.2.1毒蛋白含量的测定在花蕾期,取各亲本与杂交组合的顶部小真叶,对每个材料随机取5片,然后磨样、称重。毒蛋白的定量测定采用Bt(Cry1Ab/Ac)ELISA试剂盒,按说明书中的方法进行。每个材料测定3次,取平均值。
1.2.2生物学抗虫性的测定棉铃虫抗性鉴定在江苏省农科院植保所进行。从棉田采集棉铃虫,在恒温养虫室内用人工饲料饲养形成标准虫种。养虫室内温、光条件:每日光照16 h,温度为26 ℃。试验开始于7月13日,取羽化后室内交配2 d的棉铃虫蛾,用于棉田罩笼接蛾鉴定试验:在每个罩笼中接入棉铃虫蛾75对,任其产卵为害;于接蛾后第10天、14天,两次检查记载蕾铃总数、被害蕾铃数、棉铃虫活虫数与活虫龄期等,每重复每品种检查10株。
抗性评判:将各品种单次表现“高抗”的抗性值赋为4,表现“抗”的赋为3,“低抗”的赋为2,“不抗”的赋为1,累计各项次鉴定的抗性值,取平均数,得到该品种的平均抗性值(PK)。综合评判的抗性等级根据PK值的大小来量化,其抗级评判标准为: PK≤1.5,不抗;1.5
1.2.3杂交育种实践以WG-20为亲本,与高毒Bt抗虫亲本J668杂交,配制组合WG-20×J668。该杂交组合于2012年参加了江苏省棉花区域试验。试验方法与结果统计按江苏省区试试验方法进行。该年度参试的杂交组合共计12个,对照为抗虫杂交棉“泗杂3号”。全省布8个试点(大丰、东台、东辛、灌云、六合、射阳、太仓、盐城)。随机区组排列,3次重复,小区面积20 m2。江苏省农业科学院植保所进行抗棉铃虫、抗病性鉴定,农业部棉花品质监督检测测试中心检测纤维品质。
2 结果与分析
2.1亲本及其杂交F1的Bt毒蛋白表达量
前人的研究显示,外源Bt基因在杂交后代呈简单的显性质量遗传方式[7-10];但迄今未见低毒Bt基因与高毒Bt基因之间的显隐性关系的研究报道。本研究将低毒Bt表达亲本与高毒Bt表达亲本杂交,以及在高毒Bt表达亲本之间进行杂交,测定各亲本及其杂交F1的Bt毒蛋白表达量,将测定结果列于表1。由表1可见:亲本WG-20属于Bt低毒表达,毒蛋白平均值为88.8 ng/g;其余亲本SM-14、L1138、SM037和K047为Bt高毒表达,它们的毒蛋白表达量分别为1997.5、520.4、1348.7、1928.4 ng/g。
从表1还可以看出:(1)以低毒Bt表达亲本WG-20所配的3个杂交组合SM-14×WG-20、WG-20×L1138、SM037×WG-20,不管WG-20作为父本还是母本,其F1均为Bt低毒表达。其中杂交组合SM-14×WG-20 F1的Bt毒蛋白表达量为245.2 ng/g,只有高毒亲本表达量的12.3%、中亲值的23.5%。组合WG-20×L1138 F1的Bt毒蛋白表达量为154.1 ng/g,只有高毒亲本表达量的29.6%、中亲值的50.6%。组合SM037×WG-20 F1的Bt毒蛋白表达量为191.2 ng/g,只有高毒亲本表达量的14.2%、中亲值的26.6%。以上结果表明低毒Bt对高毒Bt的表达在遗传上呈现显性抑制效应;(2)高毒Bt亲本间的2个杂交组合,其F1均呈现Bt毒蛋白的高表达,其中组合SM037×K047 F1的Bt毒蛋白表达量为1826.6 ng/g,为高毒亲本表达量的94.7%、中亲值的111.5%。组合SM037×L1138 F1的Bt毒蛋白表达量为1318.0 ng/g,为高毒亲本表达量的97.7%、中亲值的141.0%。以上结果表明高毒Bt基因间的表达在遗传上并不存在同源Bt基因间的抑制效应。
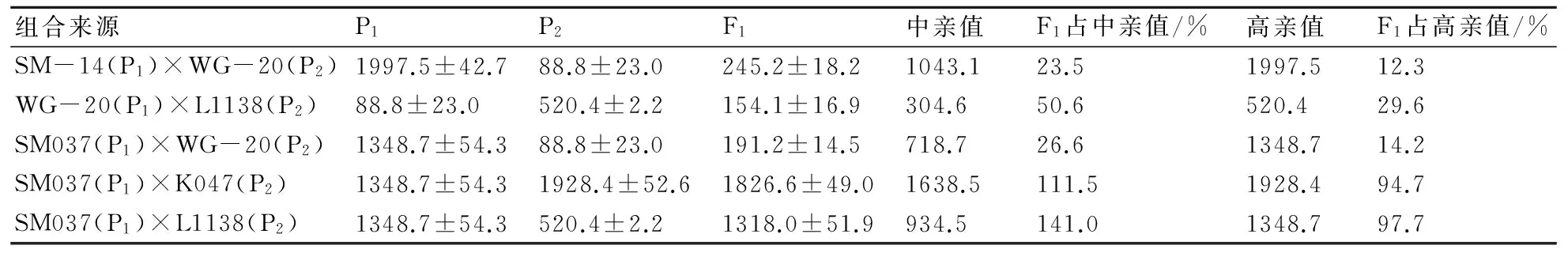
表1 亲本与杂交F1叶片样品的Bt毒蛋白表达量 ng/g
2.2亲本及其杂交F1的生物学抗虫性表现
由于棉铃虫的为害主要在棉花蕾铃期,因此Bt抗虫棉在蕾铃期对棉铃虫的抗性显得尤为重要。蕾铃期的生物学抗虫性鉴定采用田间罩笼接蛾法,将试验结果列于表2。由表2可见:以低抗亲本WG-20与抗性亲本SM-14、L1138、SM037杂交,其杂交F1的生物学抗虫性均表现为低抗;而抗性亲本SM037与抗性亲本L1138、K047杂交,其F1的生物学抗虫性则均表现为抗;而常规棉对照苏棉9号对棉铃虫的抗性为“感”。以上结果表明: Bt低抗性状对抗级性状的表达表现为显性抑制效应;而在Bt抗级性状间则不存在同源Bt基因的抗性沉默效应,其杂交F1仍表现为抗级。

表2 抗虫亲本及其杂交F1在蕾铃期的生物学抗虫性
注:在综合抗性级别栏中,HR代表高抗, R代表抗,LR代表低抗,S代表感或不抗。
2.3杂交育种实践验证结果
以大铃高衣分陆地棉种质系WG-20为亲本,与高毒Bt抗虫亲本J668配制杂交棉组合:WG-20×J668。该组合参加了2012年的江苏省杂交棉区域试验。
试验结果:该杂交棉生育期130 d。株形紧凑,株高113.2 cm,果枝较长、平展,茎秆粗壮,茸毛较少,叶片较大,叶色较深,果枝始节位6.9节,单株结铃数29.1个,铃卵圆形,单铃重6.5 g,衣分40.7%,子指11.4 g,霜前花率88.0%,僵瓣率10.1%。出苗好,长势较强,吐絮畅。在病圃接种鉴定中表现为耐枯萎病和耐黄萎病(枯萎病病指16.2,黄萎病病指33.1)。在纤维品质测试中, HVICC纤维上半部平均长度为30.6 mm,断裂比强度32.7 cN/tex,马克隆值5.3,断裂伸长率5.6%,反射率78.1%,黄色深度7.2,整齐度指数86.2%,纺纱均匀性指数154。籽棉和皮棉产量分别为3807.0、1552.5 kg/hm2,分别比对照泗杂3号增产9.1%、4.3%,增产幅度均达极显著水平,居12个参试组合的第2位。在生物学抗虫性鉴定中,该杂交棉平均抗性值PK为2.08,表现为低抗。
试验结论:该杂交棉籽棉、皮棉产量高,铃大、衣分高,纤维品质较好;但因其生物学抗虫性检测结果为低抗棉铃虫,基于抗虫棉生产应用安全性的考量,决定将其淘汰,不再进入下一轮区试。
3 讨论
对于转Bt基因抗虫棉,国内外已有很多研究报道;但不同抗虫棉的Bt基因是否可能存在同源基因表达的抑制现象;不同转基因事件之间的同源Bt基因序列重复是否会引起基因沉默,这些问题尚存争议。有研究者认为在同一个体中,如果同时存在多个同源的外源基因,不管是转化后再次得到的,还是通过有性杂交获得的,这些外源基因的表达都会受到抑制[11-12]。也有研究者认为情况并非如此,外源基因的表达具有剂量与累加效应:单拷贝插入的高表达株间相互杂交,其F1代的转基因活性与双亲相当,在F2代分离群体中,各单株的转基因活性随拷贝数多少而呈叠加性效应[13-14]。唐灿明等(1997)[7]曾利用3个抗虫亲本配制杂交组合,其杂交F1的抗虫性与亲本类似,表明抗虫基因在杂合状态下无共抑制现象存在。
本研究涉及1个低毒Bt基因,研究显示WG-20中的低毒Bt基因在F1呈显性表达,毒蛋白含量低,即低毒Bt基因对高毒Bt基因的表达具有显性抑制效应。由此可见,前人有关同源Bt基因之间沉默效应的报道,是否可能是某些低毒表达转化事件对高毒表达转化事件产生的显性抑制效应,从而在表型上表现为同源Bt基因的抑制或基因沉默效应,这个问题值得进一步甄别澄清。也许所谓某些同源Bt基因之间的表观沉默效应,可能只是由Bt低毒表达基因对高毒表达基因的显性抑制效应所致。这就提示我们:在转基因过程中,对获得的低剂量表达转化事件要及时予以剔除;否则很容易对后续的高表达转化事件基因产生显性抑制作用,在表观上呈现所谓的基因沉默效应。
本研究使用的亲本WG-20,虽然Bt毒蛋白为低毒表达,但其综合农艺性状优良,并具有大铃、高衣分特点(平均单铃重达6.31 g,衣分高达44.3%),因此常被我们用做杂交育种亲本。然而,低毒抗虫棉的Bt基因由于在杂交后代呈显性表达,在育种上是一个很不利的性状。因此当利用某些低毒Bt基因的优良种质系作为杂交亲本时,建议在大田不治虫条件下对其杂交分离群体进行抗虫性筛选,将不抗虫或抗虫性差的材料在大田及时淘汰,这样可以防止低毒Bt基因的不经意扩散,而将抗虫性强的转基因材料保留下来,从而有效保障创制的抗虫棉新种质具有高效的抗虫性与育成抗虫棉的生产应用安全。
[1] 何忠伟,周文新,陈艳芬,等.中国转基因抗虫棉发展的现状与对策[J].科技和产业,2004,4(11):27-30.
[2] 陈旭升,狄佳春,刘剑光,等.转基因棉花育种进展及其产业化前景分析[J].中国农学通报,2002(2):72-74.
[3] 郭三堆,王远,孙国清,等.中国转基因棉花研发应用二十年[J].中国农业科学,2015,48(17):3372-3387.
[4] 戴茂华,刘丽英,郑书宏,等.河北省转基因抗虫棉遗传改良成效分析[J].江西农业学报,2015,27(1):1-5.
[5] 陈旭升,狄佳春,宋锦花,等.抗虫棉群体Npt-Ⅱ标记基因纯度与其抗虫性强度的相关分析[J].棉花学报,2004,16(3):137-141.
[6] 陈旭升,狄佳春,许乃银,等.转基因抗虫棉育种及良种繁育技术研究进展[J].江西农业学报,2007,19(3):14-16.
[7] 唐灿明,朱协飞,张天真,等.转Bt基因抗虫棉R19品系的棉铃虫抗性表现及抗虫性遗传研究[J].农业生物技术学报,1997,5(2):194-200.
[8] 李汝忠,沈法富,王宗文,等.转Bt基因抗虫棉抗虫性遗传研究[J].棉花学报,2001,13(5):268-272.
[9] 袁小玲,唐灿明,张天真.转Bt+CpTI双价基因抗虫棉棉铃虫抗性的遗传分析[J].棉花学报,2001,13(6):342-345.
[10] Bakhsh A, Rao A Q, Shahid A A, et al. CaMV35S is a developmental promoter being temporal and spatial in expression pattern of insecticidal genes (Cry1Ac & Cry2A) in cotton [J]. Aust J Basic Appl Sci, 2010(4): 37-44.
[11] Flavell R B. Inativation of gene expression in plant as consequence of specific sequence duplication [J]. Proc Natl Acad Sci USA, 1994, 91: 3490-3491.
[12] 郭旺珍,孙敬,郭玉芳,等.转基因抗虫棉Bt基因不同剂量的聚合与抗虫性表现[J].遗传学报,2001,28(7):668-676.
[13] Hobbs S L A, Warkentin T D, DeLong C M O. The effect of T-DNA copy number, position and methylation on reporter gene expression in tobacco transformation [J]. Plant Mo1 Biol, 1990, 5: 851-864.
[14] Hobbs S L A, Warkentin T D, DeLong C M O. Transgene copy number can be positively or negatively associated with transgene expression [J]. Plant Mol Biol, 1993, 21: 17-26.
(责任编辑:黄荣华)
Genetic Effect Analysis of Resistance of An Upland Cotton with Low-toxic Bt Gene to Cotton Bollworm
CHEN Xu-sheng, DI Jia-chun, ZHAO Liang
(Institute of Industrial Crops, Jiangsu Academy of Agricultural Sciences / Key Laboratory of Cotton and Rape in Lower Reaches of Yangtze River, Ministry of Agriculture, Nanjing 210014, China)
In this study, the upland cotton germplasm WG-20 with low-toxic Bt gene was used as experimental material. Several hybrid combinations were made by crossing between WG-20 and some high-toxic-Bt insect-resistant cotton strains. The expression level of Bt toxalbumin, and the biological insect-resistance in F1were analyzed. The results showed that the expression character of low-toxic Bt was dominant to that of high-toxic Bt, and the character of low insect-resistance was also dominant to that of high insect-resistance, namely the expression of low-toxic Bt gene dominantly inhibited to the expression of high-toxic Bt gene. The expression of high-toxic Bt gene was found in the F1of hybrid combinations from high-toxic Bt cotton strains, and so was the expression of biological insect-resistance, namely the silent expression of homologous Bt gene did not exist among high-toxic Bt genes.
Upland cotton; Low-toxic Bt gene; Insect resistance; Genetic effect
2016-03-07
高产转基因棉花新品种培育科技重大专项子课题(2014ZX08005-001);转基因生物新品种培育重大专项子课题(2016ZX08005-005)。
陈旭升(1965─),男,浙江乐清人,研究员,博士,主要从事棉花抗病虫遗传育种工作。
S435.622.9
A
1001-8581(2016)08-0001-04
