改进的流式细胞积分对骨髓增生异常综合征诊断价值的研究
2016-09-08郭进京王会平熊术道翟志敏
郭进京,王会平,熊术道,孙 磊,翟志敏
改进的流式细胞积分对骨髓增生异常综合征诊断价值的研究
郭进京1,2,3,王会平1,2,熊术道1,2,孙磊1,2,翟志敏1,2
筛选94例患者评价改进的流式细胞术(FCM)积分在骨髓增生异常综合征(MDS)中的诊断效能。用抗体组合CD34/CD19/CD33/CD45分析四参数流式积分,通过CD19和CD33将B系和髓系前体细胞分离。对疑为MDS的患者行流式积分,评价两种方法的诊断参数。改进的积分有更高的诊断参数。11例通过改进的方案改变积分,其中5例因积分改变获得正确诊断。改进积分实用方便,更好地分离B系和髓系前体细胞。
骨髓增生异常综合征;流式细胞术;免疫表型
网络出版时间:2016-5-9 15:43:11 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160509.1543.066.html
骨髓增生异常综合征(myelodysplastic syndromes,MDS)是一组克隆性源于造血干细胞的髓样肿瘤[1]。有较高的风险演变为急性髓系白血病[2]。其年发病率每10万人口约为5例,60岁后年发病率增至每10万人口约20~50例[3]。MDS诊断主要依靠骨髓形态学检测病态造血和细胞遗传学克隆性改变及其他的异常,如骨髓铁染色环形铁粒幼细胞≥15%[4],但低危MDS患者半数初诊时无上述异常。流式细胞术(flow cytometry,FCM)分析细胞免疫表型的异常可弥补形态学和遗传学的不足,多个研究[5]组织标准化操作流程用FCM对MDS进行诊断,表明FCM检测细胞发育不良比形态学更敏感。Della Porta et al[6]整合多中心实验室数据制定了FCM积分四参数评分MDS,具有很高的诊断效能。该研究通过一组抗体组合,改进设门方案来评估FCM积分四参数,并评估改进方案的临床诊断效能。
1 材料与方法
1.1病例资料 收集安徽医科大学第二附属医院血液科因外周血一系或多系减少而就诊的患者108例,行细胞形态学、染色体以及铁染色等检查,同时行FCM积分方案分析。参照维也纳最低诊断标准和2008年WHO分型[4,7]对疑为MDS的患者进行诊断和分类。首次检测47例符合MDS确定标准,30例为非克隆性血细胞减少,31例为意义未明的特发性血细胞减少症(idiopathic cytopenia of uncertain significance,ICUS)。31例ICUS患者随访6个月,其中7例诊断为MDS;10例失访;11例为非MDS,其中1例因CD34+细胞过少而剔除;3例为慢性单核细胞白血病。最终确诊54例MDS患者和40例非MDS患者,并纳入研究,其中MDS患者男33例,女21例;年龄20~86岁,中位年龄66岁。非MDS患者男25例,女15例;年龄22~81岁,中位年龄64岁。MDS和非MDS组患者年龄差异无统计学意义(t=1.557,P=0.123)。诊断资料见表1。
1.2FCM积分方案的流式分析
1.2.1样本制备 抽取新鲜骨髓,肝素抗凝,加入抗体组合,避光孵育,氯化铵溶血,上机测试。所用的抗体组合为CD34-FITC、CD19-PE、CD33-APC、CD45-PC7,所有抗体购自美国Beckman Coulter公司,使用FC500 MPL流式细胞仪(美国Beckman Coulter公司)进行分析,分析软件为EXPO 32 Multi-Comp software(美国Beckman Coulter公司)。每测试管至少计数105个有核细胞和500个CD34+细胞。
1.2.2设门策略 用上述抗体组合进行分析,设门。如图1所示:①在FSC和SSC散点图上,设P1门去除细胞碎片,代表全部有核细胞。在P1门中选择SSC较小的细胞群设为P2门;②P2门中的细胞表达在CD34和CD45的散点图上,设置CD34+CD45dim的细胞为P3门,代表原始细胞群;③P3门中的细胞表达在CD19和CD33的散点图上,CD33+CD34+CD45dim代表髓系前体细胞:D门,CD19+CD34+CD45dim代表B系前体细胞:C门,此为本研究改进的设门方案;④P3门中的细胞表达在CD45和SSC的散点图上,其中表达更低的SSC和CD45的细胞群为B系前体细胞:P5门,剩余的细胞为P4门为髓系前体细胞,此为参考文献的方法分离B系和髓系前体细胞;⑤P1门中的全部有核细胞表达在CD45和SSC的散点图上,P6代表淋巴细胞,P7代表粒细胞;⑥淋巴细胞CD45的平均荧光强度;⑦髓系前体细胞CD45的平均荧光强度;⑧粒细胞SSC的峰值强度;⑨淋巴细胞SSC的峰值强度。
1.3评分标准 根据文献[6]评分标准如下:髓系前体细胞和有核细胞的比值≥2%(参数1);B系前体细胞和CD34+细胞的比值≤5%(参数2);淋巴细胞和髓系前体细胞CD45平均荧光强度的比值≤4或≥7.5(参数3);粒细胞和淋巴细胞SSC峰值的比值≤6(参数4)。每个参数符合标准计分为1分,不符合为0分,总积分≥2诊断为MDS。
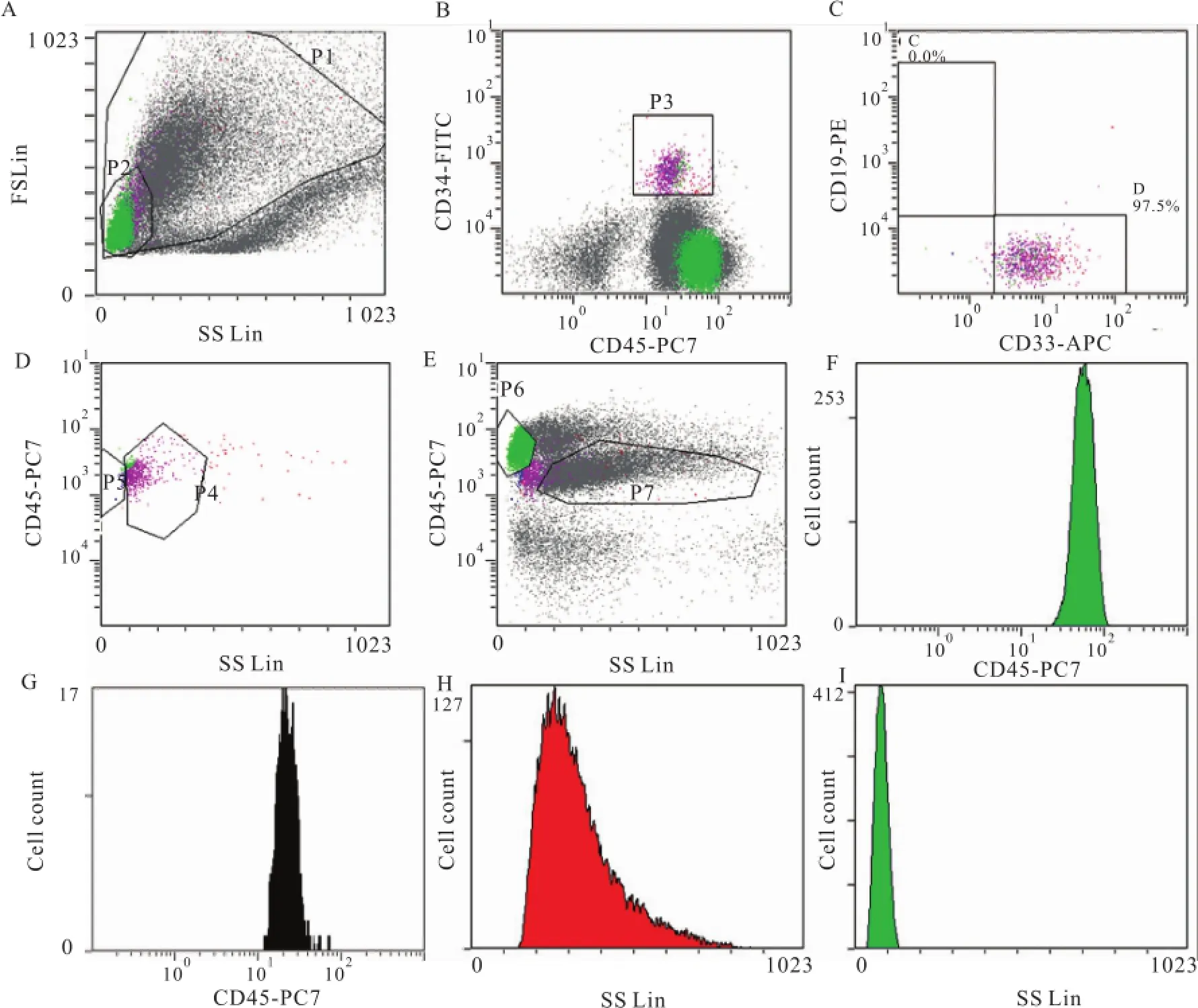
图1 抗体组合CD34/CD19/CD33/CD45分析FCM积分四参数A:全部有核细胞P1和低SSC表达的P2;B:P2在CD34和CD45中的表达,CD34+CD45dim为P3;C:P3在CD19和CD33中的表达,此为改进方案分离髓系和B系前体细胞;D:P3在CD45和SSC中的表达,此为文献方案分离髓系和B系前体细胞;E:P1在CD45和SSC中的表达,P6为淋巴细胞,P7为粒细胞;F:淋巴细胞CD45的平均荧光强度;G:髓系前体细胞CD45的平均荧光强度;H:粒细胞SSC的峰值强度;I:淋巴细胞SSC的峰值强度

表1 患者诊断结果(n)
1.4统计学处理 采用SPSS 17.0软件进行分析。如参数为正态分布,两组均数比较用独立样本t检验,非正态分布的差异比较采用Z检验。使用配对四格表Χ2检验比较两种方案诊断94例患者资料的差异。
2 结果
2.1MDS组和非MDS组人口资料和四参数分析
MDS组中位积分和中位参数1明显高于非MDS组,而中位参数2和中位参数4均明显低于非MDS组,两组中位参数3差异无统计学意义,但统计显示MDS组中位参数3结果不符合高斯分布,正态性检验P=0.033,而非MDS组为高斯分布,正态性检验P=0.791。见表2。

表2 MDS组和非MDS组患者人口资料和四参数分析
2.2改进的FCM积分和文献FCM积分诊断效能的比较
2.2.1改进的FCM积分诊断MDS的效能 以≥2分诊断为MDS,54例MDS中有52例诊断正确,敏感性为96.3(49/54),40例非MDS中有5例≥2分,特异性为87.5%(35/40)。诊断符合率为92.6%[(52+35)/(54+40)]。阳性似然比和阴性似然比分别为7.7[敏感性/(1-特异性)]和0.04[(1-敏感性)/特异性]。
2.2.2参考FCM积分诊断MDS的效能 按参考方法进行评分,54例MDS中49例诊断符合,敏感性为90.7%,40例非MDS中7例≥2分,特异性为82.5%,诊断符合率为87.2%,阳性似然比和阴性似然比分别为5.2和0.1。
2.2.3配对四格表比较两种FCM积分的诊断效能两种方案分别对94例患者进行评分,以≥2分为界,诊断为MDS,采用配对设计四个表的Χ2检验比较两种积分的诊断效能是否有差异。两种积分方案诊断MDS差异无统计学意义(Χ2=74.343,P= 1.000),且两种方案有很强的诊断吻合度(k= 0.889,P=0.000)。见表3。
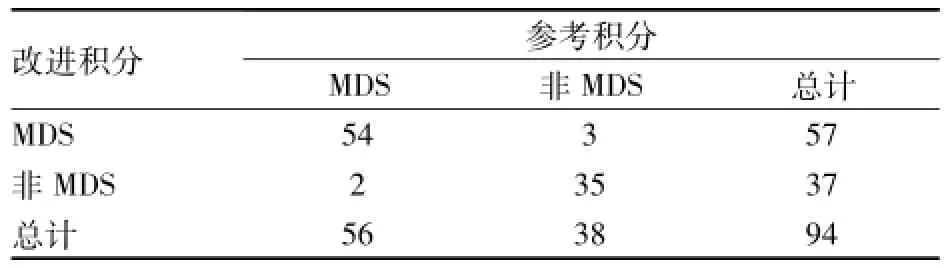
表3 改进的流式积分和参考流式积分在诊断MDS中的比较(n)
3 讨论
因MDS异质性的特点,临床诊断较为困难。形态学和遗传学是确诊MDS的主要检查,而形态学的检测易受骨髓采集、制片水平、染色因素的影响,且异质性使细胞分化成熟障碍,在判断分化阶段上易受操作者主观判断[8],遗传学有明确的染色体检出可确诊MDS,但近一半的患者无异常染色体核型[9]。FCM检测骨髓标本质量优劣对免疫表型分析的影响不如对形态学那么明显[10],故很多研究机构制订了诊断MDS的积分系统,但大多需要标记多个抗体组合,分析复杂,不易被临床医师解读,也加重了患者的经济负担。Della Porta et al[6]制定的四参数FCM积分有很高的诊断参数,尤其实用于低危MDS患者的诊断。本研究证实了该方法的临床实用性,同时本研究改进了设门方案,仅需4个抗体,一个组合就能分析该四参数积分,四色的流式分析仪就可以做到,用CD19和CD33在CD34+的细胞群中的表达代替文献中用SSC和CD45表达的强度把B系前体细胞和髓系前体细胞分离,文献方案仅凭更弱表达的SSC和CD45分离B系前体细胞,易受操作者主观判断,本改进方案杜绝了操作者主观的因素。在临床资料研究中,改进的FCM积分似乎有更高的灵敏度和特异性以及诊断符合率,11例因方法学的改变而改变了FCM积分,11例中有5例因积分的改变而得到正确的诊断,其中MDS组有3例用改进的FCM积分纠正了参考方案的诊断,非MDS组有2例纠正了参考方案的诊断。Χ2检验比较改进的FCM积分和参考FCM积分诊断MDS无差异性,说明改进的流式方案能胜任文献中FCM积分的分析。
本改进方案仅代表本院的临床资料,尚需更多实验室数据来验证这种简洁方便、经济实用、高诊断参数、易于推广的筛查MDS的FCM积分方案。
[1] Yin C C,Medeiros L J,Bueso-Ramos C E.Recent advances in the diagnosis and classification of myeloid neoplasms-comments on the 2008 WHO classification[J].Int J Lab Hematol,2010,32(5):461-76.
[2] Wang Z,Tang X,Xu W,et al.The different immunoregulatory functions on dendritic cells between mesenchymal stem cells derived from bone marrow of patients with low-risk or high-risk myelodysplastic syndromes[J].PLoS One,2013,8(3):e57470.
[3] Neukirchen J,Schoonen W M,Strupp C,et al.Incidence and prevalence of myelodysplastic syndromes:data from the Düsseldorf MDS-registry[J].Leuk Res,2011,35(12):1591-6.
[4] Vardiman J W,Thiele J,Arber D A,et al.The 2008 revision of the World Health Organization(WHO)classification of myeloid neoplasms and acute leukemia:rationale and important changes[J].Blood,2009,114(5):937-51.
[5] 卢 丹,刘艳荣.免疫分型在骨髓增生异常综合征的诊断和预后判断中的作用研究进展[J].中国实验血液学杂志,2013,21(3):785-90.
[6] Della Porta M G,Picone C,Pascutto C,et al.Multicenter validation of a reproducible flow cytometric score for the diagnosis of lowgrade myelodysplastic syndromes:results of a European Leukemia NET study[J].Haematologica,2012,97(8):1209-17.
[7] Valent P,Horny H P,Bennett J M,et al.Definitions and standards in the diagnosis and treatment of the myelodysplastic syndromes:consensus statements and report from a working conference[J].Leuk Res,2007,31(6):727-36.
[8] 刘艳荣,徐 娟,万岁桂.实用流式细胞术:血液病篇[M].北京:北京大学医学出版社,2013:132-3.
[9] Gangat N,Patnaik M M,Begna K,et al.Evaluation of revised IPSS cytogenetic risk stratification and prognostic impact of monosomal karyotype in 783 patients with primary myelodysplastic syndromes[J].Am J Hematol,2013,88(8):690-3.
[10]李 锦.骨髓增生异常综合征病态造血的流式细胞术检测[J].中国实验血液学杂志,2013,21(4):1069-72.
On the value of improved flow cytometry score in MDS diagnosis
Guo Jinjing1,2,3,Wang Huipin1,2,Xiong Shudao1,2,et al
(1Dept of Hematology,The Second Hospital of Anhui Medical University,2Hematology Research Center,Anhui Medical University,Hefei 230061;3Dept of Laboratory Medicine,Fuyang Affiliated Hospital of Anhui Medical University,Fuyang People's Hospital,Fuyang 236400)
Screening 94 patients to evaluate the diagnostic effectiveness of an improved FCM-score in MDS.A set of antibody combination:CD34/CD19/CD33/CD45 was used to analyze the four parameters FCM-score,and through CD19 and CD33 to separate progenitor B-cell blasts and myeloblasts.Analysis of the FCM-score in patients with suspected MDS,and the diagnostic parameters of the two methods were evaluated.The improved FCM-score had higher diagnosis parameters.11 patients with improved method changed the integral,5 of 11 cases changed classification and got correct diagnosis.The improved FCM-score is simple and easy,and can better separate of progenitor B-cell blasts and myeloblasts.
myelodysplastic syndromes;flow cytometry;immunophenotype
R 551.3
A
1000-1492(2016)06-0903-04
2016-03-08接收
国家自然科学基金(编号:81141104);安徽省高校省级自然科学研究项目(编号:KJ2014Z017)
1安徽医科大学第二附属医院血液内科,合肥 2306012安徽医科大学血液病研究中心,合肥 2300613安徽医科大学附属阜阳市人民医院检验科,阜阳230601
郭进京,男,硕士研究生;翟志敏,女,主任医师,教授,博士生导师,责任作者,E-mail:zzzm889@163.com
