射波刀与伽玛刀治疗局部晚期胰腺癌的比较
2016-09-08张新红康静波朱奇徐云科张嘉月展晓宇李建国
张新红康静波朱 奇徐云科张嘉月展晓宇李建国
射波刀与伽玛刀治疗局部晚期胰腺癌的比较
张新红①康静波①朱 奇①徐云科①张嘉月①展晓宇①李建国①
目的:对比观察射波刀与体部伽玛刀治疗局部晚期胰腺癌的疗效.方法:选取113例局部晚期胰腺癌患者,根据治疗方法的不同将其分为射波刀组(45例)与伽玛刀组(68例),并观察两组的治疗效果、副反应以及随访无进展生存时间和总生存时间.结果:射波刀组和伽玛刀组治疗有效率分别为75.56%和73.53%,疼痛缓解率分别为94.74%和94.52%,中位疼痛缓解时间分别为4 d和16 d.治疗后两组的总胆红素、肿瘤标志物(CA19-9)指标均较治疗前明显改善,治疗前后比较有差异(t=14.22,t=12.94;P<0.05).中位随访时间28个月,两组中位无进展生存时间(PFS)分别为10.1个月和8.7个月,两组比较有差异(t=10.07,P<0.05),中位生存时间(OS)分别为15.5个月和14.8个月,两组比较无差异(t=2.76,P>0.05).射波刀组和伽玛刀组患者的消化道反应发生率为48.89%和58.82%,(x2=2.09,P<0.05),骨髓抑制发生率分别为11.11%和11.76%,两组比较无差异(x2=5.66,P>0.05),均未见3~4级严重并发症发生.结论:与伽玛刀比较,射波刀治疗局部晚期胰腺癌局部控制率和有效率相似,但可提高无进展生存时间,且疗程短、起效快,不良反应小,是一种更为安全有效的治疗方法.
胰腺肿瘤;射波刀;立体定向放射治疗;体部伽玛刀

张新红,女,(1970- ),博士,副主任医师.海军总医院肿瘤诊疗中心,从事肿瘤放化疗及射波刀治疗.
[First-author's address] Department of Radiotherapy Oncology and Integrative Oncology, Navy General Hospital of PLA, Beijing 100048, China.
胰腺癌是一种常见的消化系统肿瘤,约占全部恶性肿瘤的2%,其恶性程度高,进展快,发病率和病死率在全部恶性肿瘤中排前10位.在我国胰腺癌发病率呈大幅度增长,年发病率为7.28/10万.然而,胰腺癌确诊时多属晚期,手术切除率极低(只有10%~15%),而且预后极差,中位生存时间<6个月,5年生存率<5%[1].因此,放射治疗成为治疗局部晚期胰腺癌的主要手段之一.本研究回顾性分析113例采用射波刀或伽玛刀治疗的局部晚期胰腺癌患者,对两种立体定向放射治疗的疗效进行比较.
1 资料与方法
1.1 一般资料
回顾分析2011年7月至2015年5月海军总医院收治的经病理学或PET/CT、肿瘤标志物(CA19-9等)检查明确诊断、且无法手术切除或拒绝手术以及卡氏评分(KPS)≥70分的113例局部晚期胰腺癌患者,其中男性75例,女性38例;年龄38~90岁,中位年龄65岁.其中胰头癌67例,胰体尾部癌46例;腹背疼痛100例,食欲减退87例,血糖异常50例,黄疸43例;8例因梗阻性黄疸行减黄术(其中胆道支架植入18例,体外引流14例);CA19-9异常102例(占90.26%).113例胰腺癌患者按照治疗方法的不同将其分为射波刀组(45例)与伽玛刀组(68例).射波刀组仅接受射波刀治疗,伽玛刀组接受体部伽玛刀治疗.射波刀组中ⅢA期患者占62.22%(28/45),ⅢB期患者占37.78%(17/45),胰头癌患者占55.56%(25/45), 91.11%(41/45)的患者CA19-9异常增高;伽玛刀治疗组中ⅢA期患者占66.18%(45/68),ⅢB期患者占33.82%(23/68),胰头癌患者占61.76%(42/68), 89.71%(61/68)的患者CA19-9异常增高.两组患者各项临床基本资料相比无差异,具有可比性.
1.2 治疗方法
(1)射波刀治疗.①采用美国Accuray公司生产的射波刀SRS系统进行治疗,治疗中以6 MV直线加速器为放射源,在计算机的控制下由具有6个关节的机械臂实现非等中心、非共面、多角度以及聚焦式照射;②定位及靶区勾画,患者取仰卧位,采用体位固定床和真空负压袋固定体位,经腹部CT增强扫描,层厚1.5 mm,在治疗规划系统上进行CT图像融合及三维图像重建,勾画靶区及邻近需要保护的十二指肠、小肠等危及器官,肿瘤区(gross tumor volume,GTV):包括原发肿瘤和转移的淋巴结,并可参照PET/CT或MRI等结果调整,在GTV基础上外扩5~8 mm为计划靶区(planning target volume, PTV),需根据肿瘤所在位置、临床靶体积、邻近危及器官及治疗目的制定;③治疗剂量,依据其组织病理、肿瘤位置、邻近危及器官耐受剂量和之前是否接受过放射治疗等决定治疗剂量,处方剂量为30~45 Gy,单次剂量为5~8 Gy,分割方式为4~7次,等剂量曲线为65%~84%,GTV覆盖率为91.34%~100%;④治疗中患者体位与定位时相同,尽量保持稳定.机械臂控制直线加速器按照治疗计划设定的途径达到各个治疗位置,并通过影像追踪调整加速器位置,治疗时间一般为0.5~1 h.
(2)伽玛刀治疗.①采用OUR-QGD型立体定向体部伽玛射线放射治疗系统;②定位及靶区勾画,患者取仰卧位,采用体位固定床和真空负压袋固定体位,体表标记重复摆位点,经腹部CT增强扫描,层厚5 mm,在γ-TPS治疗规划系统上进行三维图像重建并勾画靶区.方法同射波刀治疗组;③治疗剂量,处方剂量为36~45 Gy,肿瘤≤5 cm的单次周边剂量3.5~4.5 Gy,肿瘤>5 cm的单次周边剂量3.0~4.0 Gy,分割方式为10~11次,等剂量曲线50%~60%, GTV覆盖率89%~98%,前3次治疗为隔日治疗,如患者能耐受,后期改为连续治疗.
1.3 随访与疗效评价
(1)治疗前后所有的患者均进行疼痛情况评估.疼痛的评估应用视觉模拟评分法(visual analogue scale/score,VAS),在VAS评分下降3分及以上时定义为疼痛治疗有效[2].
(2)治疗结束后每3个月复查CT、或MRI、或PET/CT.近期疗效参照WHO实体瘤评价标准:完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),以CR+PR计算有效率(RR).毒副反应参照RTOG标准分1~4级.随访截止于2015年12月,随访时间从治疗第1 d开始计算,直至死亡或最后一次随访,记录无进展生存时间(PFS)和总生存时间(OS).
1.4 统计学方法
采用SPSS16.0软件处理统计数据,计数资料以均数±标准差(x-±s)表示,采用x2检验,计量资料用t检验,中位生存时间用Kaplan-Meier法,生存时间比较用Log-rank检验,以P<0.05为差异有统计学意义.
2 结果
表1 两组治疗参数比较(±s)
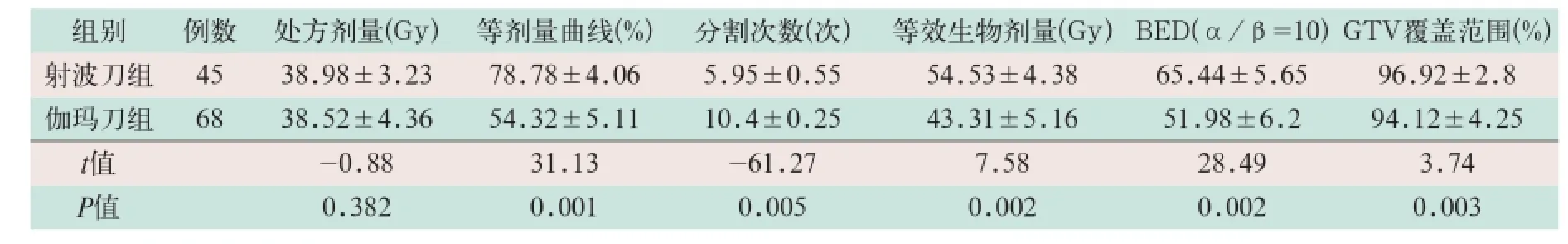
表1 两组治疗参数比较(±s)
表2 两组治疗前后总胆红素及CA19-9比较±s)
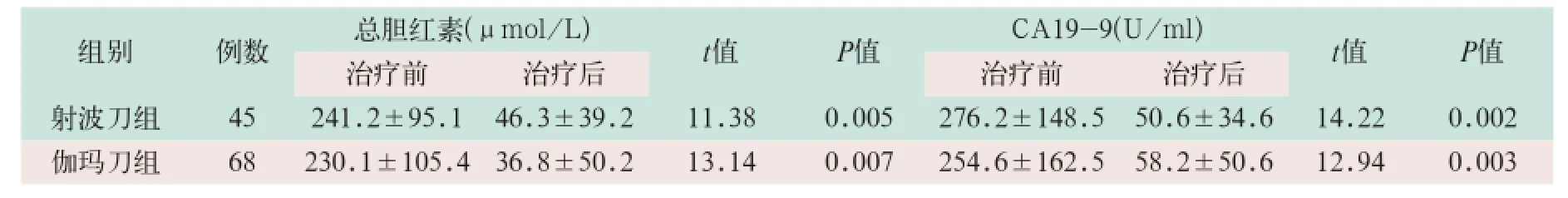
表2 两组治疗前后总胆红素及CA19-9比较±s)
2.1 治疗参数
两组患者治疗处方剂量、等剂量曲线、分割次数、等效生物剂量、生物有效剂量及GTV覆盖范围等参数比较除处方剂量外其余各项差异均有统计学意义(t=31.13,t=-61.27,t=7.58,t=28.49, t=3.74;P<0.05),见表1.
2.2 近期疗效
射波刀组治疗有效率为75.56%(占34/45)、疼痛缓解率为94.74%(占36/38);伽玛刀组治疗有效率为73.53%(占50/68),疼痛缓解率为90.32%(占56/62),两组比较差异无统计学意义(x2=2.76、x2=4.98;P>0.05).射波刀组多数患者在治疗中疼痛即逐渐减轻,缓解时间为3~7 d,中位缓解时间为4 d;伽玛刀组疼痛缓解时间为8~30 d,中位缓解时间为16 d,两组比较差异有统计学意义(t=-19.85,P<0.01).两组治疗后总胆红素、CA19-9较治疗前均显著降低,差异有统计学意义(t=14.22, t=12.94;P<0.05),但两组间比较无差异(见表2).
2.3 不良反应
治疗期间两组患者均耐受良好,主要的不良反应包括恶心、呕吐等消化道反应、骨髓抑制、乏力及发热等,均为1~2级,无3级以上毒副反应.两组病例未见消化道穿孔及大出血等严重并发症发生.
射波刀组和伽玛刀组骨髓抑制发生率分别为11.11%和11.76%,两组比较差异无统计学意义(x2=5.66,P>0.05);两组均为Ⅰ~Ⅱ度,经对症处理后均可恢复.两组消化道反应发生率分别为48.89%和58.82%,两组比较差异有统计学意义(x2=2.09,P<0.05).
2.4 随访结束
随访截止至2015年12月,随访时间为8~40个月,中位随访时间为28个月.射波刀组及伽玛刀组中位PFS分别为10.1个月和8.7个月(t=10.07,P<0.05),中位生存时间分别为15.5个月和14.8个月,1年生存率分别为55.56%和54.41%,差异无统计学意义(t=2.76,P>0.05).
3 讨论
胰腺癌手术切除率低,50%~60%为局部晚期胰腺癌治疗效果和预后均差,治疗上则以延长生命、改善症状以及提高生存质量为原则[3-6].由于胰腺癌对放射线不敏感,且紧邻胃肠道等重要组织器官,限制了放射治疗剂量的提高,使常规放射治疗在胰腺癌治疗中的作用受到限制.
立体定向放射治疗有别于常规放射治疗,对靶区进行非共面锥状旋转聚焦照射,其剂量分布的最大特征是高剂量集中在靶区,靶外剂量急剧递减,提高了肿瘤局部放射治疗剂量,减少了周围正常组织器官受量,并采用高分割剂量、短疗程的方法对肿瘤进行精确放射治疗,使肿瘤局部控制率提高,正常组织并发症降低,尤其适用于周围有不能耐受高剂量照射的重要组织和器官的病灶.
射波刀是近年来发展起来的更为先进的立体定向放射外科治疗技术平台,治疗系统由放射源、治疗床及影像引导系统组成,系统的核心是交互式机器人技术.系统在接收到患者位置、肿瘤位置及呼吸运动的反馈后,实时调整治疗床的位置和加速器的角度,并通过X射线照射影像引导摆位,全程实时定位追踪以实现治疗的高度精确性,治疗误差<1 mm.
射波刀治疗由于其高度精确性和适形性,为临床采用更短疗程、更大分割的治疗方案提供了基础,单次照射剂量可以达到12~15 Gy甚至更高,分割次数3~6次,中位剂量45 Gy,等效生物剂量(α/β=10)为80~120 Gy[7].Koong等[8]运用射波刀技术对局部晚期胰腺癌患者进行I期剂量拔高研究,3例给予单次照射剂量15 Gy,5例给予单次照射剂量20 Gy,7例给予单次照射剂量25 Gy,结果显示,单次25 Gy可以获得100%的局控率,而且症状明显减轻.之后又进行了II期临床研究,16例局部晚期胰腺癌患者接受照射剂量45 Gy调强放射治疗加同步化疗后1个月内,用射波刀局部补量25 Gy,16例患者全部完成治疗,局控率达到94%,但总生存率未明显提高[9].Kim等[10]对局部晚期胰腺癌进行前瞻性研究,一组19例仅给予射波刀治疗,照射剂量33~39 Gy/3次,另一组21例在外照射(40 Gy/20 f)后给予射波刀补量,照射剂量13~19 Gy/1次,结果后组1年生存率明显高于前组(57.9%vs21.1%),充分体现了射波刀大剂量、短疗程方案在局部晚期胰腺癌治疗中的优势.
本研究应用射波刀技术治疗局部晚期胰腺癌患者,处方剂量取决于邻近胃肠组织所能耐受的最大剂量及体积剂量限量为参考,并结合患者年龄状态(本组25%患者年龄≥75岁)、KPS评分状态,虽然剂量低于以上文献所采用的剂量,但同样取得了较为理想的治疗效果,并减少了局部副反应,患者耐受良好.
此外,本研究观察了射波刀与伽玛刀治疗局部晚期胰腺癌两种治疗方案的异同、疗效及不良反应.
(1)治疗结果显示:①射波刀组分割次数明显少于伽玛刀组,对于症状明显,治疗配合稍差的患者,该治疗可以减少患者治疗的重复摆位和搬动次数,减少由此给患者带来的痛苦;②射波刀治疗的等剂量曲线高于伽玛刀,使肿瘤局部照射剂量相对均匀,适形度增加,使GTV覆盖率也明显增加,减少了肿瘤的漏照范围;③射波刀治疗的等效生物剂量高于伽玛刀治疗,对肿瘤细胞的杀伤力增大,生物学效力加强,能更好地提高局部控制率.
(2)疗效结果显示,两种治疗均有效地降低了胆红素和CA19-9,参照WHO实体瘤评价标准,两组有效率相似,而射波刀治疗明显提高了局部晚期胰腺癌患者的无进展生存时间,中位生存时间及1年生存率略高于伽玛刀治疗,两组均有效地改善了患者的症状,疼痛缓解率分别达到94.74%和90.32%.而射波刀治疗后患者疼痛缓解起效快,中位缓解时间仅为4 d,而伽玛刀组中位缓解时间为16 d,射波刀治疗明显提高了患者生活质量,较伽玛刀治疗更有优势.
(3)不良反应,主要为消化道反应、骨髓抑制、乏力以及发热等,均为1~2级,无3级以上不良反应.射波刀组消化道反应发生率明显低于伽玛刀组,其原因是由于射波刀定位采用薄层扫描,使靶区及危及器官的勾画更为准确.此外,射波刀系统剂量计算精准,提高了肿瘤靶区适形性和精确度,能更好地保护胃、十二指肠及小肠等邻近正常组织器官,减少局部受照剂量.射波刀治疗采用图像引导系统,较伽玛刀治疗更准确,从而减少了不良反应的发生.
综上所述,射波刀和伽玛刀治疗均能获得良好的肿瘤局部控制率,并能改善患者症状和生活质量,但射波刀治疗疗程短,起效快,不良反应小,可提高患者无进展生存时间,是一种更为安全、有效的治疗方法.
[1]夏廷毅,康静波.体部肿瘤伽玛刀治疗学[M].北京:人民卫生出版社,2010:171-183.
[2]Zanoli G,Stromqvist B,Jonsson B.Visual analog scales for interpretation of back and leg pain intensity in patients operated for degenerative lumbar spine disorders[J].Spine(Phila Pa 1976),2001,26(21):2375-2380.
[3]殷蔚伯.肿瘤放射治疗学[M].北京:中国协和医科大学出版社,2008:840.
[4]吴铁鹰,张俊青,刘永兰,等.立体定向放射治疗联合吉西他滨治疗局部晚期胰腺癌疗效分析[J].肿瘤研究与临床,2012,24(7):490-492.
[5]Kothari N,Saif MW,Kim R.First-line treatment for advanced pancreatic cancer[J]. JOP,2013,14(2):129-132.
[6]Abreu MR,Vilar E,Arús ER,et al.Trends in digestive cancer mortality,Cuba1987-2008[J]. Eur J Public Health,2013,23(1):164-170.
[7]沈泽天,武新虎,李兵,等.射波刀治疗局部晚期胰腺癌的临床疗效分析[J].中国癌症杂志,2012,22(8): 589-594.
[8]Koong AC,Le QT,Ho A,et al.Phase I study of stereotactic radiosurgery in patients with locally advanced pancreatic cancer[J].Int J Radiat Oncol Biol Phys,2004,58(4):1017-1021.
[9]Koong AC,Christoferson E,Le QT,Ho A,et al. Phase II study to assess the efficacy of conventional fractionated radiotherapy followed by a stereotactic radiosurgery boost with locally advanced pancreatic cancer[J].Int J Radiat Oncol Biol Phys,2005,63(2):320-323.
[10]Kim M,Yoo S,Cho C,et al.Comparison of the efficacy of conventional radiotherapy followed by CyberKnife boost with CyberKnife alone in patients with locally advanced pancreatic can cer[J].Int J Radiat Oncol Biol Phys,2006,66(3): S300.
Comparison of the efficacy of CyberKnife therapy with Gamma-Knife therapy in patients with locally advanced pancreatic cancer
ZHANG Xin-hong, KANG Jing-bo, ZHU Qi, et al
Objective: To compare the efficacy of CyberKnife therapy with stereotactic body radiation therapy (Gamma-Knife) in treatment of locally advanced pancreatic cancer. Methods: 113 patients with locally advanced pancreatic cancer were divided into two groups according to receiving therapy method (CyberKnife group and Gamma-Knife group). Therapeutic effects, side effects, progression-free survival (PFS) and overall survival (OS) were recorded. Results: In the group of CyberKnife and Gamma-Knife, the objective response rate (ORR, CR+PR) was 75.56% and 73.53% (P>0.05), and the rate of pain alleviation was 94.74% and 94.52% (P>0.05), respectively. The median time of pain relief was 4 days and 16 days (P<0.01). After treatment, the index of total bilirubin and CA19-9 were significantly improved in both of the two groups, but there was no significant difference between them. The median time of follow-up was 28 months. The median PFS and OS in CyberKnife group and Gamma-Knife group were 10.1 and 8.7 months (t=10.07, P<0.05), 15.5 and 14.8 months, respectively (t=2.76, P> 0.05). The rate of gastrointestinal tract side effect and myelosuppression in the two groups were 48.89% and 58.82%, 11.11% and 11.76%, respectively (x2=5.66, P>0.05). There was no grade 3-4 serious adverse reaction. Conclusion: Compared with Gamma-Knife therapy, CyberKnife therapy is more effective and safer for patients with advanced pancreatic cancer which can obtain similar local control rate and effective rate. But it can improve the PFS and has the characteristics of short course, fast effect and less adverse reaction.
Pancreatic cancer; CyberKnife; Stereotactic body radiation therapy ; Gamma-Knife
1672-8270(2016)07-0070-04 [中图分类号] R735.9
A
10.3969/J.ISSN.1672-8270.2016.07.022
①海军总医院肿瘤诊疗中心 北京 100048
2015-10-30
