羟考酮在腹腔镜胆囊切除术麻醉诱导的适宜剂量探讨
2016-09-08吕华燕胡崇辉杨娜杜光生韦战红浙江大学金华医院金华市中心医院麻醉科浙江金华321000
吕华燕,胡崇辉,杨娜,杜光生,韦战红(浙江大学金华医院金华市中心医院 麻醉科,浙江 金华 321000)
论 著
羟考酮在腹腔镜胆囊切除术麻醉诱导的适宜剂量探讨
吕华燕,胡崇辉,杨娜,杜光生,韦战红
(浙江大学金华医院金华市中心医院 麻醉科,浙江 金华 321000)
目的 探讨盐酸羟考酮用于腹腔镜胆囊切除术(LC)麻醉诱导的适宜剂量。方法 择期LC术患者90例,美国麻醉医师协会(ASA)分级Ⅰ或Ⅱ级,采用随机数字表法分为3组:不同剂量羟考酮组(O1 ~O3组)。麻醉诱导:静脉注射丙泊酚1.00~2.00 mg/kg、不同剂量羟考酮组(O1~O3组)分别静脉注射羟考酮0.20、0.30和0.40 mg/kg、维库溴铵0.10 mg/kg。麻醉维持采用常用的静吸复合药物。记录入手术室后(T0)、麻醉诱导置入喉罩后1 min(T1)、建立人工气腹后(T2)、分离胆囊时(T3)、苏醒即刻(T4)和离开复苏室即刻(T5)时的心率(HR)、收缩压(SBP)、舒张压(DBP),记录T4、T5、术后4 h(T6)和术后8 h(T7)的疼痛数字等级评分(NRS),记录患者术中使用瑞芬太尼总量,围术期羟考酮总量。记录苏醒时间及术毕患者复苏过程中追加止痛药例数,观察术后患者不良反应情况。结果 O2和O3组患者术中平均HR、SBP及DBP波动不超过基础值的20.00%。3组患者术毕苏醒时间无明显差异。O1组苏醒后主诉NRS>4分要求再追加止痛药的患者为22例,O2组为7例,O3组为3例,3组间差异有统计学意义。3组患者围术期羟考酮总消耗量为O1组:(18.93±4.34)mg(0.90~2.60 mg);O2组:(25.50±4.49)mg (1.40~3.00 mg);O3组:(26.10±4.55)mg(1.80~3.40 mg),O1组较O2及O3组消耗量更少(F =23.79,P =0.000)。3组患者不良反应情况比较差异无统计学意义,但是O3组患者有1例出现呼吸抑制的严重不良反应。结论 羟考酮用于LC手术麻醉诱导的适宜剂量为0.30 mg/kg。
羟考酮;腹腔镜胆囊切除术;麻醉诱导
盐酸羟考酮注射液是半合成阿片受体激动药,具有μ受体和κ受体的双重激动α阿片类药物。有报道称其镇痛效果与盐酸吗啡注射液相似,两药的镇痛效能比接近1∶1[1]。与传统的阿片类药物相比,羟考酮具有起效迅速、消除半衰期较长和不良反应较低等特点,可以作为阿片类镇痛药在麻醉诱导时给予[2]。PIIRAINEN等[3]在麻醉诱导时给予羟考酮0.20 mg/kg用于腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC),术后再给予羟考酮滴定的剂量范围为0.00~0.33 mg/kg,所有患者不良反应发生均很低。KOKKI及KOCH等[4-5]在LC手术围术期给予羟考酮滴定,发现其剂量约0.20~0.50 mg/kg。然而,目前关于羟考酮用于LC术麻醉诱导的临床研究仍较少,其合适剂量仍需进一步探讨。因此,笔者决定在LC患者麻醉诱导给予静脉注射不同剂量的羟考酮,比较其术中的血流动力学情况,术毕苏醒情况及镇痛疗效。现报道如下:
1 资料与方法
1.1一般资料
本研究已获本院医学伦理委员会批准,并与患者签署知情同意书。选择2015年3月-2015年9月我院肝胆胰外科择期LC患者90例,美国麻醉医师协会分级(American Society of Anesthesiologists,ASA)分级Ⅰ或Ⅱ级,性别不限,年龄32~64(42.52±8.71)岁,体重45~82(60.09±12.32)kg,采用随机数字表法将其分为3组(n =30):不同剂量羟考酮组(O1~O3组)。主要排除标准:腹腔镜手术困难中转开腹者、慢性疼痛且长期使用镇痛药或精神系统药物(阿片类镇痛药、非甾体类抗炎药、镇静药和抗抑郁药)、酒精滥用史、肝、肾功能[丙氨酸转氨酶(alanine aminotransferase,ALT)、天门冬氨酸转氨酶(aspartate aminotransferase,AST)、血尿素氮(blood urea nitrogen,BUN)、尿肌酐(urine creatinine,Cr)]严重异常、高血压[收缩压(systolic blood pressure,SBP)≥180 mmHg(1 mmHg=0.133 kPa)、舒张压(diastolic blood pressure,DBP)≥110 mmHg]病史、胃食道返流症、术前24 h使用镇静药、镇吐药和抗瘙痒药物、妊娠和哺乳期。O1组:男18例,女12例;年龄38~60(44.23±7.36)岁;体重50~73(58.33±10.83)kg;手术时间40~100 (55.52±25.61)min。O2组:男15例,女15例;年龄32~63(39.09±9.91)岁;体重45~74(61.10± 9.59) kg;手术时间50~93 (61.53±16.02) min。O3组:男16例,女14例;年龄34~64(40.08±6.89)岁;体重54~82(64.78±4.41)kg;手术时间45~110 (68.52±26.03)min。3组患者年龄、性别、体重和手术时间的差异均无统计学意义(P >0.05),具有可比性。
1.2方法
所有患者术前未用药,入室常规监测血压(blood pressure,BP)、心电图(electrocardiogram,ECG)、心率(heart rate,HR)、脉搏血氧饱和度(pulse blood oxygen saturation,SpO2)和脑电双频指数(bispectral index,BIS)。开放外周静脉通路,输注乳酸林格氏液6 ml/(kg·h)。麻醉诱导前静脉注射戊乙奎醚0.3 mg、地塞米松10.0 mg。麻醉诱导:O1组:静脉注射丙泊酚1.00~2.00 mg/kg、羟考酮(批号:BE923,Hamol公司,英国)0.20 mg/kg、维库溴铵0.10 mg/kg。O2组:羟考酮0.30 mg/kg,余同O1组。O3组:羟考酮0.40 mg/kg,余同O1组。麻醉诱导后3 min插入喉罩,行机械通气。麻醉维持:静脉输注异丙酚4~8 mg/(kg·h)和瑞芬太尼0.1~0.3μg/(kg·min),吸入1%七氟烷,间断静脉注射维库溴铵0.05 mg/kg。维持BIS值40~60。术中患者出现高血压(SBP≥180 mmHg、DBP≥110 mmHg),给予乌拉地尔注射液降压。患者取头高脚低左偏位下,用三孔法使气腹压维持在10~12 mmHg(1 mmHg=0.133 kPa),由比较熟练的外科医师操作,完成LC。患者均未留置引流管。所有患者均在手术完毕前15 min停止七氟醚吸入,术毕停止给予丙泊酚和瑞芬太尼。静脉注射阿托品1.0 mg和新斯的明2.0 mg拮抗残余肌松效应,待呼吸恢复满意后拔出喉罩。拔管后当患者疼痛数字等级评分(numerical rating scale,NRS)>4分时,静脉注射盐酸羟考酮注射液2.0 mg,必要时间隔5 min重复给药,直至患者NRS评分≤4分。
1.3观察指标
于入手术室后(T0)、麻醉诱导置入喉罩后1 min (T1)、建立人工气腹后(T2)、分离胆囊时(T3)、苏醒即刻(T4)、离开复苏室即刻(T5)时记录HR、SBP、DBP和SpO2值,记录苏醒即刻(T4)、离开复苏室即刻(T5),术后4 h(T6),术后8 h(T7)的NRS评分,记录苏醒时间、记录术中瑞芬太尼使用量及需要使用乌拉地尔降压的例数,记录术毕患者复苏过程中追加止痛药例数及围术期羟考酮总用量,观察术后患者不良反应情况。苏醒时间指从患者手术结束停麻醉药后至患者自动睁眼或呼之睁眼的时间。以上观察指标由一名麻醉助手执行,该助手不清楚患者的给药方案。NRS评分标准:0分为无痛,10分为最痛。
1.4统计学方法
采用SPSS 16.0统计软件分析处理。计量资料以均数±标准差(±s)表示,组间比较采用方差分析,组内比较采用单因素方差分析。计数资料比较采用χ2检验;不适合做Pearson χ2检验的两组率的比较采用Fisher精确检验。检验水准α=0.05。
2 结果
2.13组患者术中血流动力学变化的比较
3组患者均顺利完成手术及麻醉,术中血流动力学比较情况见表1。O1、O2组患者HR在T2、T3、T4时较T0时明显升高(F =16.70,P =0.000;F =6.08, P =0.000),O3组患者HR在T2、T3时较T0时明显升高(F =6.10,P =0.000);O2、O3组患者与O1组患者HR在T2、T3、T4时差异有统计学意义(F = 5.35,P =0.006;F =5.87,P =0.004;F =6.88,P = 0.002)。O1、O2组患者SBP在T2、T3时较T0时明显升高(F =20.48,P =0.000;F =21.99,P =0.000);O3组患者SBP在T2、T3时较T0时明显升高,在T5时明显降低(F =8.26,P =0.000);O3组患者与O1组患者SBP在T2、T3时差异有统计学意义(F =3.52,P =0.034;F =6.24,P =0.003)。O1、O2及O3组 患者DBP在T2、T3时较T0时明显升高(F =41.19,P = 0.000;F =27.88,P =0.000;F =6.47,P =0.000);O2、O3组患者与O1组患者DBP在T2时差异有统计学意义(F =11.28,P =0.000)。O3组患者与O1组患者DBP在T3时差异有统计学意义(F =8.34,P = 0.000)。O2、O3组患者术中平均HR、SBP及DBP波动不超过基础值的20.00%。
2.23组患者苏醒时间、术毕止痛情况等的比较
表1 3组患者术中HR、SBP、DBP的比较 (±s)

表1 3组患者术中HR、SBP、DBP的比较 (±s)
注:1)组内比较,与术前基础值(T0)相比,P <0.05;2)与O1组比较,P <0.05
组别 T0 T1 T2 T3 T4 T5HR/(次/min)O1组(n =30) 75.27±10.88 75.47±11.06 92.03±8.241) 89.90±9.811) 84.53±8.671) 77.07±11.20 O2组(n =30) 73.11±8.87 71.41±11.09 84.10±9.271)2) 79.92±13.231)2) 77.83±8.741)2) 75.30±12.52 O3组(n =30) 74.02±9.19 73.03±12.36 86.13±11.481)2) 82.43±11.791)2) 76.83±8.812) 78.44±12.71 SBP/mmHg O1组(n =30) 124.87±11.29 115.03±10.32 146.47±19.781) 144.17±20.401) 122.47±11.14 118.23±12.16 O2组(n =30) 121.89±15.21 115.03±9.58 138.70±15.851) 143.03±16.581) 119.90±10.43 117.12±9.81 O3组(n =30) 120.82±11.13 113.89±9.68 134.93±16.441)2) 129.60±15.971)2) 118.22±12.39 113.42±9.321)DBP/mmHg O1组(n =30) 73.03±7.02 70.33±7.26 88.67±7.171) 88.97±9.231) 74.20±5.17 73.33±6.64 O2组(n =30) 70.42±7.27 68.29±8.82 82.60±8.571)2) 86.57±10.511) 72.42±5.91 72.19±7.31 O3组(n =30) 70.52±8.08 67.07±10.81 79.13±7.811)2) 77.90±13.041)2) 73.38±7.08 73.22±9.87
由表2可见,3组患者术毕苏醒时间差异无统计学意义。3组患者术中瑞芬太尼消耗量为O1:(0.73±0.22)mg(0.40~1.20 mg),O2:(0.68±0.18)mg (0.40~1.10 mg),O3:(0.69±0.16)mg(0.40~1.00 mg),差异无统计学意义。3组患者围术期羟考酮总消耗量为O1:(18.93±4.34)mg(0.90~2.60 mg),O2:(25.50± 4.49)mg(1.40~3.00 mg),O3:(26.10±4.55)mg (1.80~3.40 mg),O1组较O2及O3组消耗量明显更少(F =23.79,P =0.000)。O1组患者NRS>4分要求再追加止痛药的患者为22例,O2组为7例,O3组为3例。O1组患者在T6、T7时刻NRS评分>4分的患者例数较O2、O3组更多,但是差异无统计学意义。
2.33组患者不良发应情况的比较
3组患者不良反应情况比较差异无统计学意义(P >0.05),最常见的不良反应为恶心,其次为呕吐。O1、O2组无严重不良反应出现,O3组患者有1例拔管后出现呼吸抑制,该患者手术结束停麻醉药10 min后出现咳嗽及吞咽反应、呼之睁眼,拔管后再次入睡,有呼吸停顿,经皮氧饱和度低于90.00%,给予面罩加压给氧,大声呼唤患者,静注盐酸多沙普伦注射液30.0 mg,在手术室内观察30 min后好转。见表3。

表2 3组患者苏醒时间、术毕止痛情况等的比较
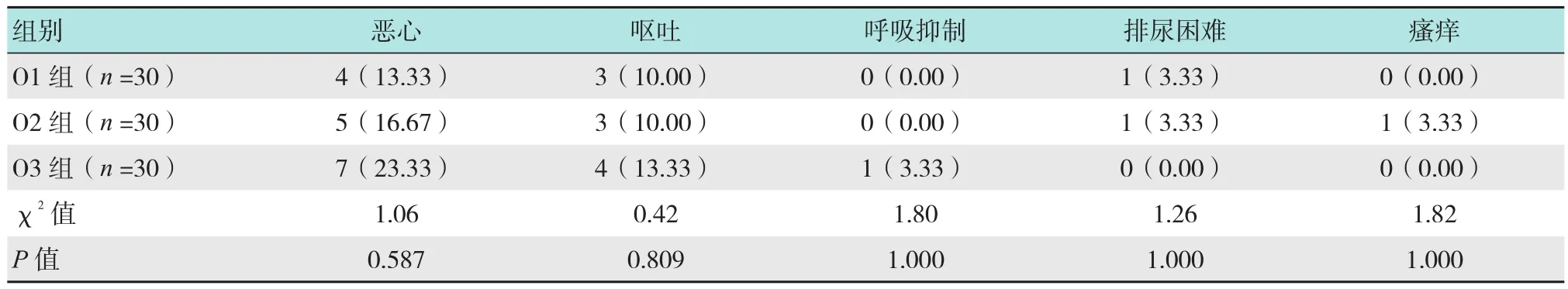
表3 3组患者不良发应情况的比较 例(%)
3 讨论
腹腔镜手术因其微创、手术时间短、伤口愈合快和住院时间短等优势已在临床广泛应用,但同时这类微创短时的手术,其术后镇痛常被忽视。来自德国[6]的一项大型前瞻性研究,纳入11万多患者,显示腹腔镜手术术后疼痛没有得到医师的足够重视,术后疼痛评分较高,LC手术术后第1天疼痛评分平均为4.76分(n =4 460)。此外不同的腹腔镜手术,因手术部位、患者体位、术中操作均不相同,其术后疼痛程度亦不同,LC手术较之妇科腹腔镜手术术后疼痛强度更大,对术后镇痛的需求更高[7]。静吸复合全身麻醉LC术,虽是微创手术,腹壁伤口比开腹手术小,但腹腔内创伤仍存在,此外由于CO2人工气腹的原因,腹壁及膈肌受过度机械牵拉及化学刺激等因素均是造成LC术后中重度疼痛的重要因素[8]。部分患者胃肠功能恢复前的痉挛性疼痛,有可能形成重度疼痛。故LC术的麻醉,在追求苏醒快捷的同时,亦应重视完善镇痛,实现全身麻醉与手术后镇痛的衔接,使患者无疼痛空白期。手术后患者无疼痛产生,提高患者满意度,符合当代外科微创、舒适、快捷、康复的发展要求[9],对患者顺利康复十分必要。
在国外LC手术常为日间门诊手术,术前及术中不给予长效阿片类药物,术毕根据患者疼痛情况给予长效阿片类药物止痛。羟考酮是长效镇痛药,作用时间4~6 h左右,而LC手术时间较短(60 min左右),切皮之前使用,不仅能抑制术中的神经中枢敏化的形成,而且能防止术后一段时间的中枢敏化的形成,使术后疼痛明显减轻。胡建等[10]的研究表明术前给予羟考酮能更有效地抑制炎性因子释放,减少疼痛中枢敏化,起到更好的镇痛作用。故本研究中麻醉诱导时即给予不同剂量的羟考酮。
目前认为LC后急性疼痛主要表现为混合性的躯体和内脏性疼痛,已有的研究结果表明阿片类药物是治疗急性疼痛的首选药物,特别是羟考酮相对于其他阿片类药物具有更好地抑制内脏性疼痛的作用[11]。羟考酮作为阿片类镇痛药物中的一种,具有呼吸抑制、恶心和呕吐等不良反应,可能亦有阿片类药物的封顶效应[12]。为了确定最适宜的给药剂量,即在达到良好镇痛的同时又可把不良反应降到最低。本研究结合国内外文献的结果[13]设计了3个剂量,并观察其疗效。结果表明3个不同剂量的羟考酮都能完成LC术,术毕苏醒时间无明显差异。O1组部分患者术中血流动力学波动较大,需要使用乌拉地尔降压的患者比其他两组更多,差异有统计学意义。O2、O3组患者术中平均HR、SBP及DBP波动不超过基础值的20.00%。同时O1组患者术毕NRS评分均在4分以上、需要补救镇痛的患者比其他两组更多,差异有统计学意义。虽然3组患者不良反应率差异无统计学意义,但是O3组患者中有1例出现呼吸抑制的严重不良反应,安全性不足。
本研究中3组患者最常见的不良反应为恶心,其次为呕吐,3组患者之间发生率无明显差异。恶心及呕吐为阿片类药物常见的不良反应,是影响临床阿片类镇痛药术后使用的重要原因,也是降低患者生活质量及镇痛满意度的重要因素。许幸等[1]将盐酸羟考酮用于全麻患者术后镇痛,术后不良反应发生率最高的为恶心及呕吐,分别为46.40%及25.00%。吴周全等[14]将羟考酮用于腹部手术术后镇痛,其不良反应发生率最高的亦为恶心及呕吐,分别为26.70%~33.30%及13.30%~20.00%。国外文献报道的LC术后的恶心及呕吐约为28.00%~54.00%[15]。本研究中恶心呕吐的发生率分别为13.33%~23.33% 及10.00%~13.33%,恶心呕吐发生率较同类研究相对较低的原因笔者认为:①参考BISGAARD[16]的推荐术前预防性使用地塞米松,术中使用托烷司琼止吐;②患者术后未使用镇痛泵,NRS评分大于4分后再给予镇痛治疗;③本文中羟考酮麻醉诱导时即给药,而其他同类研究将羟考酮作为术后镇痛时给予;④国外此类患者常为日间手术,返家途中的颠簸、运动均会增加术后恶心和呕吐发生率。但是目前国内关于羟考酮用于LC手术术后不良反应情况的文献不多,尚待进一步研究比较。
综上所述,0.20 mg/kg羟考酮虽然能完成LC手术,但是术中心率及血压波动较大,术后即刻镇痛效果欠佳;0.30及0.40 mg/kg羟考酮术中平均心率及血压波动不超过基础值的20.00%,术毕镇痛效果良好。但是O3组患者中有1例出现呼吸抑制的严重不良反应。故综合考虑术中血流动力学指标、术后镇痛效果及不良反应情况,0.30 mg/kg羟考酮是最适宜的。
[1] 许幸, 吴新民, 薛张纲, 等. 盐酸羟考酮注射液用于全麻患者术后镇痛的有效性和安全性:前瞻性、随机、盲法、多中心、阳性对照临床研究[J]. 中华麻醉学杂志, 2013, 33(3): 269-273.
[2] POYHIA R, HYNYNEN M, SEPPALA T, et al. Pharmacodynamics and Pharmacokinetics of high-dose oxycodone infusion during and after coronary artery bypass grafting[J]. Journal of Cardiothoracic and Vascular Anesthesia, 2004, 18(6): 748-754.
[3] PIIRAINEN A, KOKKI H, IMMONEN S, et al. A dose-finding study of dexketoprofen in patients undergoing laparoscopic cholecystectomy: a randomized clinical trial on effects on the analgesic concentration of oxycodone[J]. Drugs in R & D, 2015,15(4): 319-328.
[4] KOKKI M, BROMS S, ESKELINEN M, et al. The analgesic concentration of oxycodone with co-administration of paracetamol-a dose-finding study in adult patients undergoing laparoscopic cholecystectomy[J]. Basic Clinical Pharmacology Toxicology, 2012, 111(6): 391-395.
[5] KOCH S, AHLBURG P, SPANGSBERG N, et al. Oxycodone vs. fentanyl in the treatment of early post-operative pain after laparoscopic cholecystectomy: a randomised double-blind study[J]. Acta Anaesthesiol Scand, 2008, 52(6): 845-850.
[6] GERBERSHAGEN H J, ADUCKATHIL S, ALBERT J M. Pain intensity on the first day after surgery[J]. Anesthesiology, 2013,118(4): 934-944.
[7] 郭珊娜, 段光友, 王金韬, 等. 舒芬太尼配伍曲马多用于女性腹腔镜胆囊切除术和妇科腹腔镜手术术后自控静脉镇痛效果的比较[J]. 中华外科杂志, 2015, 53(2): 150-154.
[8] 邱培才, 邓伟均, 李苏明, 等. 腹腔镜胆囊切除术后右上腹疼痛原因分析[J]. 中国内镜杂志, 2009, 15(4): 390-391.
[9] 朱继巧, 贺强, 张忱, 等. 不留置鼻胃管联合喉罩麻醉在腹腔镜胆囊切除术中的应用[J].中华腔镜外科杂志: 电子版, 2011,4(1): 21.
[10] 胡建, 许建峰, 刘耿, 等. 不同剂量羟考酮术前用药对腹腔镜胆囊切除术后疼痛及炎症细胞因子的影响[J]. 临床麻醉学杂志, 2015, 31(10): 941-944.
[11] LENZ H, SANDVIK L, QVIGSTAD E, et al. A comparison of intravenous oxycodone and intravenous morphine in patient-controlled postoperative analgesia after laparoscopic hysterectomy[J]. Anesth Analg, 2009, 109(4): 1279-1283.
[12] 李艳, 王保国. 阿片类药物量效关系及其对麻醉药物效应的影响[J]. 国际麻醉学与复苏杂志, 2008, 29(3): 216-218.
[13] 姜慧芳, 连燕虹, 周惠丹, 等. 羟考酮抑制单肺通气患者双腔支气管导管插管反应的适宜剂量[J]. 中华麻醉学杂志, 2015,35(9): 1104-1106.
[14] 吴周全, 邹志清, 陈勇. 不同剂量羟考酮对腹部手术后急性疼痛的抑制作用[J]. 临床麻醉学杂志, 2015, 31(2): 161-164.
[15] KARANICOLAS P J, SMITH S E, KANBUR B, et al. The impact of prophylactic dexamethasone on nausea and vomiting after laparoseopic cholecystectomy: a systematic review and metaanalysis[J]. Ann Surg, 2008, 248(5): 751-762.
[16] BISGAARD T. Analgesic treatment after laparoscopic cholecystectomy-a critical assessment of the evidence[J]. Anesthesiology, 2006, 104(1): 835-846.
(吴静 编辑)
Optimum dose of Oxycodone for anesthesia induction in patients undergoing laparoscopic cholecystectomy
Hua-yan Lyu, Chong-hui Hu, Na Yang, Guang-sheng Du, Zhan-hong Wei
(Department of Anesthesiology, Jinhua Central Hospital, Jinhua, Zhejiang 321000, China)
Objective To determine the optimum dose of Oxycodone for anesthesia induction in patients undergoing laparoscopic cholecystectomy. Methods Ninety patients, ASAⅠ orⅡ , scheduled for elective LC,were randomly divided into 3 groups using random number table (O 1~O 3 groups, n = 30 each). Anesthesia was induced with iv Propofol 1.00~2.00 mg/kg, Oxycodone 0.20 mg/kg, 0.3 mg/kg and 0.4 mg/kg (O 1~O 3 groups,respectively), and Vecuronium 0.10 mg/kg. Before anesthesia induction ( T0), 1 min after Laryngeal Mask intubating ( T1), the instant of pneumoperitoneum ( T2), separation of the gallbladder ( T3), wake up immediately ( T4), leaving the recovery room ( T5), the heart rate (HR), systolic blood pressure (SBP) and diastolic blood pressure (DBP)were recorded. At T4, leaving the recovery room ( T5), 4 hours after the operation ( T6), 8 hours after operation (T7), the numeric pain rating scale (NRS) were recorded. The overall amount of remifentanil and Oxycodone were record. The wake up time, additional analgetic cases and the adverse reactions were recorded. Results The average HR, SBP and DBP fl uctuations in the O 2 and O 3 groups were not more than 20.00% of the basal values. There was no signifi cant difference in wake up time between the three groups. There were 22 cases of patients, the NRS > 4, in O1 group requires additional analgesics after they wake up, more than O 2 and O 3 group (7, 3 respectively,P < 0.05). The overall Oxycodone consumption of the three groups were O1: (18.93 ± 4.34) mg (0.90~2.60 mg),O2: (25.50 ± 4.49) mg (1.40~3.00 mg), O3: (26.10 ± 4.55) mg (1.80~3.40 mg) (F = 23.79, P = 0.000). There was no signifi cant difference in adverse reactions between the three groups, but one patient had respiratory depression in O3 group. Conclusion The optimum dose of Oxycodone for anesthesia inducing in laparoscopic cholecystectomy were 0.30 mg/kg.
Oxycodone; laparoscopic cholecystectomy; anesthesia induction
R657.4;R614.2
A
10.3969/j.issn.1007-1989.2016.08.007
1007-1989(2016)08-0029-05
2016-03-18
