急性胰腺炎局部并发症定义及治疗的演变
2016-09-08金梦钱家鸣芦波张慧敏吴东杨红
金梦 钱家鸣 芦波 张慧敏 吴东 杨红
·综述与讲座·
急性胰腺炎局部并发症定义及治疗的演变
金梦钱家鸣芦波张慧敏吴东杨红
急性胰腺炎(AP)是临床常见急腹症,我国总体病死率4.6%,重症患者病死率可高达15.6%~30%[1]。AP患者的临床经过有两个死亡高峰[2],除早期全身器官衰竭所致的死亡高峰外,在病程晚期(发病2周后)胰腺及胰周的局部并发症逐渐显现,部分患者可继发感染导致病情二次加重,此为AP患者死亡的第2个高峰。文献报道胰腺坏死及其继发的并发症占AP患者死亡病因的70%~86%[3]。故AP局部并发症对预后有着重要影响。本文将重点阐述近年来AP局部并发症概念和诊治策略的演变,加深临床医师对AP局部并发症的认识。
一、急性胰腺炎局部并发症概念的演变
1990年以前对于AP局部并发症的认识较为混乱,以“胰腺脓肿”为例,有学者回顾1956年至1987年间45篇提及AP局部病变的文献,仅11篇明确提出了胰腺脓肿的定义,且所有定义均不相同[4]。1992年亚特兰大标准[5](以下称1992年标准)首次对AP局部并发症做出定义,分为以下4种:(1)急性液体积聚:发生于病程早期,胰腺内或胰周或胰腺远隔间隙液体积聚,并缺乏完整包膜。(2)假性囊肿:有完整非上皮性包膜包裹的液体积聚,内含胰腺分泌物、肉芽组织、纤维组织等。(3)感染性坏死:即在胰腺坏死的基础上合并感染。(4)胰腺脓肿:胰腺内或胰周的脓液积聚,外周为纤维囊壁,为病程晚期表现。
但自1992年以来,以增强CT为代表的影像技术发展迅速,同时经皮穿刺引流、内镜下引流、微创手术引流等微创技术的发展为AP患者的临床诊治带来有力支持,故临床工作者对其局部并发症的认识发生了变化。2012年新亚特兰大标准[2](以下称2012年标准)对局部并发症的概念做出了修订(图1),其改动主要在于以下3点:(1)对急性液体积聚的成分做出界定,以是否含有固体坏死物质分为急性胰周液体积聚(acute peripancreatic fluid collection, APFC)和急性坏死物积聚(acute necrotic collection, ANC);(2)强调胰腺局部并发症随病程的变化,分为早期并发症和晚期并发症,其中APFC和ANC为AP发病4周以内的早期并发症,胰腺假性囊肿和包裹性坏死(walled off pancreatic necrosis, WOPN)为AP发病4周后的晚期并发症;(3)强调胰腺炎各期、各类并发症均有继发感染的可能,不再将感染性胰腺炎、胰腺脓肿等作为独立并发症。依据2012年标准[2],各并发症定义如下。
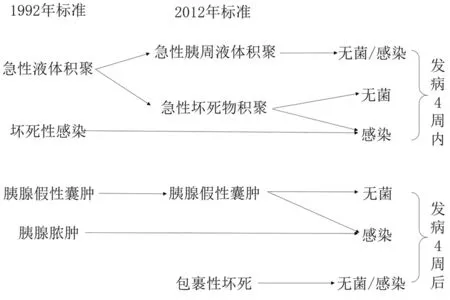
图1 急性胰腺炎局部并发症概念的演变
1.早期并发症:(1)APFC:指病程早期出现于胰腺周围的富含胰酶的液体渗出,30%~50%的患者在发病48 h内即可出现。其影像学特点为无壁、内容物均质,以正常筋膜为界。(2)ANC:同样出现于AP早期,其内包含两种成分,一种为急性胰周积聚的液体,另一种为胰腺组织和(或)胰周组织坏死(在增强CT中表现为一区或多区的无强化组织)。病程早期的胰腺坏死在影像学上不易与脂肪浸润区分,二者均表现为低密度、无强化,故需在长期随访后做出诊断。
2.晚期并发症:(1)胰腺假性囊肿:继发于APFC。主要特点为有囊壁包裹,内容物均质、无固体成分。AP继发的假性囊肿与慢性胰腺炎继发的假性囊肿有所不同,此类囊肿与胰管交通少见,无胰管狭窄表现[6]。(2)WOPN:继发于ANC,取代既往“机化性胰腺坏死”、“胰腺假性囊肿合并坏死”和“中央空洞型坏死”等模糊而易混淆的概念。其影像学特点为有囊壁形成,增强CT可见囊壁强化,内含不均匀的坏死物。
3.概念更新:胰腺脓肿方面,2012年标准弱化了该定义的地位,因其指仅有脓液(液体密度)而无坏死组织,即继发感染的胰腺假性囊肿,其囊壁比无菌性假性囊肿更厚、更不规则,极为少见。2012年标准强调,感染在AP中并非一个独立的并发症,而是在胰腺炎的各个阶段均有可能继发。在病程中出现2次发热、复发性腹痛、白细胞增多、血清胰酶活性再次升高、器官功能障碍加重时,需考虑并发感染可能。
此外,近年对其他AP局部并发症的认识也逐渐深入,包括血栓事件、假性血管瘤、胃排空障碍、结肠坏死等,腹腔间隔室综合征(abdominal compartment syndrome, ACS)也是AP患者常见并发症之一。
二、急性胰腺炎局部并发症治疗理念的改变
近几年来AP局部并发症治疗策略从既往“以外科治疗为核心”的治疗方案逐渐转变为“早期重症监护、晚期干预”理念。
早在20世纪初,随着麻醉技术的发展,有学者开始尝试用开腹手术和纱布引流治疗重度急性胰腺炎[7]。在随后的30年中,手术逐渐成为胰腺炎的治疗手段之一,但却面临着超过50%的死亡率。1960至1970年曾有学者试图通过广泛切除胰腺及坏死物达到早期根治的目的,但是因过高的死亡率而被弃用。上世纪90年代,Bradley等[8]的一项前瞻性研究表明,未继发感染的坏死性胰腺炎患者即使合并呼吸功能衰竭、肾功能衰竭也能通过非手术治疗缓解,自此人们逐渐意识到手术并非局部并发症唯一有效的治疗手段,手术在AP局部并发症治疗中的地位逐渐下降。近年来,随着影像学技术的创新以及介入技术的发展,AP局部并发症的治疗再次迎来了重大变革,数项介入和微创技术得到愈加广泛的应用,如经内镜逆行性胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP),细针抽吸(fine needle aspiration, FNA),经皮或内镜下引流胰周积液、假性囊肿和胰腺脓肿,超声血管造影和导管栓塞技术治疗AP合并出血等。
1.APFC和胰腺假性囊肿:目前普遍认为APFC可在发病数周内自行消失,无需干预,仅在合并感染时才有穿刺引流的指征[9]。
假性囊肿的治疗方面,早年临床医师即认识到大多胰腺假性囊肿无需特殊干预[10],1990年Singer等[11]提出“watch and wait”策略。目前研究普遍认为,无菌的假性囊肿约60%可自行吸收[12],部分假性囊肿可以自行与胆管、肠道相通从而达到自行缓解。如囊肿持续增大或出现明显压迫症状时,推荐通过ERCP或磁共振胰胆管成像判断解剖结构,可采取内镜下支架置入术[13]或经皮穿刺引流[14]治疗。其中,胰腺假性囊肿的内镜治疗首先由Baron等[15]于1996年报道,通过内镜将鼻胰引流管(管径通常为10F)置入腹膜后,路径包括经胃和经十二指肠两种,成功率可达80%,但由于其操作技术要求较高,目前临床应用尚不广泛。传统手术已经极少被应用于假性囊肿,但胰头或胰体部的胰腺瘘管有时仍需要手术干预[16]。
2.ANC和WOPN:就ANC而言,因坏死物质的存在持续刺激炎症反应,既往建议早期手术清除,认为尤其适用于并发器官衰竭的患者,可提高其生存机会,但手术死亡率可高达50%~65%[3, 17]。现今,对于AP患者的手术干预实际已达成广泛共识——尽可能延缓干预时间,发病后3~4周后为最佳时机。此时坏死组织已被包裹,可达到一次清除的目的,降低了术中出血、胰漏、周围重要结构破坏的风险,减少了胰腺内分泌和外分泌功能的损伤。
微创手术的提出被认为能够减轻对患者的物理创伤,但早期研究并未发现患者死亡率和并发症的显著下降。随着腹膜后路径的出现,研究报道微创手术成功率上升至60%~100%,死亡率仅为0~27%[18-19],但这些研究的入选患者存在偏倚,无法与手术患者直接比较。同时微创手术也存在其局限性,多部位病灶的患者往往需面临多次手术。故目前对于微创手术仍建议在病程4周以后进行,并依据患者情况制定个体化手术方案。
此外,内镜治疗技术也被应用于WOPN的患者,但其中40%患者引流后继发感染,且45%的患者出现了严重的并发症,如出血、胃穿孔等,目前开展较少,且缺乏多中心大样本数据[15]。
对并发胰腺坏死的患者而言,约30%患者需面临胰管漏或胰管离断综合征的问题,因其严重影响患者治疗效果和生存质量[20-21]。胰管漏或胰管离断综合征的患者会面临反复腹腔积液、胰源性腹水、胰腺皮肤瘘管等多种长期并发症。治疗方面,除充分内科治疗外,首选内镜下引流、内镜下支架置入术,无效者或难度较大者可考虑外科手术治疗。
3.局部并发症合并感染:当临床怀疑局部并发症继发感染时,如患者存在发热、腹痛及腹膜炎体征,或影像学见液体或坏死物内气体影,可无需FNA穿刺即诊断继发感染;若证据不足,可考虑经皮FNA,并行革兰染色和细菌培养。
既往感染性胰腺坏死被认为是坏死清创术的绝对指征,但也同时面临着术后高死亡率、高并发症的问题[22-23]。2010年一项88例随机对照研究[24]比较了开腹坏死清创术和“step-up”(经皮引流+必要时微创手术清除坏死物)治疗策略,证实“step-up”方法能够降低43%的死亡率,其中有35%的患者仅需经皮穿刺引流即可治愈。一项纳入了12项研究共324患者的meta分析[25]显示,感染性胰腺坏死的患者采取非手术治疗(支持治疗、抗生素和经皮导管引流)约有64%的成功率,死亡率为12%。
在各项非手术治疗手段中,经皮导管引流作为主要的治疗手段有50%的成功率。1998年Freeny等[26]首次报道了一系列采用CT引导下经皮穿刺引流治疗的感染性AP患者。经皮穿刺引流除能够引出感染的坏死物之外,还能通过大管径(28F)引流管进行积极的灌洗,可使47%的患者避免手术[27]。Mann等[28]在此基础上进一步探索出在大管径引流管基础上结合网篮、圈套等技术,86.2%(25/29)的患者治疗有效。尽管在介入治疗下,仍有约26%患者需要进一步清创术或其他手术,但介入穿刺引流至少能够为手术争取更多的时机,尽可能地帮助患者平稳过渡至坏死物被完整包裹。
但需注意,虽然微创手术和介入穿刺引流具有创伤小、恢复快的优点,但部分重症胰腺炎患者往往坏死组织范围较广,微创清除及引流难以达到理想效果,多次引流又会增加感染的风险,故治疗方式的选择仍应结合患者实际情况、病变范围、营养状态等多因素评估决定。
综上所述,随着AP局部并发症概念的更新,其治疗理念也逐渐发生变化。临床工作者需重视AP患者的局部并发症,定期随访,依据不同患者的并发症种类采取合适的干预策略,以改善患者预后。
[1]急性胰腺炎协作组. 中国6 223例急性胰腺炎病因及病死率分析[J]. 胰腺病学, 2006, 6(6): 321-325.DOI:10.3760/cma.j.issn.1674-1935.2006.06.001.
[2]Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis-2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111.DOI: 10.1136/gutjnl-2012-302779.
[3]Mier J, Leon EL, Castillo A, et al. Early versus late necrosectomy in severe necrotizing pancreatitis[J]. Am J Surg, 1997, 173(2): 71-75.DOI:10.1016/s0002-9610(96)00425-4.
[4]Lumsden A, Bradley EL 3rd. Secondary pancreatic infections[J]. Surg Gynecol Obstetrics, 1990, 170(5): 459-467.
[5]Bradley EL 3rd. A clinically based classification system for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta, Ga, September 11 through 13, 1992[J]. Arch Surg, 1993, 128(5): 586-590.
[6]D′egidio A, Schein M. Pancreatic pseudocysts: a proposed classification and its management implications[J]. Br J Surg, 1991, 78(8): 981-984.
[7]Bradley EL 3rd, Dexter ND. Management of severe acute pancreatitis: a surgical odyssey[J]. Ann Surg, 2010, 251(1): 6-17.DOI: 10.1097/SLA.0b013e3181c72b79.
[8]Bradley EL 3rd, Allen K. A prospective longitudinal study of observation versus surgical intervention in the management of necrotizing pancreatitis[J]. Am J Surg, 1991, 161(1): 19-24.
[9]Working Group IAP/APA/APG. Acute Pancreatitis Guidelines. IAP/APA evidence-based guidelines for the management of acute pancreatitis[J]. Pancreatology, 2013, 13(4 Suppl 2): e1-15.DOI: 10.1016/j.pan.2013.07.063.
[10]Farthmann EH, Lausen M, Schoffel U. Indications for surgical treatment of acute pancreatitis[J]. Hepato-gastroenterology, 1993, 40(6): 556-562.
[11]Singer MV, Forssmann K. Non-surgical therapy of pancreatitis complications (pseudocyst, abscesses, stenoses)[J]. Schweiz Rundsch Med Praxi, 1994, 83(32): 865-869.
[12]Diculescu M, Ciocirlan M, Ciocirlan M, et al. Predictive factors for pseudocysts and peripancreatic collections in acute pancreatitis[J]. Rom J Gastroenterol, 2005, 14(2): 129-134.
[13]Zein CO, Baron TH, Morgan DE. Endoscopic pancreaticoduodenostomy for treatment of pancreatic duct disconnection because of severe acute pancreatitis[J]. Gastrointest Endosc, 2003, 58(1): 130-134.DOI:10.1067/mge.2003.280.
[14]Tsiotos GG, Sarr MG. Management of fluid collections and necrosis in acute pancreatitis[J]. Curr Gastroenterol Rep, 1999, 1(2): 139-144.
[15]Baron TH, Thaggard WG, Morgan DE, et al. Endoscopic therapy for organized pancreatic necrosis[J]. Gastroenterology, 1996, 111(3): 755-764.
[16]Werner J, Feuerbach S, Uhl W, et al. Management of acute pancreatitis: from surgery to interventional intensive care[J]. Gut, 2005, 54(3): 426-436.DOI:10.1016/j.surg.2005.03.010.[17]Hartwig W, Maksan SM, Foitzik T, et al. Reduction in mortality with delayed surgical therapy of severe pancreatitis[J]. J Gastrointest Surg, 2002, 6(3): 481-487.
[18]Connor S, Ghaneh P, Raraty M, et al. Minimally invasive retroperitoneal pancreatic necrosectomy[J]. Dig Surg, 2003, 20(4): 270-277.
[19]Castellanos G, Pinero A, Serrano A, et al. Infected pancreatic necrosis: translumbar approach and management with retroperitoneoscopy[J]. Arch Surg, 2002, 137(9): 1060-1063.
[20]Uomo G, Molino D, Visconti M, et al. The incidence of main pancreatic duct disruption in severe biliary pancreatitis[J]. Am J Surg, 1998, 176(1): 49-52.
[21]Tenner S, Baillie J, Dewitt J, et al. American college of gastroenterology guideline: management of acute pancreatitis[J]. Gastroenterology, 2013, 108(9): 1400-1415. 1416.DOI: 10.1038/ajg.2013.218.
[22]Berzin TM, Banks PA, Maurer R, et al. CT-guided percutaneous catheter drainage in necrotizing pancreatitis: outcomes among patients discharged with drains in place[J]. J Vasc Interv Radiol, 2008, 19(7): 1002-1006.DOI: 10.1016/j.jvir.2008.03.002.
[23]Szentkereszty Z, Kerekes L, Hallay J, et al. CT-guided percutaneous peripancreatic drainage: a possible therapy in acute necrotizing pancreatitis[J]. Hepato-gastroenterology, 2002, 49(48): 1696-1698.
[24]van Santvoort HC, Besselink MG, Bakker OJ, et al. A step-up approach or open necrosectomy for necrotizing pancreatitis[J]. N Engl J Med, 2010, 362(16): 1491-1502.DOI: 10.1056/NEJMoa0908821.
[25]van Baal MC, van Santvoort HC, Bollen TL, et al. Systematic review of percutaneous catheter drainage as primary treatment for necrotizing pancreatitis[J]. Br J Surg, 2011, 98(1): 18-27.DOI: 10.1002/bjs.7304.
[26]Freeny PC, Hauptmann E, Althaus SJ, et al. Percutaneous CT-guided catheter drainage of infected acute necrotizing pancreatitis: techniques and results[J]. Am J Roentgenol, 1998, 170(4): 969-975.DOI:10.2214/ajr.170.4.9530046.
[27]Endlicher E, Volk M, Feuerbach S, et al. Long-term follow-up of patients with necrotizing pancreatitis treated by percutaneous necrosectomy[J]. Hepato-gastroenterology, 2003, 50(54): 2225-2228.
[28]Mann S, Gmeinwieser J, Schmidt J, et al. Possibilities and limits of interventional therapy in necrotizing pancreatitis[J]. Zentralbl Chir, 2001, 126(1): 15-22.DOI: 10.1055/s-2001-11717.
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2016.04.016
100730北京,中国医学科学院,北京协和医学院,北京协和医院消化科
杨红,Email: hongy72@163.com
2015-09-06)
