表面活性剂促进气体水合物生成的研究
2016-09-07谢育博刘道平
谢育博 杨 亮 刘道平 杨 梦
(上海理工大学能源与动力工程学院新能源科学与工程研究所 上海理工大学流动控制与仿真重点实验室 上海 200093)
表面活性剂促进气体水合物生成的研究
谢育博杨 亮刘道平杨 梦
(上海理工大学能源与动力工程学院新能源科学与工程研究所 上海理工大学流动控制与仿真重点实验室上海200093)
天然气水合物被公认为21世纪的重要后续能源,其生成与压力、温度、气水接触面积以及添加剂等因素有关。文章概述了表面活性剂的基本性质,并从改变反应液的表面张力、形成胶束、改变水合物形貌等方面总结了表面活性剂对促进水合物生成的影响,提出了其促进水合物生成的机理。对于未来的研究,我们不仅要观察水合物的形态,也要从水合物膜的内部结构分析表面活性剂对水合物的生成影响,为水合物生成机理形成统一的认识和气体水合物进一步发展提供参考。
表面活性剂;气体水合物;综述;生成;促进效果
气体水合物是水与天然气、CO2等气体分子在一定的压力和温度条件下形成的非化学计量的笼状晶体物质,故又称为笼型水合物。主体分子即水分子以氢键相互结合形成晶格网络,客体分子即气体分子受到范德华力约束填在晶格内。气体水合物具有高储气量、呈固态便于储存运输、经济安全等特点。气体水合物法气体分离、海水淡化、CO2捕集与储存、果汁提浓、水合物蓄冷等方面[1]在工业应用中得到广泛关注与高度认可。
然而水合物在工业应用过程中遇到的最大的技术难题是如何提高水合物的生成速率、增大水合物的储气密度。目前常用的强化方法包括机械强化和化学物理强化两种类型。机械强化主要是搅拌、喷雾和鼓泡等方式。郝文峰等[1]通过有无搅拌条件下甲烷水合物生成过程中的反应速率和液相温度的变化对比,证明搅拌对甲烷水合物的生成反应有巨大的影响,有效的缩短了反应时间。同时发现搅拌时间和搅拌速率对水合物生成也有较大影响,即搅拌时间短或者没有搅拌,气液扩散速率低,影响储气效果;搅拌时间长,水合物晶核与搅拌碰撞而分解。由于水的雾化可以有效提高气-水接触面积,刘道平等[2]设计和建造了一个半间歇式雾流强化装置,在初始p=3.52 MPa,T=274 K的实验条件下通过实验发现喷雾能促进水合反应的进行,有效地缩短诱导时间,并且认为系统初始水温一定时,初始压力越高,诱导时间越短;系统初始压力一定时,初始水温越低,诱导时间越短。但是机械强化也带来一些不利因素,如搅拌系统消耗的能量使悬浮液变厚,导致水合物形成总量降低,并且机械强化系统需要额外的工具,使系统变得复杂,增加了生产成本。物理化学强化是通过在水中加入适当的化学添加剂改变水的性质。从纳米尺度和分子尺度层面强化水气接触,促进水合物的成核生长。采用动力学添加剂的方法是一种常用且有效促进水合物生成的方法,如向水中加入表面活性剂。
1 表面活性剂及其对水合过程的影响
1.1 表面活性剂
所谓表面活性剂[3]就是在溶剂中少量加入时即能显著降低其表面张力,改变体系界面状态,从而产生润湿或反润湿、乳化或破乳、分散或凝集、起泡或消泡、增溶等一系列作用,以满足实际应用要求。它包括阴离子表面活性剂、阳离子表面活性剂和非离子表面活性剂三种类型。表面活性剂具有以下基本性质[3]:
1)双亲媒性。表面活性剂的分子结构由疏水基团和亲水性离子基团构成,既有亲水性又有亲油性。
2)形成胶束。表面活性剂形成胶束的最低浓度为临界胶束浓度(CMC)。通常表面活性剂的浓度高于临界胶束浓度时,才能充分发挥表面活性剂的功能。
3)界面吸附定向排列。表面活性剂的表面吸附作用在气-液、液-液、和液-固界面上选择性吸附,定向排列成分子层,水的表面张力下降较小。随着浓度的增大,表面活性剂分子聚集到气液界面,使表面张力急剧下降。当表面活性剂分子增加到一定程度(CMC)时,溶液表面形成单分子膜,表面张力降低到最低点。
1.2 表面活性剂对水合过程的影响
向水中加入表面活性剂,不影响气体水合物相平衡条件,但能使气-液界面张力降低,减小水合物反应体系中气体分子进入液相的扩散阻力。张琳等[4]指出:形成的表面活性剂胶团使气体分子在溶液中的溶解度增加,增加了气液接触面积,使其更充分的结合生成水合物晶核,加快了水合物的成核,缩短了诱导时间,提高了水合物生成效率。
表面活性剂胶团对生成速度常数的影响随表面活性剂浓度变化,并在一定浓度时出现最大值。这是由于胶团不仅使反应物在胶团与溶液的界面上富集,而且还对反应体系有其他影响。这些影响也会改变反应速度。其中之一是将反应物加溶到胶团内部,会使反应物在溶液中的活度降低。因此表面活性剂在浓度太大时往往会引起反应速度的降低[3]。
2 表面活性剂促进水合过程机理
Kalogerakis N等[5]首次发现表面活性剂对甲烷水合物生成有促进作用,并研究了不同类型表面活性剂对甲烷水合物生成动力学的影响,发现低浓度的表面活性剂不影响水合物热力学,但加快了水合物的生成速率并提高了气体在溶液中的溶解度。对于表面活性剂促进水合物生成的机理,目前有以下几种说法(图1)。

图1 表面活性剂促进水合的不同方式Fig.1 The different ways of surfactant promote hydration
2.1 表面活性剂改变溶液表面张力
在不含表面活性剂的溶液中,形成的水合物薄膜覆盖了气液接触表面,阻碍了气液接触,水合物就会停止生长,但是,在含有表面活性剂的水溶液中,水合物的生成速率得到了很大的提升,因此Sloan提出表面活性剂之所以能提高水合物的生成速率,主要是因为表面活性剂能降低水溶液的表面张力,使气体更容易进入液相。罗虎[6]利用悬浮气泡法测定了甲烷水合物在不同浓度的十二烷基硫酸钠(SDS)溶液中水合物膜的生长速率,认为在浓度较低时(50 mg/L或100 mg/L),降低界面张力在SDS对水合物促进作用中占主导因素。周诗岽等[7]向气体反应液中添加表面活性剂,他们也认为水合物生成速率的加快是由于加入表面活性剂后溶液的表面张力大大减小,导致气体分子进入液相的速度大大加快。但是,这种说法很难解释在含表面活性剂的静态体系中,水合物的生成速率一直维持在很高水准的这一现象[8],因此有人提出了“胶束”说。
2.2 表面活性剂形成胶束
1) 否定胶束存在
Zhong Y等[9]提出了“胶束”说,但是这一说法引起了很多人的质疑。Profio P D等[10]提出:表面活性剂在促进水合物形成的过程中是否能真的形成胶束。离子型表面活性剂稀水溶液与强电解质稀溶液具有相同的导电规律[11],即当浓度小于临界胶束浓度时其电导率随着浓度的增大而增大,且增大较快;当浓度大于临界胶束浓度时其电导率随着浓度的增大而增大,但增大的速率减慢。Profio P D利用表面活性剂水溶液的这一特性,在分别含有甲烷和氮气的条件(T=275 K,p=4.00 MPa)下,对含有阴离子表面活性剂SDS、月桂酸钠(SL)、油酸钠(SO)、十二烷基苯磺酸(DBSA)和阳离子表面活性剂盐酸十二烷胺(DAHCL)、十二烷基三甲基溴化铵(DTACL)的水溶液进行电导率测量。通过实验结果表明,在T=275 K、p=4.00 MPa条件下,表面活性剂SDS、SL、DAHCL在达到CMC之前就形成沉淀,并且没有迹象表明形成了胶束;表面活性剂SO、DBSA、DTACL确实形成了胶束,但是CMC值与标准条件下基本一致。他们认为在T=275 K时,电导率曲线的下滑是由于溶液中离子迁移率随温度的降低而降低。在此前的实验中,对于这些表面活性剂对水合物形成速率有显著提高的溶液都不会形成胶束。水合物诱导时间降低的原因还需要其他的实验验证。并且他们指出这种现象的结构特征需要借助Raman和X射线进行阐明。
Watanabe K等[12]也对Zhong Y等提出了同样的质疑。他们在静态HFC-32+水体系中考察了表面活性剂SDS对水合物形成的影响。在p=0.10~0.40 MPa范围内测量SDS溶液的表面张力,发现与在常温常压下测量的数值基本一致,且没有迹象表明溶液浓度在达到CMC以后表面张力会明显下降。由实验分析发现在T=279 K时,溶液不论是在大气压下与空气直接接触还是在p=0.40 MPa下与HFC-32接触,SDS都不会形成胶束。SDS溶液浓度变化的一个特征值是溶解度值而不是CMC。他们认为添加SDS后会在溶液表面和表面上方的器壁上形成更厚、多孔的水合物层,在水合物形成速率的峰值处,SDS浓度比气体的溶解度值稍低,当达到溶解度值后,继续添加SDS会引起水合物形成速率的降低,但总的水转化为水合物的比率增加。在2007年,Okutani K等[13]对这一结论进行了修正,他认为水合物形成速率和总的水转化成水合物的比率都会增加。
在甲烷形成的条件下Krafft点不会从标准范围(281~289 K)偏移,于是Zhang J S等[14]提出:甲烷水合物生成的条件低于标准的Krafft点时,SDS能否形成胶束?他们通过实验分析发现SDS在甲烷形成条件下的溶解度与在T=270~282 K、标准大气压下的溶解度相同,并通过取样分析发现SDS的溶解度不会超过1780 mg/kg。基于这一发现,他推断在水中添加SDS超过1780 mg/kg时,会形成固体晶粒而不是胶束。在低于Krafft点条件下,不论溶液是与甲烷还是与空气接触,SDS都不会形成胶束。SDS对气体水合物成核的促进作用,不是因为SDS胶束微粒的参与,而是由于SDS吸附在水合物晶核上以减少成核的能耗。
2) 胶束存在但不促进水合过程
根据上述结论可知胶束形成的体系最低温度不能低于Krafft点,但是如果表面活性剂的Krafft点较低,在水合物生成的条件下可以形成胶束,那么它又是如何影响水合物生成的?在2007年,Profio P D等[15]又通过电导率测量的方法进行实验分析。由于DBSA、SO、CTPABr三种表面活性剂具有较低的Krafft点。他们经过实验分析证实这三种表面活性剂只要初始浓度高于CMC,在p=4.00 MPa、T=275 K条件下就可以形成胶束。但是他们却发现在搅拌系统中,表面活性剂浓度大于CMC时的反应速率比小于CMC时稍慢。于是他们推断表面活性剂胶束不是加速而是抑制水合物的形成。
Zhang J S等[16]研究了SDS在甲烷水合物生成过程中的作用,发现SDS减小了水合物的诱导时间,但是在SDS浓度为260 mg/kg~10000 mg/kg范围内和诱导时期之间,没有观察到系统化的趋势。因此,他推断即便有SDS胶束或SDS沉淀剂,它们对水合物成核的影响也很小。
3) 胶束增加气体溶解度
Zhong Y等[9]在SDS静态体系中发现CMC为242 kg/m3,超过此浓度水合物的反应速率较静止系统提高700倍,主要是由于形成胶束能够增溶乙烷气体,提高气体在水中的溶解度,促进水合物的形成。他们认为当浓度达到CMC时,会形成大量球形胶束。

图2 胶束模型Fig.2 Micelle model
每个胶束由60个硫酸十二指单体组成,胶束的憎水基聚集在一起,亲水基分布在周围形成一个具有孔隙的空腔结构。客体分子被包裹在空腔里,水分子聚集在球形胶束的周围,这样增加了气体在水中的溶解度,起到良好的增溶作用,缩短了诱导时间,增加了储气量。在实验中还发现, 含SDS的体系生成的水合物均匀地附在整个反应器壁上,并且生成的水合物所含的静态水很少,水合物的生成率高达86%。而不含SDS的体系生成的水合物却凌乱地堆在反应器底部, 水合物含有大量的静态水。为了解释观察到的这种现象,他们提出了含表面活性剂的水合物生成历程[8]:1)水合物晶核在水相中生成,浮力使它们上升到气液界面;2)凝结的晶核快速移到金属-溶液-气体界面;3)随着液面的下降,水合物吸附在金属壁上;4)吸附在金属壁上的多孔水合物中的间隙水与自由气体继续反应生成新的水合物,使水合物在金属壁上快速生长。
2.3 表面活性剂改变水合物形貌
Mel’nikov首次提出水合物不会在水平面上形成一个致密的、无空隙的薄膜,而是形成的水合物晶体迁移到反应容器的器壁上,并在液面以上的器壁上形成较厚的、多孔的水合物层,多孔层通过毛细作用力吸入液体,直到系统中大部分水转化成水合物时,气液在多孔层内都能很好的接触[12]。
Okutani K等[17]选用SDS和SHS两种表面活性剂,通过宏观观察水合物生成状态,他们发现在溶液表面上有糊状的水合物层形成,同时在溶液表面上方的器壁上水合物层以更快的速度生长。糊状的水合物层是由很多细小的、树枝状的物质组成。随着这种树枝状物质数量的增多和每种树枝状物质的生长将会导致枝状物质局部的凝结,糊状水合物层的表面会越来越厚。
他们对于水合物层在器壁上生长的观点与Kutergin、Mel’nikov、Watanabe K等的观点是一样的。但是对于水合物层从水溶液表面向溶液内部生长的机理目前还没有得出更清晰的结论。后来根据Yoslim[18]用显微镜观察发现上述糊状水合物层向溶液内部生长的现象是由于内部大量的水通过多孔的水合物层输送到液面,为水合物的生长持续提供自由水,维持气液界面水合物层的生长。Okutani K等人认为在枝状水合物晶粒从溶液表面向下垂直生长的同时水合物层也在液面以上的器壁上生长,并且在器壁上生长的水合物层占据了形成的水合物的大部分。
Ando N等[19]在Okutani K等的实验基础上选用硫酸十二脂锂(LDS)、DBSA、SO三种不同的表面活性剂,这三种表面活性剂具有较低的Krafft点,在水合物形成的条件下可以形成胶束。实验结果表明:表面活性剂LDS、DBSA与Okutani K等观察到表面活性剂SDS、STS、SHS的现象是一样的,即多孔水合物层在溶液表面以上的器壁上生长,并且它们的数量占总的水合物数量的大部分。LDS的浓度在CMC的0.6~1.6倍范围内会显著提高水合物的反应速率和总的水的转化率,但是超过这个浓度范围外,水合物的反应速率和总的水的转化率没有明显提高。DBSA也有同样的实验现象。于是他们根据这种现象推断LDS和DBSA的胶束对水合物的形成没有实际的影响。
Yoslim J等[18]也观察到与Okutani K等观察到的类似的实验现象,即添加表面活性剂的系统不会在溶液表面形成致密薄膜,而是在气-液-固三相交界点开始形成较厚、多孔水合物层,并在气液界面以上沿器壁向上生长,在器壁上形成两种不同的水合物晶核,即生长较慢的叶状晶粒和生长较快的块状水合物(如图3所示)。然后在气液界面形成糊状水合物层,并向水的内部生长,但它不是形成针状晶粒树突,而是形成纤维状晶粒分支并且分支的数量随表面活性剂浓度的增大而增加。
2.4 水合物表面吸附表面活性剂分子
当今比较认可的关于水合物颗粒吸附表面活性剂促进水合过程的机理大致是:1)表面活性剂分子亲水基团吸附在水合物颗粒表面;2)水合物微粒间的粘附作用被消弱,增强颗粒表面与气体的接触面积。
Verrett J等[21]研究了SDS对甲烷溶解度和摩尔分数的影响。实验结果表明在SDS的浓度对水合物形成有显著促进作用时,对甲烷的溶解度没有影响,但是在水合物成核后即晶粒生长时期,表面活性剂在水合物生长过程中能增大甲烷在液相中的摩尔分数,于是推断甲烷摩尔分数的增加是水合物生成速率提升的主要因素。据估计,其它的因素如水合物微粒的表面面积可能也会影响水合物的生成速率,但还需进一步的实验研究。
Du J等[22]采用相同碳链长度的表面活性剂SDS、DAH、DTAC、DN2CL在T=274 K、p=15.00 MPa条件下非搅拌系统中进行实验观察(见表1)。在实验中可以看到DTAC对水合物的生成速率有很小的影响,但是其他三种能显著促进水合物的形成。由于溶液在系统温度低于Krafft点时是过饱和的,可以形成水合晶体表面活性剂,于是他们认为这三种表面活性剂可能是由水合晶体表面活性剂通过异构晶体促进甲烷水合物的成核。然而形成的水合晶体表面活性剂在气体迁移方面产生制动效应,导致在成核或诱导时期甲烷的摩尔百分数减少。他们还认为在离子表面活性剂溶液中平衡离子可能影响甲烷水合物结构,反过来可能影响甲烷水合物形成的动力学。但是根据目前的科研结果来看,这种平衡离子影响的可能性是最小的,并且是由于表面活性剂的首基不同对甲烷水合物的形成有不同的影响。最终通过实验结果分析发现,水合物的生长速率和最终吸收的甲烷量不仅与表面活性剂的表面类型有关还与最初的表面活性剂的量有关。

图3 叶状水合物晶粒生长图Fig.3 The figure of leaf-like hydrate crystal growth

图4 表面活性剂在水合物微粒表面的吸附过程Fig.4 The adsorption process of surfactant on the surface of hydrate particles
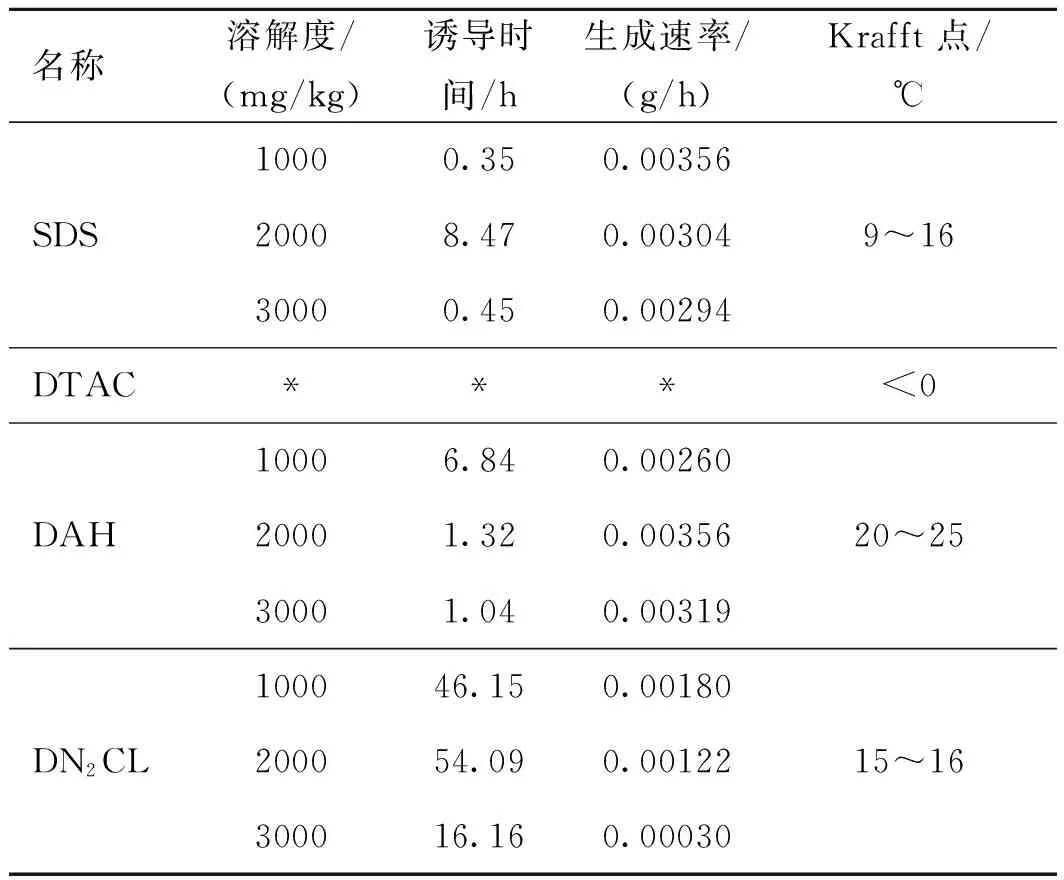
表1 实验数据对比
注:*表示在100 h内没有观察到DTAC的温度和压力变化。
3 结论与展望
国内外各研究机构对表面活性剂促进气体水合物快速生成进行了大量的实验研究,并取得了一定的成果,这些成果为表面活性剂促进水合物生成机理形成统一的认识提供了实验基础和参考依据。
从目前的研究进展可以看出,表面活性剂能显著提高水合物生成速率,改变水合物层的形貌和增大储气能力。因此,进行表面活性剂对水合物生成机理的研究对水合物工业化生产有很大的战略意义。目前对表面活性剂的实验研究虽然取得了一定成果,但是表面活性剂对水合物生成机理还没有形成一个统一的认识,离工业应用有很远的距离。
1)从目前来看表面活性剂对水合物生成机理的研究,大多集中在观察水合物的外在形态,但是不同的实验条件和不同种类的表面活性剂对水合物的形貌又有不同的影响,因此很难形成统一的结论。
2)水合物膜的生长是水合物生长的主要方式,但是目前对水合物膜内部结构缺乏深入研究和了解,因此表面活性剂对水合物生成机理还没有形成统一认识。
3)对本文通过分析总结可以得到表面活性剂对水合物生成机理可能是:在一定的温度和压力条件下,当表面活性剂的浓度达到CMC以后形成胶束,并且降低表面张力,水合物微粒间吸附作用减弱,客体分子进入微粒间隙,增加气体的溶解度,由于相邻水合物微粒表面的表面活性剂吸附同一个客体分子,因此逐渐形成多孔的水合物层,改变了水合物膜的形貌,增大气液接触面积,加速水合物的生成和增加储气密度。对于未来的研究,我们不仅要观察水合物的形态,也要从水合物膜的内部结构分析表面活性剂对水合物的生成机理,以便形成统一的结论。
本文受上海市重点学科建设资助项目(S30503)和上海理工大学自然科学基金培育项目(15HJPY-QN08)资助。(The project was supported by the Key Subject Construction in Shanghai (No. S30503) and Natural Science Foundation of University of Shanghai for Science and Technology (No. 15HJPY-QN08).)
[1]郝文峰, 樊栓狮, 王金渠. 搅拌对甲烷水合物生成的影响[J]. 天然气化工:c1化学与化工, 2005, 30(3):5-7. (HAO Wenfeng, FAN Shuanshi, WANG Jinqu. Effects of stirring on the formation of methane hydrate[J].Natural Gas Chemical Industry: c1 Chemical and Chemical Engineering, 2005,30(3):5-7.)
[2]刘道平, 潘云仙, 周文铸,等. 喷雾制取天然气水合物过程的特性[J]. 上海理工大学学报, 2007, 29(2):132-136. (LIU Daoping, PAN Yunxian, ZHOU Wenzhu, et al. Performance of natural gas hydrate production process in a batch reactor with water spraying[J]. Journal of University of Shanghai for Science and Technology, 2007, 29(2): 132-136.)
[3]陈光进, 孙长宇, 马庆兰. 气体水合物科学与技术[M]. 化学工业出版社, 2008.
[4]张琳, 王树立, 周诗岽,等. 表面活性剂用于促进气体水合物生成研究的进展[J]. 应用化学, 2014, 31(5):505-512. (ZHANG Lin, WANG Shuli, ZHOU Shidong, et al. Research progress in surfactant effect on promating gas hydrate formation[J]. Chinese Journal of Applied Chemistry,2014,31(5):505-512.)
[5]Kalogerakis N, Jamaluddin A K M, Bishnoi P R, et al. Effect of surfactants on hydrate formation kinetics[J]. Spe International Symposium on Oilfield Chemistry, 1993.
[6]罗虎. SDS促进水合物生成的机理及水合物膜生长动力学研究[D]. 北京:中国石油大学, 2006.
[7]周诗岽, 余益松, 张晓萍,等. 表面活性剂对气体水合物反应液表面张力的影响[J]. 天然气化工:c1化学与化工, 2013, 38:42-45. (ZHOU Shidong, YU Yisong, ZHANG Xiaoping, et al. Investigation on the effect of surfactant on surface tension of liquids for gas hydrate formation[J]. Natural Gas Chemical Industry: c1 Chemical and Chemical Engineering, 2013, 38:42-45.)
[8]徐勇军, 叶国兴, 杨晓西,等. 表面活性剂对水合物生成影响及其应用前景[J].天然气工业, 2002, 22(1): 85-87. (XU Yongjun, YE Guoxing, YANG Xiaoxi, et al. Effect of surfactants on hydrate formation and its application prospect[J].Natural Gas Industry,2002,22(1):85-87.)
[9]Zhong Y, Rogers R E. Surfactant effects on gas hydrate formation[J]. Chemical Engineering Science, 2000, 55(19):4175-4187.
[10] Profio P D, Arca S, Germani R, et al. Surfactant promoting effects on clathrate hydrate formation: are micelles really involved?[J]. Chemical Engineering Science, 2005, 60(15): 4141-4145.
[11] 王明德. 临界胶束浓度与电导率的变化[J]. 陕西师范大学学报:自然科学版, 2005(Suppl.1).(WANG Mingde. Critical micelle concentration and the changes of conductivity[J]. Journal of Shanxi Normal University:Natural Science Edition, 2005(Suppl.1).)
[12] Watanabe K, Imai S, Mori Y H. Surfactant effects on hydrate formation in an unstirred gas/liquid system: an experimental study using HFC-32 and sodium dodecyl sulfate[J]. Chemical Engineering Science, 2005, 60(17):4846-4857.
[13] Okutani K, Kuwabara Y, Mori Y H. Surfactant effects on hydrate formation in an unstirred gas/liquid system: amendments to the previous study using HFC-32 and sodium dodecyl sulfate[J]. Chemical Engineering Science, 2007, 62(14):3858-3860.
[14] Zhang J S , Lee S, Lee J W. Does SDS micellize under methane hydrate-forming conditions below the normal krafft point?[J]. Journal of Colloid & Interface Science, 2007, 315(1):313-318
[15] Profio P D, Arca S, Germani R, et al. Novel nanostructured media for gas storage and transport: clathrate hydrates of methane and hydrogen[J]. Journal of Fuel Cell Science & Technology, 2007, 4(1):49-55.
[16] Zhang J S, Lee S, Lee J W. Kinetics of methane hydrate formation from SDS solution[J]. Industrial & Engineering Chemistry Research, 2007, 46(19):6353-6359.
[17] Okutani K, Kuwabara Y, Mori Y H. Surfactant effects on hydrate formation in an unstirred gas/liquid system: an experimental study using methane and sodium alkyl sulfates[J]. Chemical Engineering Science, 2008, 63(1):183-194.
[18] Yoslim J, Linga P, Englezos P. Enhanced growth of methane-propane clathrate hydrate crystals with sodium dodecyl sulfate, sodium tetradecyl sulfate, and sodium hexadecyl sulfate surfactants[J]. Journal of Crystal Growth, 2010, 313(1):68-80.
[19] Ando N, Kuwabara Y, Mori Y H. Surfactant effects on hydrate formation in an unstirred gas/liquid system: an experimental study using methane and micelle-forming surfactants[J]. Chemical Engineering Science, 2012, 73(19):79-85.
[20] Lo C, Zhang J S, Couzis A, et al. Adsorption of cationic and anionic surfactants on cyclopentane hydrates[J]. Journal of Physical Chemistry C, 2010, 114(31):13385-13389.
[21] Verrett J, Posteraro D, Servio P. Surfactant effects on methane solubility and mole fraction during hydrate growth[J]. Chemical Engineering Science, 2012, 84(52):80-84.
[22] Du J, Li H, Wang L. Effects of ionic surfactants on methane hydrate formation kinetics in a static system[J]. Advanced Powder Technology, 2014, 25(4):1227-1233.
About the corresponding author
Liu Daoping, male, Ph. D., professor, School of Energy and Power Engineering, University of Shanghai for Science and Technology, E-mail: dpliu@usst.edu.cn. Research fields: single pressure absorption refrigeration, formation of the natural gas.
Research in Surfactant Effect on Promoting Gas Hydrates Formation
Xie YuboYang LiangLiu DaopingYang Meng
(Institute of New Energy Science and Engineering, Key Laboratory of Flow Control and Simulation, School of Energy and Power Engineering, University of Shanghai for Science and Technology, Shanghai, 200093, China)
Nowadays, natural gas hydrates are recognized as an important future energy in 21 Century. Pressure, temperature, the contact area of gas and water, surfactant and other factors affect its formation. The basic properties of the surfactant are introduced in the present paper, and the effects of surfactant on the formation of hydrates are summarized from the changes of surface tension of liquids for gas hydrates formation, micelle formation and the hydrate morphology. The mechanism of surfactant promoting gas hydrates formation is then put forward. In order to form a unified understanding on hydrate formation mechanism, the hydrate form is not only observed, the influence of the surfactant on the formation of the hydrate is also analyzed from the internal structure of the hydrate film for the future research.
surfactant; gas hydrates; review; formation; promotion effect
0253- 4339(2016) 03- 0035- 07
10.3969/j.issn.0253- 4339.2016.03.035
2015年8月3日
TE832; TQ423.9
A
简介
刘道平,男,博士,教授,上海理工大学能源与动力工程学院,13501618727, E-mail: dpliu@usst.edu.cn。 研究方向:单压吸收式制冷,气体水合物生成技术。
