一种提取血小板蛋白的新方法
2016-09-06钱春美李永新杨兴才张晓峰
李 宁, 管 宇, 钱春美, 李永新, 杨兴才, 张晓峰
(上海中医药大学 附属上海市中医医院, 上海 200071)
一种提取血小板蛋白的新方法
李宁, 管宇, 钱春美, 李永新, 杨兴才, 张晓峰
(上海中医药大学 附属上海市中医医院, 上海200071)
目的:探讨高质量提取血小板蛋白的方法。方法:比较传统与改进后的提取血小板蛋白量,并进行蛋白定量和免疫蛋白印迹实验。结果:改进后的方法提取蛋白量平均为1.86 g/L,传统方法为1.21 g/L。免疫蛋白印迹实验表明,改进后的方法提取蛋白量高于传统方法,并且APP检测的结果好于传统方法。结论:通过实验可以得出改进后的提取蛋白方法,更有利于进行后续Alzheimer病的机理研究。
蛋白提取; 血小板; β-淀粉样前体蛋白
在细胞中,蛋白行使着重要的功能,参与细胞所有的功能性过程[1]。近年来,随着对Alzheimer病(AD)的研究,作为衡量其诊断效果的指标之一的血小板β-淀粉样前体蛋白(APP)成为研究热点[2]。血小板表达3种APP异构体:APP695、APP751、APP770。AD患者血小板APP异构体比率(APP130/APP106)异常可作为辅助诊断AD的重要生物指标[3]。从血小板中提取总蛋白检测APP就成为一个关键实验技术。本研究主要从基础研究出发,探讨一种新型的提取血小板总蛋白的方法,从而简化其流程。这种新的提取蛋白的方法对进一步研究APP异构率有着重要的作用。
1 材料与方法
1.1主要试剂
BCA蛋白定量试剂盒购自南京凯基生物科技发展有限公司;RIPA蛋白提取试剂盒购自南京凯基生物科技发展有限公司;磷酸盐缓冲液(PBS)购自南京凯基生物科技发展有限公司;M22C11抗体购自 Millipore;羊抗鼠二抗购自南京凯基生物科技发展有限公司;柠檬酸购自国药集团化学试剂有限公司;柠檬酸三钠购自国药集团化学试剂有限公司;葡萄糖购自国药集团化学试剂有限公司;氨基丁三醇购自国药集团化学试剂有限公司;蛋白酶抑制剂购自西格玛奥德里奇(上海)贸易有限公司;亮抑蛋白酶肽购自西格玛奥德里奇(上海)贸易有限公司;PMSF购自南京凯基生物科技发展有限公司。
1.2主要仪器
放射自显影分析系统为美国Bio-rad公司产品;光谱扫描多功能读数仪购自美国Thermo Fisher公司。
1.3实验材料
正常人血,年龄50~80岁。
1.4实验方法:
本实验分为两组对照的提取血小板蛋白方法,一组按照传统的步骤提取,另一组为改进后的提取方法。
1.4.1传统提取血小板蛋白
静脉采血5 mL,2% EDTA-Na2抗凝,离心200g、10 min;取血浆,1 500g、离心15 min后弃去上清,得到血小板,超声破碎20 s、2次。用BCA蛋白定量试剂盒测其浓度,并进行免疫蛋白印迹检测。
1.4.2改进后提取血小板蛋白
(1) Buffer A与Buffer B的配制:Buffer A(pH 6.4):38 mmol/L ditric acid (柠檬酸);75 mmol/L trisodium citrate(柠檬酸三钠);136 mmol/L glucose(葡萄糖)。
Buffer B(pH 7.4):5 mmol/L tromethamine(氨基丁三醇);1 mmol/L egtazic acid(依他酸);10 mmol/L EDTA;10 mg/L aprotinin (蛋白酶抑制剂);10 mg/L leupeptin(亮胰蛋白酶肽)0.1 mmol/L PMSF。
(2) 实验流程:静脉采血5 mL,2%EDTA- Na2抗凝;9∶1混合Buffer A中,室温下200g离心10 min;取富含血小板的血浆,1 500 g离心15 min,弃去上清;将沉淀重悬于500 μL的bufferB中,1 500 g离心5 min;然后利用RIPA蛋白提取试剂盒提取蛋白,应用BCA蛋白定量试剂盒进行蛋白定量,并进行免疫蛋白印迹检测。
2 结果
2.1BCA定量结果
各组分别选取6个采血样本进行BCA定量分析,结果见图1。改进方法后,平均5 mL血量提取蛋白为1.86 g/L,而传统方法提取蛋白量为1.21 g/L。
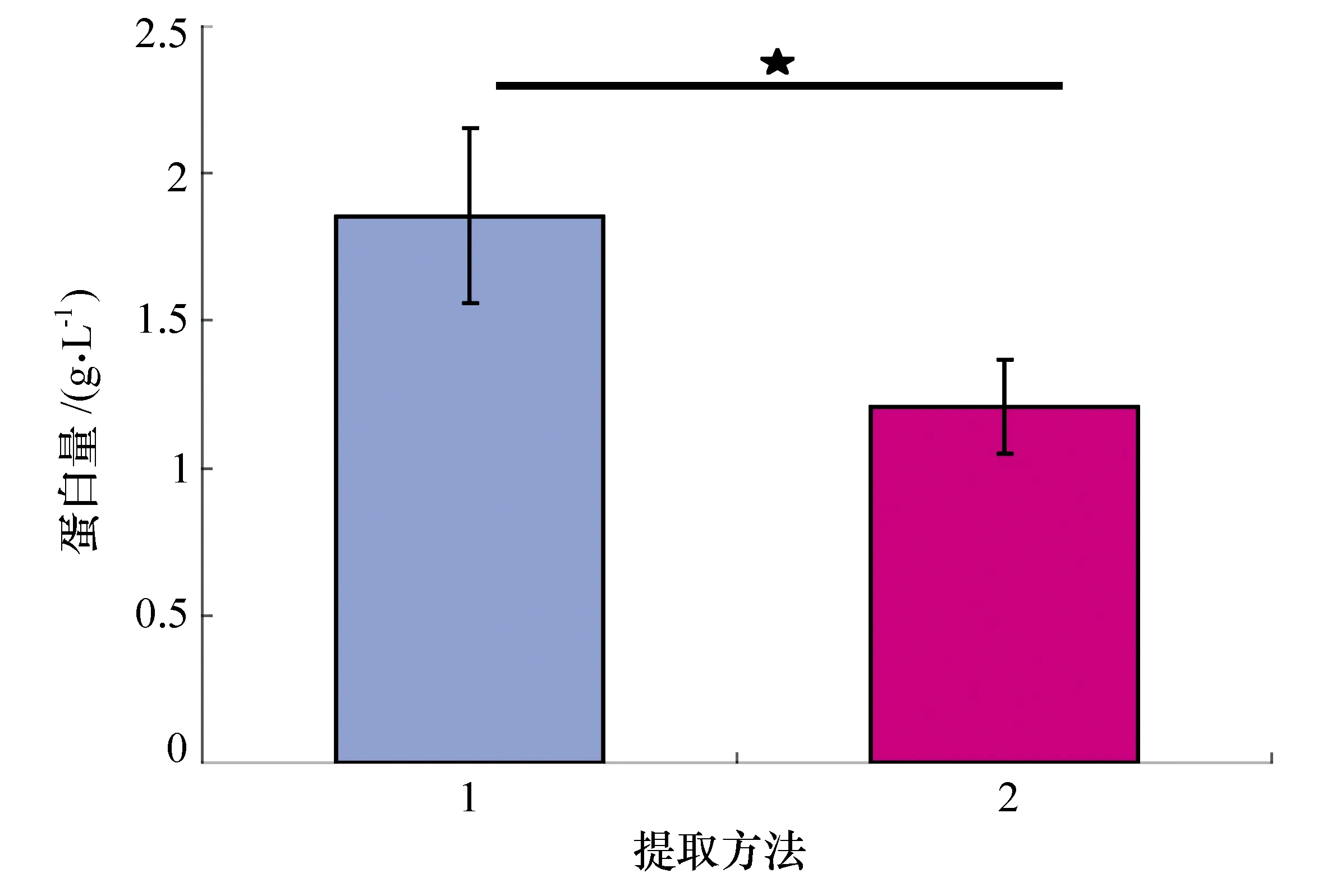
图1 两种方法提取蛋白量的比较(1为改进后提取蛋白量;2为传统方法提取蛋白量;★ T检验P<0.05)
2.2免疫蛋白印迹实验结果分析
蛋白提取后,进行免疫蛋白印迹分析。上样量体积为20 μL不变、蛋白浓度不同。结果(见图2)显示,改进方法后提取的蛋白量内参GAPDH的表达明显高于传统的提取方法。

图2 两种方法免疫蛋白印迹检测比较(1为改进后提取技术,2传统提取技术)
通过比较AD病人与正常对照组之间APP表达的差异(见图3),可以看出通过改进方法后提取的蛋白APP的异构率有明显的差异,可以确定改进方法提取的蛋白可以应用到后续AD发病机理的研究。

图3 应用新的方法比较AD病人与正常人之间APP的表达(1为AD病人血液,2为正常人血液)
3 讨论
APP异构体证实存在于脑脊液、血液和尿液中[4]。血小板膜APP的构成与中枢神经系统相似,区别仅在于mRNA水平和蛋白质水平。有研究表明,研究外周血血小板APP成分能够为研究AD发病机制和治疗提供线索[5-6]。Zubenko等[7]报道AD患者血小板膜可塑性和细胞骨架异常。另有研究表明AD患者血小板APP代谢及不同分子量成分出现异常。文献[8]表明,AD组的APP130/APP106比率明显于对照组。AD患者血小板APP加工异常导致APP130/APP106
比率降低,对于鉴别AD患者具有一定的临床意义。
在同样的采血量的情况下,改进后的方法明显提取到多量的蛋白。在进行免疫蛋白印迹实验中,上样的体积是一定的,蛋白含量不同(见图1),并且省略了许多的步骤,节省了时间以及试剂的消耗。本实验中,作为改进后的提取蛋白方法,借鉴了以往的分离血小板的方法并配制了相应的溶液[9],但是又相对改进了最后一步的提取方法,采用RIPA裂解液裂解血小板的方法提取蛋白,取得了浓度比较高的蛋白样品,并进一步确定了其相应的目的蛋白的表达[3,9]。在以往的提取血小板蛋白的方法中,用得最多的是高速离心分离血液[10],该方法不仅费时费力,而且容易混杂其他蛋白,造成蛋白纯度降低。改进后的方法只需要低速离心就可以取得很好的效果,并且实验费用降低。此外,改进后的方法中添加了两种蛋白酶抑制剂,使得提取的蛋白保存时间长,并且在蛋白不变性的情况下保存半年以上,可以进行后续的蛋白检测实验。有研究表明,离心力的不同可以导致不同的离心效果[11]。在本实验中,采用了1 500g的离心力,也取得了理想的效果。在一些特定蛋白提取过程中[12],也可应用一些蛋白特有标志抗体进行提取,但是该方法增加了提取费用,并且后续的功能性检测更加复杂。
References)
[1] Cooper G M. The cell: a molecular approach[M]. 2nd ed. ASM press, 2000.
[2] Li Q X, White S, Tanner J E, et al. Secretion of Alzheimer’s disease Aβamyloid peptide by activated human platelets[J]. Lab Investigation,1998,78(4):461-469.
[3] Rosenberg R N, Baskin F, Fosmire J A, et al. Altered amyloid protein processing in platelets of patients with Alzheimer disease[J]. Arch Neurol, 1997,54(2):139-144.
[4] Padovani A, Borroni B, Colciaghi F, et al. Platelet amyloid precursor protein forms in AD: a peripheral diagnostic toll and a pharmacological target[J]. Mechanisms Aging Development, 2001,122:1997-2004.
[5] Bush A I, Martins R N, Rumble B, et al. The amyloid precursor protein of Alzheimer’s disease is released by human platelets[J]. J Biol Chem,1990,265:15977-15983.
[6] Diluca M, Colciaghi F, Pastorino L, et al. Platelets as a peripheral district where to study pahtogenetic mechanisms of Alzheimer disease: the ease of amyloidprecursor protein[J]. Eur J pharmacol, 2000,405:277-283.
[7] Zubenko G S, Kopp U, Seto T, et al. Platelet membrane fluidity individuals at risk for Alzheimer disease: a comparison of results from fluorescene spectroscopy and electron spinresponse spectroscopy[J]. Psychopharmacology, 1999,145:175-180.
[8] Borroni B, Volpi R, Martini G, et al.Peripheral blood abnormalities in Alzheimer Disease: evidence for early endothelialdysfunction[J]. Alzheimer Dis Ass Disordecs, 2002,16:150-155.
[9] Borroni B, Colciaghi F, Lenzi G L, et al. High cholesterol affects platelet APP processing in controls and in AD patients[J]. Neurobiol Aging, 2003,24:631-636.
[10] 薛寿儒,杨小旺。血小板β-淀粉样肽前体蛋白免疫强度及异构体比率对Alzheimer病的诊断价值[J].临床神经病学杂志, 2007,27(3):176-178.
[11] Pacifici L, Casella F, Maggiore C. Platelet rich plasma(PRP): potentialities and techniques of extraction[J]. Minerva Stomatol, 2002, 51:341-350.
[12] Akopyan K, Lindqvist A, Mullers E. Cell cycle dynamics of proteins and post-translational modifications using quantitative immunofluorescence[J]. Methods Mol Biol, 2016,1342:173-183.
A novel method of extracting platelet protein
Li Ning, Guan Yu, Qian Chunmei, Li Yongxin, Yang Xingcai, Zhang Xiaofeng
(Shanghai Municipal Hospital of Traditional Chinese Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200071, China)
Objective: To investigate a novel method of extracting high quality protein of platelet. Methods: comparing the novel method and traditional method of extracting protein by BCA quantification and Western blot. Results: The novel method of extracting protein is 1.86 g/L while the traditional method is 1.21 g/L. Western blot also shows that the result obtained from the novel method band is higher than that from the traditional method. The novel method gets a better result through the APP detection. Conclusion: The novel method can be more beneficial to the further research of the mechanism of Alzheimer’s disease.
protein extract; platelets; APP
10.16791/j.cnki.sjg.2016.03.015
2015- 09- 24修改日期:2015- 11- 03
上海市卫生局转化医学重点课题“基于APP的调心方治疗轻度老年痴呆的临床转化研究”(20114029)
李宁(1980—),男,河北安国,硕士,工程师,研究方向为发育生物学.
E-mail: andyleening@163.com
R331.1
B
1002-4956(2016)3- 0056- 02
