氟、砷染毒大鼠脑组织神经细胞损伤的实验研究
2016-09-05马小惠黄志超于亚鹭郑玉建王彦茹
张 杰, 马小惠, 吴 军, 马 艳, 黄志超, 于亚鹭, 郑玉建, 王彦茹
(新疆医科大学公共卫生学院, 乌鲁木齐 830011)
氟、砷染毒大鼠脑组织神经细胞损伤的实验研究
张杰, 马小惠, 吴军, 马艳, 黄志超, 于亚鹭, 郑玉建, 王彦茹
(新疆医科大学公共卫生学院, 乌鲁木齐830011)
目的探讨氟、砷对大鼠学习记忆能力及大脑组织神经细胞损伤的影响。方法90只初断乳清洁级SD大鼠随机分为9组,每组10只,雌雄各半,分别为对照(蒸馏水)组、低剂量砷(NaAsO20.75 mg/kg体质量)染毒组、高剂量砷(NaAsO21.5 mg/kg体质量)染毒组、低剂量氟(NaF 25 mg/kg体质量)染毒组、高剂量氟(NaF 50 mg/kg体质量)染毒组、低剂量砷(NaAsO20.75 mg/kg体质量)与低剂量氟(NaF 25 mg/kg体质量)联合染毒组、低剂量砷(NaAsO20.75 mg/kg体质量)与高剂量氟(NaF 50 mg/kg体质量)联合染毒组、高剂量砷(NaAsO21.5 mg/kg体质量)与低剂量氟(NaF 25 mg/kg体质量)联合染毒组及高剂量砷(NaAsO21.5 mg/kg体质量)与高剂量氟(NaF 50 mg/kg体质量)联合染毒组。自由饮水方式进行染毒,连续染毒6个月。采用Morris水迷宫实验评价大鼠学习记忆能力;透射电镜观察脑组织细胞超微结构改变;单细胞凝胶电泳法检测细胞DNA损伤情况。结果与对照组相比,高剂量砷、高剂量氟及高剂量氟砷联合染毒组大鼠逃避潜伏期明显延长;大脑皮质神经细胞出现皱缩、细胞核明显变形、核内染色质分布不均匀、胞浆内部分线粒体肿胀、内质网扩张等结构改变;并且脑组织神经细胞Olive尾矩值明显增高。结论氟、砷可透过血脑屏障在大鼠脑组织中蓄积,引起脑组织细胞形态学变化及神经细胞DNA损伤,这可能是氟、砷对动物学习记忆能力产生影响的重要原因。
亚砷酸钠; 氟化钠; 学习记忆能力; DNA损伤
地方性氟中毒、砷中毒是由于一定地区的环境中氟、砷元素过多,而致长期生活在该环境中的居民经饮水、食物和空气等途径摄入过量氟、砷所引起慢性全身性疾病。有调查资料显示,在我国山西、贵州以及新疆某些地区的地质环境中氟、砷元素同时异常增高,而导致长期生活在该地的人群发生地方性氟、砷联合中毒[1-2]。地方性氟、砷中毒对人体的危害是多方面的,可引起机体多系统、多器官的损伤。近年来随着研究的深入,人们发现中枢神经系统,特别是脑组织对氟、砷元素较为敏感。因此,氟、砷对学习记忆及脑损伤的相关研究日益受到研究者们的关注。本研究旨在探讨氟、砷染毒对大鼠学习记忆及脑组织细胞损伤的影响,为进一步阐明氟、砷对动物脑损伤的机制提供科学依据。
1 材料与方法
1.1仪器与试剂
1.1.1仪器Morris圆形水迷宫(上海药物研究所),JES-100SX电子显微镜(日本),氢化物发生-双道原子荧光光谱仪(北京吉天仪器设备有限公司),792型离子色谱仪(瑞士万通公司),IX71型倒置显微镜(OLYMPUS公司),PowerPacTMBasic型水平电泳槽(美国BIO-RAD公司)。
1.1.2试剂氟化钠(NaF,分析纯,北京化学试剂三厂),亚砷酸钠(NaAsO2,分析纯,美国Fluka公司),氟、砷标准溶液(中国标准物质研究中心),单细胞凝胶电泳DNA损伤检测试剂盒(南宁高新生物公司)。
1.2方法
1.2.1动物染毒选择健康初断乳的清洁级SD大鼠90只,雌雄各半,体质量为60~80 g,由新疆医科大学动物实验中心提供,动物合格证号为:SYXK(新)2003-0004。适应性饲养1 w后,将大鼠按体质量随机分为9组,每组10只,雌雄各半。分别为低剂量砷(NaAsO20.75 mg/kg体质量)染毒组、高剂量砷(NaAsO21.5 mg/kg体质量)染毒组、低剂量氟(NaF 25 mg/kg体质量)染毒组、高剂量氟(NaF 50 mg/kg体质量)染毒组、低剂量砷(NaAsO20.75 mg/kg体质量)与低剂量氟(NaF 25 mg/kg体质量)联合染毒组、低剂量砷(NaAsO20.75 mg/kg体质量)与高剂量氟(NaF 50 mg/kg体质量)联合染毒组、高剂量砷(NaAsO21.5 mg/kg体质量)与低剂量氟(NaF 25 mg/kg体质量)联合染毒组、高剂量砷(NaAsO21.5 mg/kg体质量)与高剂量氟(NaF 50 mg/kg体质量)联合染毒组、对照(蒸馏水)组。采用自由饮水方式对动物进行染毒,染毒时间为6个月。
1.2.2Morris圆形水迷宫试验采用定位导航实验对各实验组大鼠的空间学习记忆能力进行测试。动物6个月染毒结束后,将大鼠面向池壁放入水中,记录大鼠从入水到找到平台并站立于其上所需时间(逃避潜伏期),若大鼠在水池中游泳120 s内仍未成功找到平台,则引导大鼠至平台站立15 s,并记录逃避潜伏期为120 s,实验连续进行5 d。
1.2.3大鼠脑组织中氟、砷含量测定称取脑组织(0.2±0.05)g剪碎,加入10 mL硝酸和高氯酸(HNO3∶HClO4=4∶1)混合消化液,在通风柜内用控温电热板进行加热消解,当瓶底消化产物变为白色,冷却后加入5 mL超纯水,继续加热至水分蒸干,再用超纯水定容至5.0 mL。消化后的样品采用离子色谱法测定氟含量,采用氢化物原子荧光光度法检测砷含量。
1.2.4大脑皮质神经细胞电镜观察每组随机选取2只大鼠,经乙醚吸入麻醉后断头处死,在冰上快速分离大脑皮质,切取组织块放入4%戊二醛溶液中,4℃固定过夜,1% 四氧化锇后固定2 h。用环氧树脂进行包埋,用超薄切片机进行超薄切片,采用醋酸铀枸橼酸铅对切片染色。采用透射电子显微电镜观察各组大鼠脑皮质神经元超微结构。
1.2.5单细胞凝胶电泳法检测DNA损伤各实验组大鼠处死后,冰浴下取脑组织,0.125% 胰蛋白酶37℃消化10 min,1 500 r/min离心5 min,弃上清液,加入含10%小牛血清DMEM细胞培养基终止消化,用PBS洗2次,200目不锈钢筛过筛后用PBS重新悬浮细胞,再按照彗星实验试剂盒方法要求检测脑组织细胞DNA损伤情况。每组随机抽取4只大鼠,每只动物观察25个细胞,共观察100个细胞。采用CASP彗星分析软件进行分析,选择Olive尾矩作为DNA损伤的指标。

2 结果
2.1各组大鼠脑组织氟、砷含量与对照组比较,低剂量氟染毒组、高剂量氟染毒组、低剂量砷与低剂量氟联合染毒组、低剂量砷与高剂量氟联合染毒组、高剂量砷与低剂量氟联合染毒组、高剂量砷与高剂量氟联合染毒组大鼠脑组织中氟含量较高,其差异有统计学意义(F=23.482,P<0.05);与对照组比较,低剂量砷染毒组、高剂量砷染毒组、低剂量砷与低剂量氟联合染毒组、低剂量砷与高剂量氟联合染毒组、高剂量砷与低剂量氟联合染毒组、高剂量砷与高剂量氟联合染毒组大鼠脑组织中砷含量较高,其差异有统计学意义(F=72.216,P<0.05),见表1。
2.2Morris圆形水迷宫实验结果Morris圆形水迷宫实验结果显示,在连续5 d定位导航训实验间,各实验组大鼠随实验天数的增加,到达终点平台逃避潜伏期均逐渐缩短(表2)。采用重复测量资料方差分析综合评价5 d的测试结果,与对照组相比,高剂量砷染毒组、高剂量氟染毒组、高剂量砷与低剂量氟联合染毒组、低剂量砷与高剂量氟联合染毒组及高剂量砷与高剂量氟联合染毒组大鼠逃避潜伏期均延长,且差异有统计学意义(F=7.131,P<0.05)。交互分析结果显示,氟、砷联合染毒对大鼠逃避潜伏期的影响不呈现交互作用(P>0.05)。

表1 各组大鼠脑组织中氟、砷含量测定结果(±s, n=10)
注:与对照组相比,*P<0.05。

表2 Morris圆形水迷宫实验中大鼠逃避潜伏期比较(s, ±s, n=10)
注:与对照组相比,*P<0.05。
2.3大脑皮质神经细胞电镜观察结果透射电镜下可见对照组大鼠大脑皮质神经元形态完整,核膜清晰完整,细胞核内染色质分布正常,胞浆内质网、线粒体、高尔基体及核糖体形态正常(图1)。高剂量砷染毒组、高剂量氟染毒组、低剂量砷与高剂量氟联合染毒组、高剂量砷与低剂量氟联合染毒组、高剂量砷与高剂量氟联合染毒组可见大脑皮质神经元细胞皱缩,细胞核明显变形,核内染色质分布不均匀,核膜下可见大量异染色质聚集,胞浆内部分线粒体肿胀、呈空泡样改变及内质网扩张等结构改变,见图2、3、4。

图1对照组大鼠大脑皮质神经元(TEM,×6000)

图2高剂量砷染毒组大鼠皮质神经元(TEM,×6000)
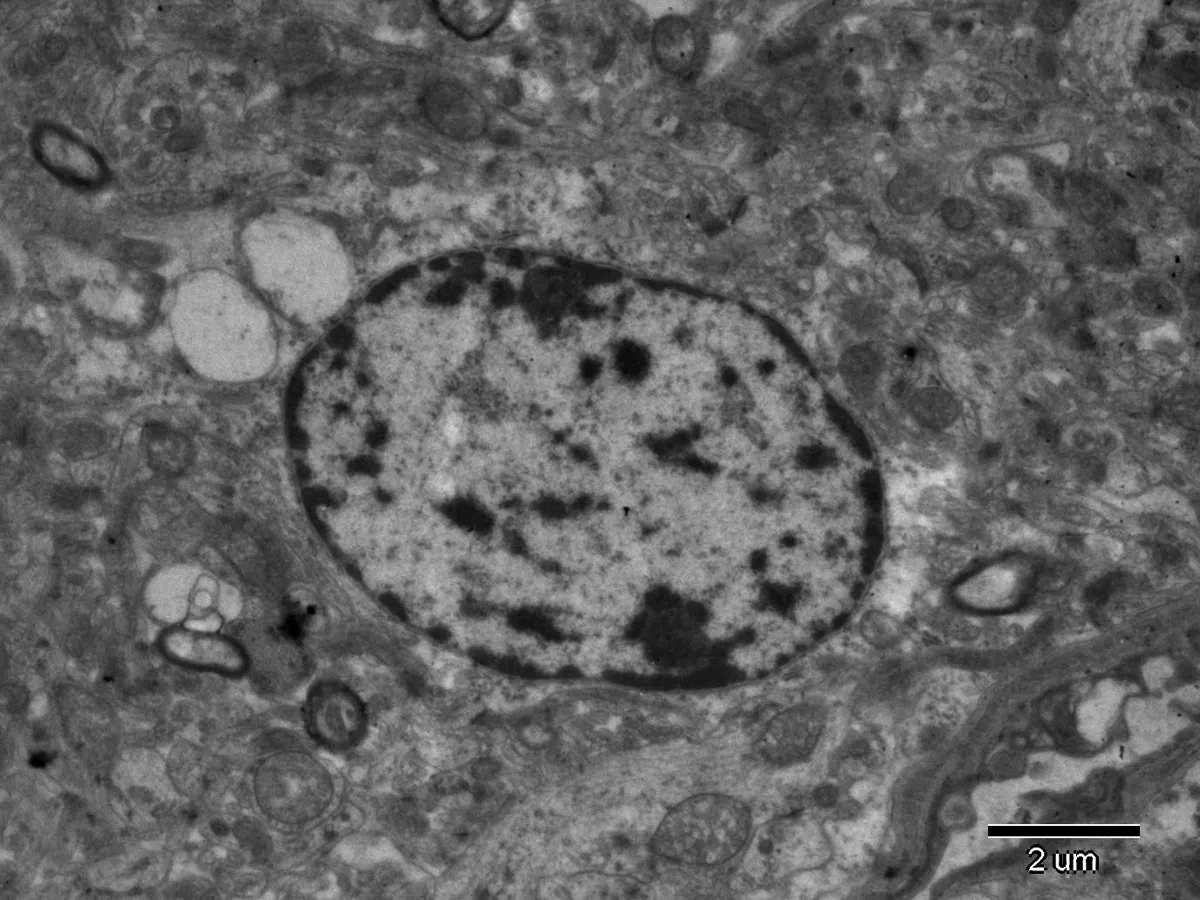
图3高剂量氟染毒组大鼠皮质神经元(TEM,×6000)
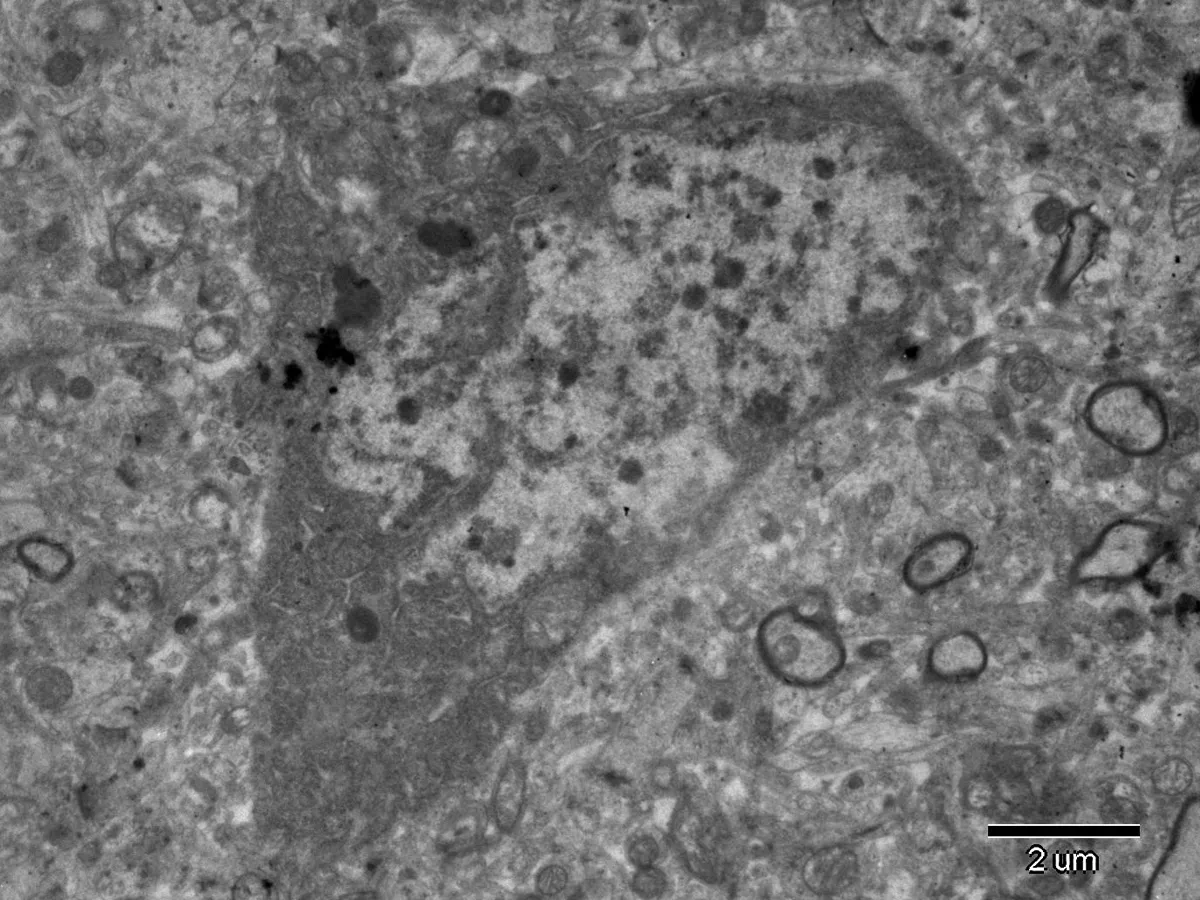
图4高剂量砷与高剂量氟联合染毒组大鼠皮质神经元(TEM,×6000)
2.4各实验组大鼠脑组织神经细胞DNA损伤检测结果单细胞凝胶电泳实验结果显示,与对照组对比,高剂量砷染毒组、高剂量氟染毒组、低剂量砷与高剂量氟联合组、高剂量砷与低剂量氟联合组、高剂量砷与高剂量氟联合组大鼠脑组织神经细胞Olive尾矩值明显增高,差异有统计学意义(F=29.375,P<0.05),见表3。交互分析结果显示,氟、砷联合染毒对大鼠脑组织神经细胞Olive尾矩值的影响未呈现交互作用(P>0.05)。


实验分组Olive尾矩值对照组0.85±0.21低剂量砷染毒组0.90±0.15高剂量砷染毒组1.31±0.32*低剂量氟染毒组1.01±0.30高剂量氟染毒组1.21±0.28*低剂量砷与低剂量氟联合染毒组0.94±0.23低剂量砷与高剂量氟联合染毒组1.31±0.22*高剂量砷与低剂量氟联合染毒组1.25±0.19*高剂量砷与高剂量氟联合染毒组1.42±0.31*
注:与对照组相比,*P<0.05。
3 讨论
作为中枢神经系统的大脑是人体重要的器官,对调控人体的生命活动至关重要。有研究表明,过多的氟进入机体可通过血脑屏障并在脑组织蓄积[3-4];而长期高砷暴露不仅可使砷在肝、肾、皮肤等器官蓄积,同样使脑组织中砷含量有所增加[5-6]。本实验结果与上述研究结果相一致,染毒6个月后各染毒组脑组织中的氟、砷含量均明显高于对照组。水迷宫实验结果显示,与对照组相比,高剂量砷染毒组、高剂量氟染毒组、低剂量砷与高剂量氟、高剂量砷与低剂量氟、高剂量砷与高剂量氟联合染毒组大鼠逃避潜伏期均有所延长。表明蓄积在脑组织中的氟、砷可对大脑正常生理功能产生负面影响。为进一步证明氟、砷对脑组织神经细胞的损伤作用,本研究利用透射电镜观察了氟、砷暴露后大脑皮质神经细胞超微结构的改变,结果显示各高剂量氟砷单独及联合染毒组大鼠大脑皮质神经元细胞出现皱缩,细胞核明显变形,核内染色质分布不均匀,核膜下可见大量异染色质聚集、胞浆内部分线粒体肿胀、呈空泡样改变、内质网扩张等结构改变。说明蓄积在脑组织中的氟、砷可破坏神经元的正常结构,而脑组织细胞形态学变化可能是氟、砷造成大脑生理功能受损的病理基础。单细胞凝胶电泳实验结果亦表明,与对照组相比,各高剂量氟、砷单独及联合染毒组大鼠Olive尾矩值明显升高,说明蓄积在脑组织中的氟、砷还可导致神经细胞DNA的损伤。此外,本研究未发现氟、砷对脑神经功能及神经细胞损伤存在联合毒效应。目前,氟砷造成脑损伤的机制尚不清楚,有必要更加深入和系统的进行研究。
[1]Huang YZ, Qian XC, Wang GQ, et a1. Syndrome of endemic arsenism and fluorosis.A clinical study[J]. Chin Med J(Engl), 1992, 105(7): 586-90.
[2]钱海雷. 氟、砷对骨的联合毒性[J]. 环境与职业医学, 2004, 21(3): 169-171.
[3]Reddy YP, Tiwari SK, Shaik AP, et al. Effect of sodium fluoride on neuroimmunological parameters, oxidative stress and antioxidative defenses[J]. Toxicol Mech Methods, 2014, 24(1): 31-6.
[4]Chauhan SS, Ojha S, Mahmood A. Effects of fluoride and ethanol administration on lipid peroxidation systems in rat brain[J]. Indian J Exp Biol, 2013, 51(3): 249-55.
[5]Luo J, Qiu Z, Chen J, et al. Maternal and early life arsenite exposure impairs neurodevelopment and increases the expression of PSA-NCAM in hippocampus of rat offspring[J]. Toxicology, 2013, 311(3): 99-106.
[6]Markowski VP, Currie D, Reeve EA, et al. Tissue-specific and dose-related accumulation of arsenic in mouse offspring following maternal consumption of arsenic-contaminated water[J]. Basic Clin Pharmacol Toxicol, 2011, 108(5): 326-32.
(本文编辑张巧莲)
A research on damage of the brain nerve cells of rat caused by fluoride-arsenic exposure
ZHANG Jie, MA Xiaohui, WU Jun, MA Yan, HUANG Zhichao, YU Yalu, ZHENG Yujian, WANG Yanru
(CollegeofPublicHealth,XinjiangMedicalUniversity,Urumqi830011,China)
ObjectiveTo observe the toxic effects of fluoride, arsenic and co-exposure on learning and Memory ability, ultrastructural changes and DNA damage in cerebral coaex in rats. MethodsA total of 90 SD rats were randomly divided into 9 groups by two-factors and three-levels factorial experiment design, 10 rats in each group, control group (distilled water), low dose NaAsO2(0.75 mg/kg) group, high dose NaAsO2(1.5 mg/kg) group, low dose NaF (25 mg/kg) group, high dose NaF (50 mg/kg) group, low dose NaAsO2(0.75 mg/kg) and low dose NaF (25 mg/kg) combined group, low dose NaAsO2(0.75 mg/kg) and high dose NaF (50 mg/kg) combined group, high dose NaAsO2(1.5 mg/kg) and low dose NaF (25 mg/kg) combined group, high dose NaAsO2(1.5 mg/kg) and high dose NaF (50 mg/kg) combined group. After 6 months of exposure, learning ability was tested by the Morris water maze; ultrastructural changes of neurons in the cerebral cortex were observed by transmission electron microscope; DNA damage was detected by single cell gel electrophoresis (SCGE). ResultsCompared with the control group, the escape latency periods of rats exposed to high-dose NaAsO2group, high-dose NaF group,high-dose NaAsO2and high-dose NaF combined group were significantly prolonged in water maze test; The ultrastructure of cortex neurons also had pathological changes; and the olive tail moment in those groups were remarkably elevated. ConclusionsFluoride and arsenic could pass blood-brain barrier and cumulate in cerebral cortex of rats. Chronic fluoride, arsenic and fluoride-arsenic combined exposure may affect learning and memory abilities through cell pathological changes and DNA damage of brain nerve cells.
Sodium arsenite; sodium fluoride; learning and Memory ability; DNA damage
国家自然科学基金(81260410); 教育部博士点基金(20126517110002)
张杰(1974-),男,高级实验师,博士,研究方向:微量元素与健康。
郑玉建,男,博士,教授,博士生导师,研究方向:环境与健康,E-mail:zhyujian6@hotmail.com。
R-33; R34
A
1009-5551(2016)06-0678-04
10.3969/j.issn.1009-5551.2016.06.004
2016-03-12]
