氨基酸底物α,β-不饱和苄基酯的制备
2016-09-03江慧
江慧
(宁夏职业技术学院,宁夏银川750021)
氨基酸底物α,β-不饱和苄基酯的制备
江慧
(宁夏职业技术学院,宁夏银川750021)
本文通过三种方法成功的制备了目标底物。方法一:叠氮苄基酯与苯甲醛的缩合;方法二:以溴乙酸乙酯为原料,经叠氮化反应、与醛的缩合、皂化、酯化即可得到目标底物2-叠氮-3-苯基丙烯酸苄酯;方法三:2-叠氮-3-苯基丙烯酸甲酯与苄醇的酯交换,其结构经1H NMR,13C NMR表征。
合成;叠氮化;缩合;α,β-不饱和苄基酯
氨基酸在生命体中扮演了极为重要的角色,特别是手性α-氨基酸,它是一切生命之源[1]。因为它是蛋白质组成的基本单元,参与生理活动和各种代谢。习惯上将氨基酸分为两大类:蛋白氨基酸和非蛋白氨基酸,前者是指20种编码蛋白质的氨基酸。1983年已发现有500多种的非蛋白氨基酸,1985年,非蛋白氨基酸的数量已达到700多种。它们都广泛应用于学术研究领域与药物、生物科技以及化学产业中[2,3]。2-叠氮取代的α,β-不饱和苄基酯[4]是制备氨基酸很好的底物,故对关于自然界中广泛存在的含氮结构单元构建的研究具有重要的意义[5]。
本文通过三种方法成功的合成了2-叠氮取代的α,β-不饱和苄基酯,其结构经1H NMR,13C NMR表征。
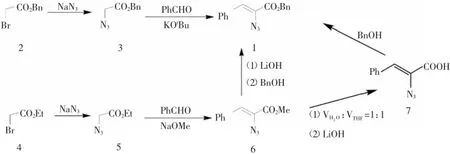
图1 2-叠氮-3-苯基丙烯酸苄酯的合成路线
1 实验部分
1.1仪器与试剂
Bruker 400 MHz核磁共振仪(CDCl3为溶剂,TMS为内标);IKA RCT基本型磁力搅拌器;Buchi R20旋转蒸发仪;ZF-5紫外分析仪。青岛海洋薄层层析板,青岛海洋硅胶;主要试剂有叠氮钠,溴乙酸乙酯,溴乙酸苄酯,苯甲醇,甲醇,苯甲醛;其他试剂均为分析纯。溶剂在实验前均以常规方法除水。
1.2实验方法
2-叠氮-3-苯基丙烯酸苄酯的合成路线(见图1)。
1.2.12-叠氮乙酸苄酯3的制备在氮气保护下,将溴乙酸苄酯(458mg,2mmol)和叠氮钠(195 mg,3mmol)溶于二氯甲烷(10 mL)中,室温下搅拌18 h,然后用蒸馏水淬灭反应,冷却到室温后。用45.0mL无水乙醚萃取三次,有机相合并后依次用蒸馏水洗,饱和食盐水洗,无水硫酸钠干燥,过滤除去干燥剂,用旋转蒸发仪蒸除有机溶剂,浓缩后,硅胶柱层析以V(石油醚):V(乙酸乙酯)=10:1为洗脱剂对溴乙酸苄酯叠氮化后的混合物进行分离,除去未反应的原料,得淡红色液体油状化合物3(302mg,产率79%),1H NMR(CDCl3,400MHz)δ:7.35~7.40(s,5 H),5.24(s,2 H),3.91(s,1 H)。
1.2.22-叠氮乙酸乙酯5的制备在氮气保护下,将溴乙酸乙酯(501 mg,3 mmol)和叠氮钠(239 mg,3.69 mmol)溶于15 m L二氯甲烷中,加热回流10 h,冷却到室温后,然后用蒸馏水淬灭反应,用60.0mL无水乙醚萃取三次,有机相合并后依次用蒸馏水洗,饱和食盐水洗,无水硫酸钠干燥,过滤除去干燥剂,用旋转蒸发仪蒸除有机溶剂,减压浓缩后得无色液体化合物5(371 mg,产率96%),1H NMR(CDCl3,400 MHz)δ:4.20(dd,2 H,J=1.6 Hz and J=1.6 Hz),3.80(s,2 H),1.25(t,J=1.6 Hz,3 H)。
1.2.32-叠氮-3-苯基丙烯酸甲酯6的制备氮气保护下,将甲醇钠(243mg,4.5mmol)溶于甲醇(15mL),冰水浴冷却,缓慢滴加化合物5(1.16 g,9 mmol)和苯甲醛(318 mg,3 mmol),0℃反应24 h后,用蒸馏水淬灭反应,用60.0mL乙酸乙酯萃取三次,有机相合并后依次用蒸馏水洗,饱和食盐水洗,无水硫酸钠干燥,过滤除去干燥剂,用旋转蒸发仪蒸除有机溶剂,减压浓缩后,硅胶柱层析以V(石油醚):V(乙酸乙酯)=15:1为洗脱剂对2-叠氮乙酸乙酯与苯甲醛缩合后的混合物进行分离,除去未反应的原料,得淡黄色黏稠液体6(438 mg,产率72%)。1H NMR(CDCl3,400 MHz)δ:7.81(m,2 H),7.38(m,3 H),6.92(s,1 H),3.91(s,3 H);13C NMR(CDCl3,100MHz)δ:163.0,132.1,129.6(2),128.4,127.4(2),124.6,124.3,51.8。
1.2.42-叠氮-3-苯基丙烯酸7的合成化合物6(203 mg,1 mmol)溶于溶剂(V水:VTHF=1:1)5.0 mL中,加入LiOH(420 mg,10 mmol),室温下反应12 h后,用3mol/L的盐酸调节至pH为3~4,用60.0 mL无水乙醚萃取三次,有机相合并后依次用蒸馏水洗,饱和食盐水洗,无水硫酸钠干燥,过滤除去干燥剂,用旋转蒸发仪蒸除有机溶剂,减压浓缩后得淡黄色片状固体7(170mg,产率90%)。1H NMRδ:7.84~7.90(m,2 H),7.36~7.44(m,3 H),7.11(s,1 H)。
1.2.52-叠氮-3-苯基丙烯酸苄酯1的制备
方法一:氮气保护下,将叔丁醇钾(336mg,3mmol)溶于苄醇(5mL),冰水浴冷却,缓慢滴加化合物3(1.15 g,6 mmol)和苯甲醛(212 mg,2 mmol),0℃反应16 h后,用蒸馏水淬灭反应,用30.0 mL二氯甲烷萃取三次,有机相合并后依次用蒸馏水洗,饱和食盐水洗,无水硫酸钠干燥,过滤除去干燥剂,用旋转蒸发仪蒸除有机溶剂,减压浓缩后,硅胶柱层析以V(石油醚):V(乙酸乙酯)=10:1为洗脱剂对2-叠氮乙酸苄酯与苯甲醛缩合后的混合物进行分离,得淡黄色固体1(480mg,产率86%)。2-叠氮-3-苯基丙烯酸苄酯1的波谱学数据如下:1H NMR(CDCl3,400MHz)δ:7.82(d,2 H,J=1.6 Hz),7.40(m,8 H),6.96(s,1 H),5.35(s,2 H);13CNMR(100 MHz,CDCl3)δ:163.4,135.4,133.3,130.8(2),129.6,128.9(2),128.8,128.7(2),128.6(2),125.8,125.4,68.0。
方法二:将化合物7(378mg,2 mmol)溶于干燥的DCM(10mL),加入苄醇(432mg,4mmol),DCC(453 mg,2.2 mmol),DMAP(12 mg,0.1 mmol),氮气保护下0℃反应20 h后,用蒸馏水淬灭反应,用30.0 mL二氯甲烷萃取三次,有机相合并后依次用蒸馏水洗,饱和食盐水洗,无水硫酸钠干燥,过滤出去干燥剂,用旋转蒸发仪蒸除有机溶剂,减压浓缩后,硅胶柱层析以V(石油醚):V(乙酸乙酯)=20:1为洗脱剂对2-叠氮乙酸苄酯与苯甲醛缩合后的混合物进行分离,(V石油醚:V乙酸乙酯=15:1)得淡黄色固体1(485mg,产率88%)。2-叠氮-3-苯基丙烯酸苄酯1的波谱学数据如下:1H NMR(400 MHz,CDCl3)δ:7.82(d,2 H,J=1.6 Hz),7.40(m,8 H),6.96(s,1 H),5.35(s,2 H);13C NMR(100 MHz,CDCl3)δ:163.4,135.4,133.3,130.8(2),129.6,128.9(2),128.8,128.7(2),128.6(2),125.8,125.4,68.0。
方法三:氮气保护下,将化合物6(406mg,2 mmol)溶于干燥的二氯甲烷(10 mL),加入苄醇(432 mg,4 mmol),LiOH(432mg,4mmol),DCC(453mg,2.2mmol),DMAP(12 mg,0.1 mmol),0℃反应20 h后,用蒸馏水淬灭反应,用30.0 mL二氯甲烷萃取三次,有机相合并后依次用蒸馏水洗,饱和食盐水洗,无水硫酸钠干燥,过滤除去干燥剂,用旋转蒸发仪蒸除有机溶剂,减压浓缩后,硅胶柱层析以V(石油醚):V(乙酸乙酯)=20:1为洗脱剂对2-叠氮-3-苯基丙烯酸甲酯与苄醇酯交换后的产物进行分离,得淡黄色固体1(452mg,产率82%)。2-叠氮-3-苯基丙烯酸苄酯1的波谱学数据如下:1H NMR(CDCl3,400 MHz)δ:7.82(d,2 H,J=1.6 Hz),7.40(m,8 H),6.96(s,1 H),5.35(s,2 H);13C NMR(100 MHz,CDCl3)δ:163.4,135.4,133.3,130.8(2),129.6,128.9(2),128.8,128.7(2),128.6(2),125.8,125.4,68.0。
2 结果与讨论
对α,β-不饱和苄基酯即2-叠氮-3-苯基丙烯酸苄酯化合物1的制备进行了大量的实验研究,筛选了包括叔丁醇钾、甲醇钠等各种碱,尝试了不同的反应溶剂,比如甲醇、四氢呋喃、甲苯等常规溶剂,结果都无法得到想要的目标底物。分析原因如下:苄基酯对碱的稳定性较低,要远远低于普通烷基酯对碱的稳定性,常常一个较弱的碱就可以将苄基脱除。而在制备α,β-不饱和苄基酯这个目标底物的过程中,需要用到较强的碱来辅助醛与叠氮苄基酯的缩合,在此过程中,会发生苄基酯的解离,这是不可避免的。为了回避苄基酯的解离这一问题,用苯甲醇替代普通溶剂来降低解离倾向,以碱叔丁醇钾这种非亲核性的碱来辅助该缩合,最终成功得到目标底物1。大家会问叔丁醇钾比较贵,为什么不选用相对廉价的甲醇钠和乙醇钠来辅助缩合呢,是因为如果使用甲醇钠、乙醇钠来辅助缩合将生成部分酯交换产物,从而降低产率。以市面上可以直接购买的溴乙酸苄酯为原料出发,通过两步化学转化:第一步是叠氮化,第二步缩合,就可以得到所需要的目标底物α,β-不饱和苄基酯,制备目标底物的效率较高。但是由于通过多次柱层析纯化该目标底物的氢谱中在化学位移4.5左右有个杂质峰,对于下一步反应的研究产生干扰,所以采用第二种合成路线,可以通过更为廉价的溴乙酸乙酯叠氮化反应制备叠氮乙酸乙酯,然后与醛缩合,再皂化,酯化也以较高的收率成功的得到了纯净的目标底物α,β-不饱和苄基酯。
[1]Ma,J.-A.Angew.Chem.Int[J].Ed,2003,(42):4290-4299.
[2]Tang,Z.,Yang,Z.-H.,Chen X.-H.J.Am.Chem[J].Soc,2005,(127):9285-9289.
[3]Zheng,Z,Peikins,B.L.,Ni,B.J.Am[J].ChemSoc,2010,132:50-51.
[4]Benjamin J.Stokes,Huijun Dong,Brooke E,et al.Leslie Intramolecular C-H Amination Reactions:Exploitation of the Rh2(II)-Catalyzed Decomposition of Azido acrylates[J].J. Am.Chem.Soc,2007,(129):7500-7501.
[5]顾培明,王宝娟,李学强.N-乙酰苯甘氨酸的制备[J].应用化工,2013,42(12):2201-2203.
Preparation of am ino acid substrateα,β-unsaturated benzyl ester
JIANG Hui
(Ningxia Polytechnic,Yinchuan Ningxia 750021,China)
This article aimed at the synthesis of 2-azido-3-phenyl-acrylic acid benzyl ester through threemethods.The preparation of 1 was achieved from condensation with azido benzyl este and benzaldehyde.The secondmethod of obtaining the target substrate 1 is via azide reaction,condensation,saponification,esterification,with benzaldehyde an aldehyde and bromine ethyl acetate.The third method is the transesterification of 2-azide-3-phenyl acrylic acidmethyl ester and benzyl alcohol.The structures of all new compoundswere confirmed by1H NMR and13CNMR.
synthesis;azide;condensation;2-azido-3-phenyl-acrylic acid benzyl ester
O621.1
A
1673-5285(2016)07-0124-03
10.3969/j.issn.1673-5285.2016.07.031
2016-05-23
江慧,女(1985-),硕士研究生,宁夏职业技术学院助教,邮箱:jh2009abc@163.com。
