葡萄糖氧化酶在修饰玻碳电极上的直接电化学*
2016-09-03耿方勇张钰帅杨晓璐肖宝林
耿方勇,李 迪,张钰帅,杨晓璐,肖宝林,洪 军
(河南大学生命科学学院,河南 开封 475000)
葡萄糖氧化酶在修饰玻碳电极上的直接电化学*
耿方勇,李迪,张钰帅,杨晓璐,肖宝林,洪军
(河南大学生命科学学院,河南开封475000)
将葡萄糖氧化酶(Glucose oxidase, GOD)固定在由多壁碳纳米管(MWCNTS)和石墨烯(Graphene)构成的纳米复合材料修饰的玻碳电极上,最外层用壳聚糖(Chitosan)进行覆盖,利用循环伏安法(Cyclic Voltammetry, CV)来测量葡萄糖氧化酶在修饰电极上的电化学和电催化反应,测得电子传递速率常数ks为0.87 s-1,电活性物质表面密度Г为1.54×10-10mol/cm-2,动力学表观米氏常数Km为1.32×103μmol/L,线性检测范围为:40~1000 μmol/L,修饰电极有较好的稳定性,而且修饰电极在检测底物时有较好的抗干扰能力,因此,该体系修饰的电极有希望构建第三代葡萄糖生物传感器。
石墨烯;多壁碳纳米管;直接电化学;稳定性;抗干扰
葡萄糖氧化酶由于具有催化专一性、高活性、催化高效性、对人体无毒副作用等优点被广泛地应用于许多方面,如在食品工业,可用于去葡萄糖、脱氢、杀菌;在饲料添加方面,是一种新型的酶饲料添加剂,能够改善动物肠道环境[1]。同时,在生物方面,用来构建生物传感器是最具有商业价值的。
增加氧化还原蛋白质的直接电子转速率是开发生物传感器、生物燃料电池的先决条件。然而,蛋白质活性中心与电极表面进行直接电子通信是困难的, 正如葡萄糖氧化酶,其起到传递电子作用的活性中心FAD是深深嵌入蛋白质结构的内部[2-3]。因此通过各种方法使两者之间能够进行电子通信是首要问题。
随着纳米技术的发展,纳米材料的应用已渗透到传感器的设计中,石墨烯具有极大的比表面积和良好的电子传递性能,并有很好的生物相容性,在酶的直接电化学、生物小分子的电化学检测中都具有极其优异的性能[4]。多壁碳纳米管具有较大比表面积、化学稳定性好、生物兼容性好、具有良好的电子传递能力,被广泛的应用于生物传感器领域中[5]。
由于石墨烯为单层的片状结构,多壁碳纳米管为管状结构,综合二者优点制作复合材料,将管状的多壁碳纳米管复合在单层片状结构的石墨烯上,从而增大酶的附着量,并提高酶的活性中心与电极之间的电子传递速率。
本文将从葡萄糖氧化酶固定于修饰有纳米高分子复合材料的玻碳电极表面,通过循环伏安测试法研究酶在电极上的电化学行为及电化学特性,实现了直接电化学研究。
1 实 验
1.1仪器
KQ-100B型超声波清洗器,昆山市超声仪器有限公司; CHI650C电化学分析仪,上海辰华仪器公司; PHS-3C型精密酸度计,上海大普仪器公司;CP214型电子天平,河南中良科学仪器有限公司。
1.2试剂
葡萄糖氧化酶、多壁碳纳米管、石墨烯、壳聚糖、磷酸氢二钠、磷酸二氢钠、葡萄糖(Glucose, Glu),均购于Sigma公司;其它试剂均为分析纯,所有溶液均用去离子双蒸水配置。
2 结果与讨论
2.1不同修饰材料循环伏安曲线对比
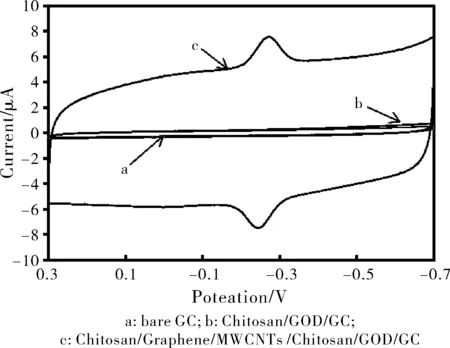
图1 不同修饰材料循环伏安曲线对比图
在50 mmol/L PBS溶液缓冲液(pH 7)中,采用CV法对修饰电极的电化学行为进行研究,扫描速率为0.05 V/s。图1显示了不同修饰电极的循环伏安图:曲线a、b均为无明显氧化还原峰,而曲线c在-0.1~ -0.3之间具有一对明显的氧化还原峰,实验结果表明GOD在纳米复合材料修饰的玻碳电极上具有电化学活性,是一准可逆的电子传递氧化还原反应过程[6-7]。
2.2循环伏安法测量GOD电化学反应机制
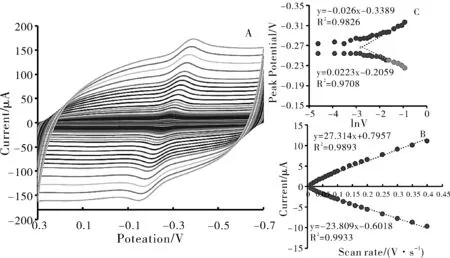
图2 不同扫描速度CV曲线图(A),不同扫描速度GOD峰电流值与扫描速度图(B)和GOD峰值电压与扫描速度对数图(C)
图2(A)显示了在50 mmol/L PBS溶液缓冲液(pH 7)中,不同扫描速率下修饰电极CV曲线图。
图2(B)显示在扫描速率为0.01~0.4 V/s范围内,阴极峰电流和阳极峰电流二者与电压成线性关系,这说明了GOD与电极之间的电子传递过程是固化机制[8]。
峰值电压与扫描速度自然对数的线性关系如图2(C)所示,修饰电极在扫描速率0.2~0.4 V/s的范围内,阴极峰电压变化(Epc)与lnv成线性关系为。
根据Laviron公式:
(1)
式中:α——阴离子迁移系数
n——电子数
R——气体常数,R=8.314 J·mol-1·K-1
F——法拉第常数,F=96493 C/mol
T——温度,T=298 K
根据公式(1)计算得α·n=1.15 (0.3<α<0.7),n=2, 说明了GOD与电极之间的氧化还原反应是双电子传递过程。
(2)
根据公式(2)可以计算出电子迁移速率常数(ks)[9-10],由图C中两条趋势线交点可以计算出lnv=-2.754;ks=0.87 s-1。
再根据公式
(3)
式中:A——电极表面积
Γ——电活性物质表面密度
得出表面密度Γ为1.54×10-10mol/cm2,和PDB单层理论值1.7×10-10mol/cm2十分接近,因此酶在修饰电极上是单层分布的,这主要是由于纳米复合材料具有较大的比表面积,能够使酶稳定的附着在其表面。
2.3对葡萄糖的检测
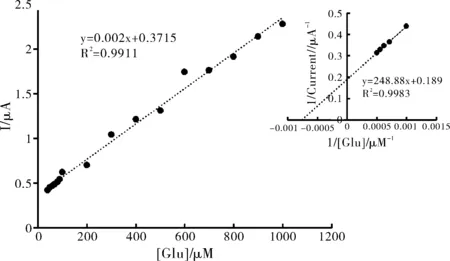
图3 峰值电流随底物浓度变化图(插图为GOD ineweaver-Burk图)
图3为全修饰电极在Glu存在时峰值电流与Glu浓度关系图,从图3中可以得出修饰体系的线性检测范围为40~1000 μmol/L。
图3中插图表示的是对于固定化的GOD,催化电流与底物浓度之间的关系遵循米氏动力学机制:
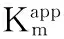
3 Chi/MWCNTs/Graphene/GOD/GC电极抗干扰实验
对全修饰的电极进行抗干扰实验,如图4所示,先后加入葡萄糖溶液,电流均有较明显的下降,待电流稳定后加入维生素B1,电流并未有所改变,再加入葡萄糖溶液后,电流又有明显下降,接着加入抗坏血酸和尿酸后均未产生电流变化,最后再次加入葡萄糖溶液,电流再次降低,因此,构建的电极体系具有很高的选择性,抗干扰能力强。
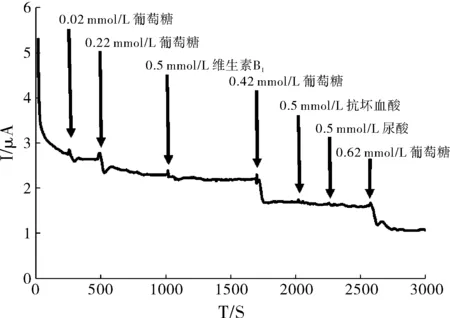
图4 电流-时间曲线
此外研究修饰电极的稳定性,将电极在反应池中浸泡0.5 h后采用CV法进行多次扫描,曲线几乎重合;将初始电极放置一天一夜后测量其信号强度,达到初始信号强度的96.7%,因此本实验构建的全修饰电极有较好的稳定性。
4 结 论
葡萄糖氧化酶在石墨烯-多壁碳纳米管复合材料修饰的电极上可实现直接电子转移,进行直接电化学,修饰电极对葡萄糖具有生物催化活性,检测范围为40~1000 μmol/L,构建的体系具有较高的选择性,抗干扰能力强,稳定性好,因此该体系有希望用于检测葡萄糖浓度,构建第三代生物传感器。
[1]刘超,袁建国,王元秀,等.葡萄糖氧化酶的研究进展[J].食品与药品,2010, 12(7):285-289.
[2]陈真诚,李凌云,邓振生.一种葡萄糖氧化酶安培传感器研究[J].传感技术报,2007,20(4):743-746.
[3]SANDIP B B, BULE M V, SINGHAL R S, et al. Glucose oxidase-An overview [J]. Biotechnology Advances, 2009, 27: 489-501.
[4]TAPAS K, BOSE S, KIM N H, et al. Recent advances in graphene-based biosensors [J]. Biosensors and Bioelectronics, 2011, 26: 4637-4648.
[5]RAHIMI P, POUR H A R, GANJALI M R, et al. Ionic-liquid/NH2-MWCNTs as a highly sensitive nano-composite for catalase direct electrochemistry [J]. Biosensors and Bioelectronics, 2011, 25: 1301-1306.
[6]FU C L, YANG W S, CHEN X, et al. Direct electrochemistry of glucose oxidase on a graphite nanosheet-Nafion composite film modified electrode [J]. Electrochemistry Communications, 2009, 11: 997-1000.
[7]KYUHWAN H, HAN S W, KWON Y C, et al. Direct electrochemistry of glucose oxidase immobilized on carbon nanotube for improving glucose sensing [J]. International journal of hydrogen energy, 2015, 40: 2199-2206.
[8]QIU C C, WANG X, LIU X Y, et al. Direct electrochemistry of glucose oxidase immobilized on nanostructured gold thin films and its application to bioelectrochemical glucose sensor [J]. Electrochimica Acta, 2012, 67: 140-146.
[9]LIANG B, GUO X S, FANG L, et al. Study of direct electron transfer and enzyme activity of glucose oxidase on grapheme surface [J]. Electrochemistry Communications, 2015, 50: 1-5.
[10]LIU Q, LU X B, LI J. Direct electrochemistry of glucose oxidase and electrochemical biosensor [J]. Bioelectron, 2007, 24: 1286-1291.
[11]GU T T, ZHANG Y, DENG F. Direct electrochemistry of glucose oxidase and biosensing for glucose based on DNA/chitosan film [J]. Anal. Chim, 2011, 23: S66-S69.
[12]DAI Z H, SHAO G J, HONG J M. Immobilization and direct electrochemistry of glucose oxidase on a tetragonal pyramid-shaped porous ZnO nanostructure for a glucose biosensor [J]. Biosensor. Bioelectron, 2008, 24: 1286-1291.
[13]FU C L, YANG W S, CHEN X. Direct electrochemistry of glucose oxidase on a graphite nanosheet-Nafion composite film modified electrod [J]. Electrochem. Commun, 2009, 11(5): 997-1000.
Direct Electrochemistry of Glucose Oxidase on A Nano Complex Modified Glassy Carbon Electrode*
GENGFang-yong,LIDi,ZHANGYu-shuai,YANGXiao-lu,XIAOBao-lin,HONGJun
(School of Life Sciences, Henan University, Henan Kaifeng 475000, China)
graphene; multi-walled carbon nanotubes; direct electrochemistry; stability; anti-interference
河南大学特聘教授科研启动基金(No:5443D0810)。
耿方勇(1994-),男,河南大学生命科学学院研究生。
洪军,博士,校特聘教授,硕士生导师。
O646
A
1001-9677(2016)07-0122-03
