活性炭负载丁二酸用于捕获烟气中的元素汞
2016-09-03侯启雄黄张根胡拖平
侯启雄,黄张根,胡拖平,崔 燕
(1 中北大学,山西 太原 030051;2 中国科学院山西煤炭化学研究所,山西 太原 030001)
活性炭负载丁二酸用于捕获烟气中的元素汞
侯启雄1,黄张根2,胡拖平1,崔燕2
(1 中北大学,山西太原030051;2 中国科学院山西煤炭化学研究所,山西太原030001)
为提高活性炭(AC)对燃煤烟气中元素汞(Hg0) 的捕获能力设计了一种新颖高效的AC改性方法:丁二酸 (SA) 浸渍法。在实验室模拟烟气条件下对处理后的活性炭 (SA/AC) 进行了汞捕获活性评价,并考察了温度、制备条件、空速对其活性的影响,找出了最佳的制备条件和汞捕获实验条件。结果表明SA/AC汞捕获能力远高于初始AC,110 ℃下5% SA/AC的活性最高。
活性炭;丁二酸;元素汞;烟气
近些年,汞排放带来的环境问题越来越引起人们的关注[1-2],汞是一种具有易挥发性、生物累积性、以及剧烈毒性的元素[3-4]。燃煤汞排放是目前最主要的人为汞排放之一[5]。研究人员估计人为汞排放将呈增加趋势[2, 6]。燃煤烟气汞的形态主要有元素汞 (Hg0)、氧化态汞 (Hg2+)、附着在颗粒上的汞 (Hgp)[7],Hg0大约占总汞量的20%~50%[8],其中Hg0是最难脱除的[9]。使用吸附剂吸附法是对烟气Hg0一种有效脱除工艺。
活性炭 (AC) 作为一种可再生的吸附剂具有较好的Hg0捕获能力[10-11]。但由于其投资和运行费用高昂,难以被全面推广使用。通过对AC改性处理提高其汞捕获效率,降低AC的用量是目前改善AC脱汞工艺的首选方案。大量的对AC改性处理研究发现,引入含氧官能团[12],负载金属氧化物[13-14]、卤素[15]、硫[16]等活性组分均能显著提高AC的汞捕获能力。
在AC表面引入硫、卤素、金属氧化物等改性方法,存在成本较高或后续污染等问题。如果能够找到一种操作简易、低成本无污染、高活性的改性工艺,将具有非常高的应用价值。Li等认为增加活性炭表面的含氧官能团能够显著提高AC的Hg0捕获能力[17],其中羧基、酸酐、内酯基等是AC表面吸附并催化氧化Hg0的活性位点。作者推测,羧酸类化合物的羧基官能团直接负载到AC表面可能同样具有催化氧化Hg0的活性。丁二酸具有熔点高、腐蚀性弱、热稳定性好、价格适中易于存储运输等优点。基于此,本文使用丁二酸 (SA)等体积浸渍法对AC进行改性处理,在实验室固定床模拟烟气条件下,考察了温度、浸渍量、空速等因素对SA/AC汞捕获活性的影响规律。
1 实 验
1.1样品制备
本文使用的AC为山西新华活性炭有限公司生产的商业活性炭,将AC破碎筛分至40~60目 (0.45~0.30 mm),在室温下用去离子水反复震荡洗净后取出放入烘箱在110 ℃下烘干备用。
丁二酸处理试样的制备:采用等体积浸渍法将不同SA浸渍量的AC在110 ℃下℃烘干12 h。根据AC的最大溶液吸收体积和不同的浸渍量确定配制不同浓度的丁二酸浸渍溶液。每100 g AC浸渍X g SA的试样标记为X%SA/AC,根据实验需要X取值0,1,5和10, 0% SA/AC表示未处理的AC。
1.2实验装置
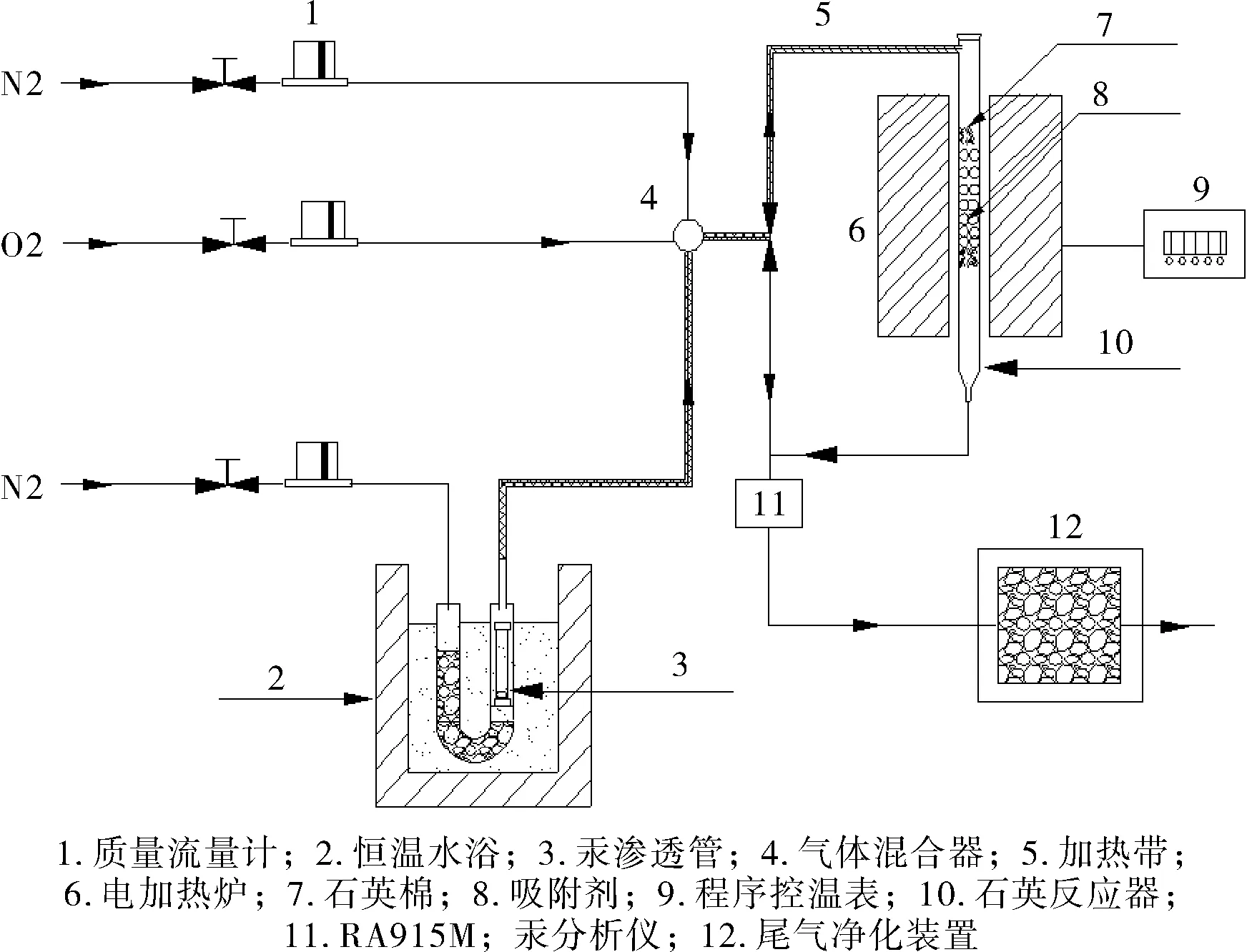
图1 实验装置示意图
吸附剂的汞脱除活性评价装置如图1 所示:由模拟烟气、固定床反应装置和气体检测系统组成。模拟烟气汞蒸汽 (Hg0) 气源:将汞渗透管 (美国VICI Metronics公司) 放置在有恒温水浴准确控温的U型石英管内的一侧,通入一定量的氮气作为携带气,通过调节恒温水浴的温度使Hg0的浓度保持在(400±10) μg·Nm3。Hg0的浓度测定采用俄罗斯LumexRA-915М汞分析仪,该仪器的检测使用基于高频调制偏振光的塞曼效应原子吸收光谱法(ZAAS-HFM)进行测定。通过质量流量计调整各气体流速使总气体流速为400 mL·min-1、氧气浓度为6.5%,氮气作为平衡气。称取1.0 g的SA/AC装入内径为8 mm 的石英管内,此时装填高度约40 mm,对应体积空速为12500 h-1,控制电加热炉使反应床层温度保持在110 ℃。在没有特别指明的情况下,吸附剂的汞捕获效率评价实验均在此条件下进行。样品的汞捕获效率η用公式(1)来表示,样品的累计汞吸附量Q(μg)用公式(2)来表示,单位质量样品的汞吸附量q(μg·g-1)用公式(3)来表示。
(1)
(2)
(3)
式中:Coutlet和Cinlet——实验条件下反应器出口和入口Hg0的浓度,μg·m-3
F——气体流速,m3·min-1
W——吸附剂的质量,g
t——时间,min
尾气处理:采用过量的AC对实验尾气进行深度脱除。
2 结果与讨论
2.1汞捕获活性评价
图2为0%SA/AC和5%SA/AC的捕获率与反应时间的关系图,从图中可以看出0% SA/AC的汞捕获能力非常有限,20 min 时捕获率已经降到了10%以下,300 min的时候汞捕获率接近于零。和0%SA/AC相比,5%SA/AC的汞捕获能力提高非常显著。在100 min的时候仍保持100%的汞捕获率。为了
考察5%SA/AC的最大汞吸附量进行了长时间的实验,可以看出汞的捕获率随反应时间逐渐下降,到1000 min的时候,捕获率大约下降到90%,随着时间的继续延长,汞捕率缓慢下降,到15000 min的时候仍有25%的捕获率,此时吸附剂的汞吸附量达到890 μg·g-1。而0%SA/AC的汞吸附量只有20 μg·g-1。为了进一步了解SA/AC的汞捕获性能,考察了浸渍量、空速、温度对其汞捕获活性的影响。
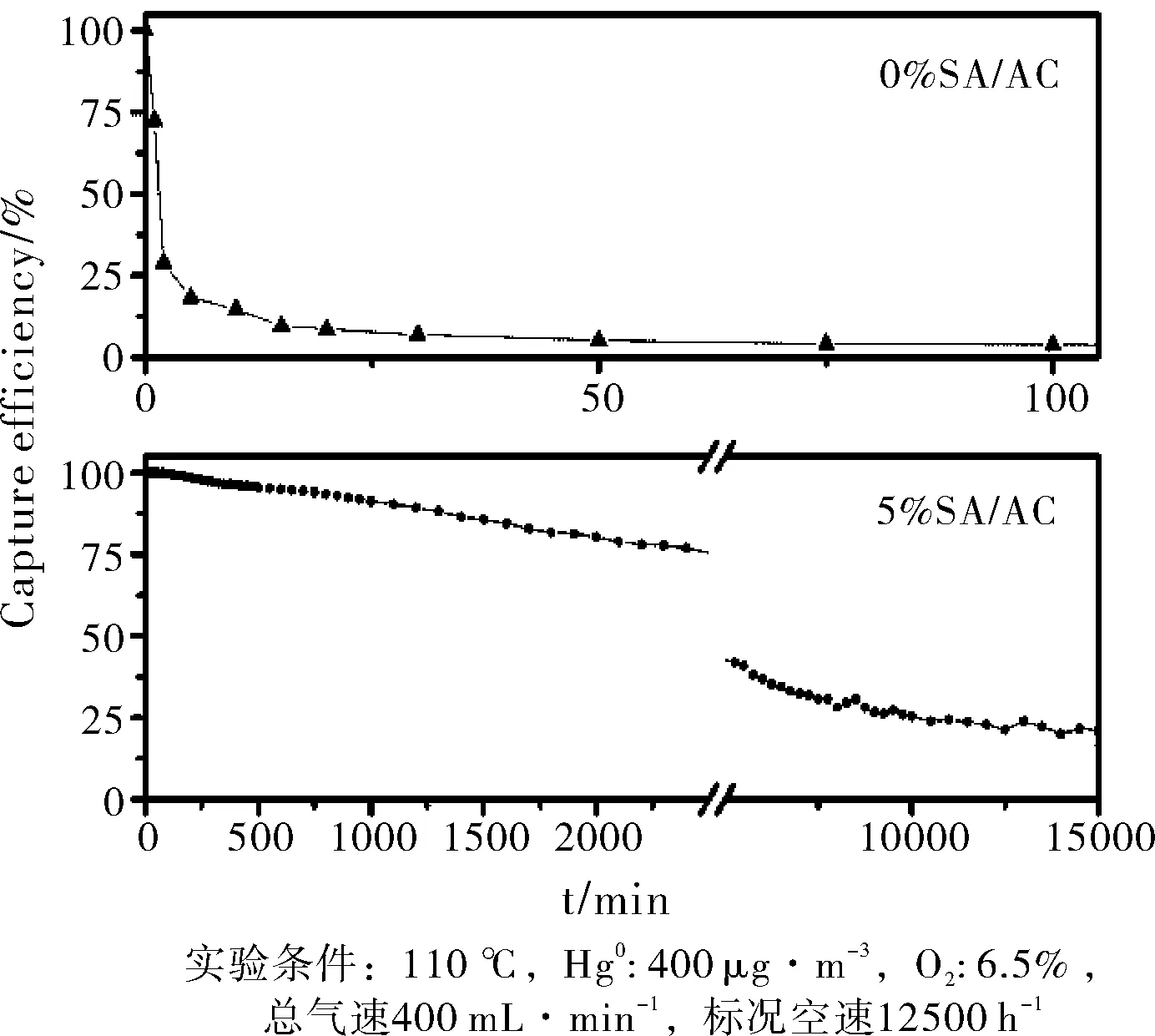
图2 SA/AC的汞捕获率随反应时间变化关系图
2.2不同浸渍量的实验
不同浸渍量的SA/AC在2.1条件下的实验结果(图3)显示, 5%SA/A的整体实验结果最优,7%SA/AC次之。而1%SA/AC的捕获活性随着反应时间的推移下降很快,1000 min时已经小于25%。过高的丁二酸浸渍量汞捕获活性反而降低,主要是因为过高的浸渍量使AC孔道的堵塞造成有效活性位数量降低,表观汞捕获活性降低。
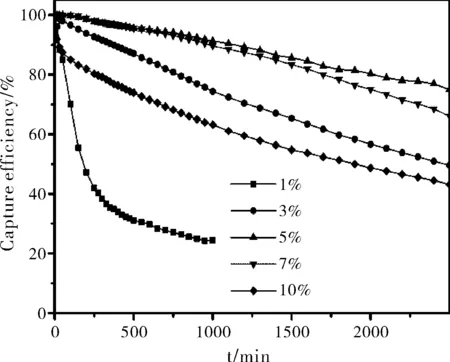
图3 不同浸渍量的SA/AC的汞捕获活性
2.3空速的影响
在2.1实验条件下考察了不同空速下(5000 h-1、12500 h-1、25000 h-1、37500 h-1、50000 h-1,对应的样品装填量依次为2.50 g, 1.00 g, 0.50 g, 0.33 g, 0.25 g)5% SA/AC的汞捕获效率(图4),可以看出,空速越低,越有利于汞的捕获。表1为1000 min时不同空速下吸附剂的总汞捕获量及单位质量吸附剂的汞捕获量,可以看出,空速越低,总的汞捕获量(Q)越大,但单位质量的汞捕获量(q)越小。
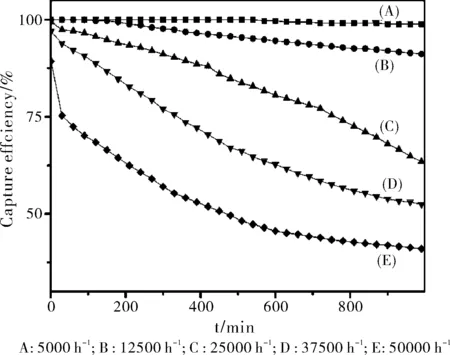
图4 不同空速下5%SA/AC的汞捕获活性
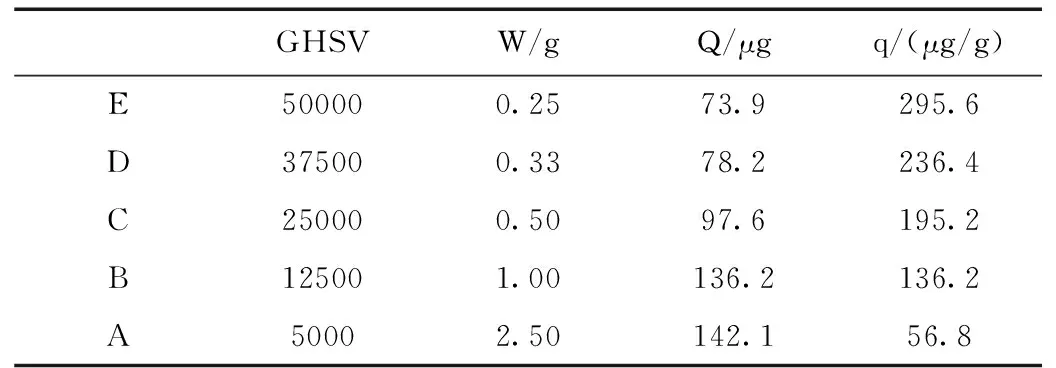
GHSVW/gQ/μgq/(μg/g)E500000.2573.9295.6D375000.3378.2236.4C250000.5097.6195.2B125001.00136.2136.2A50002.50142.156.8
2.4温度的影响
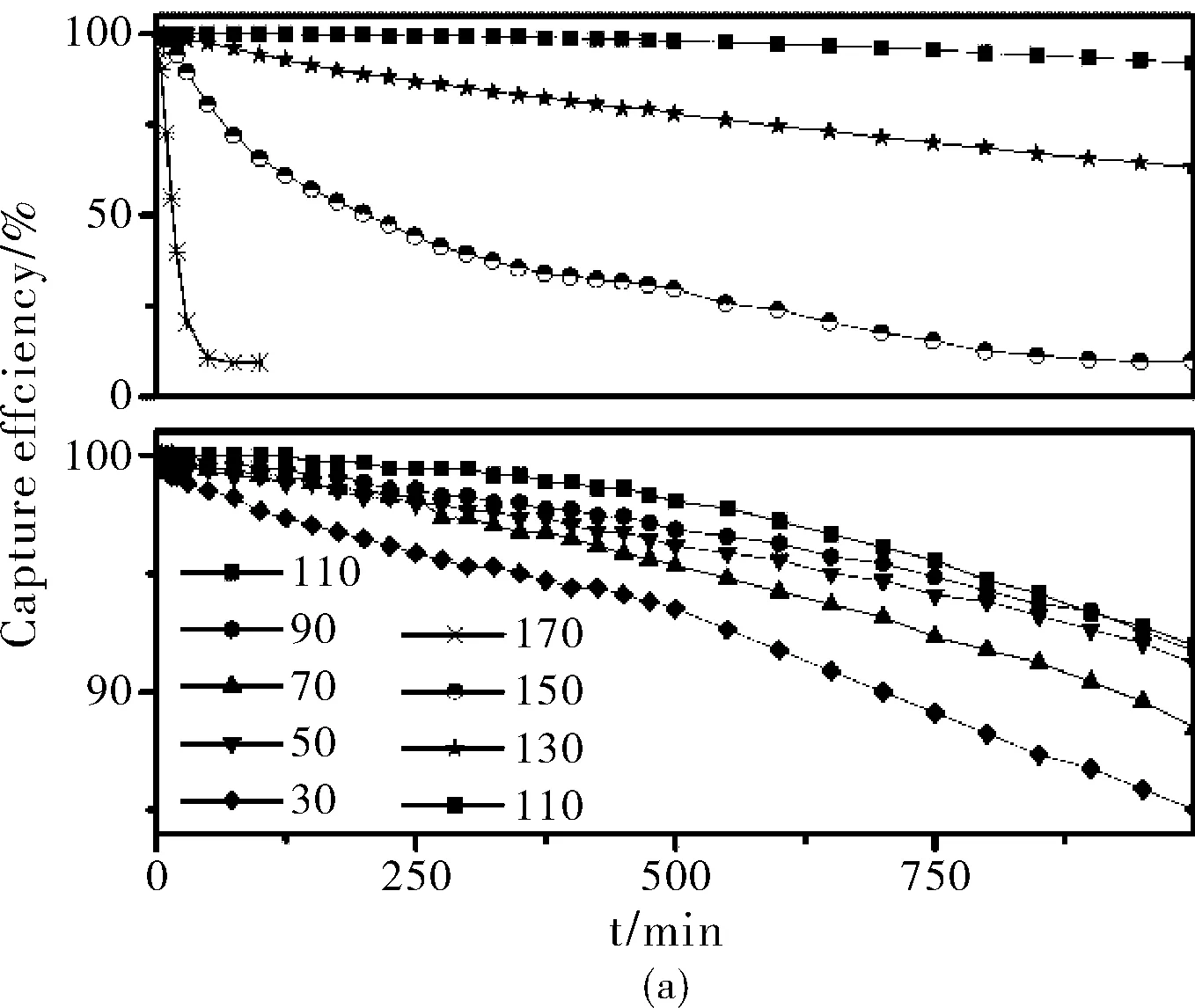
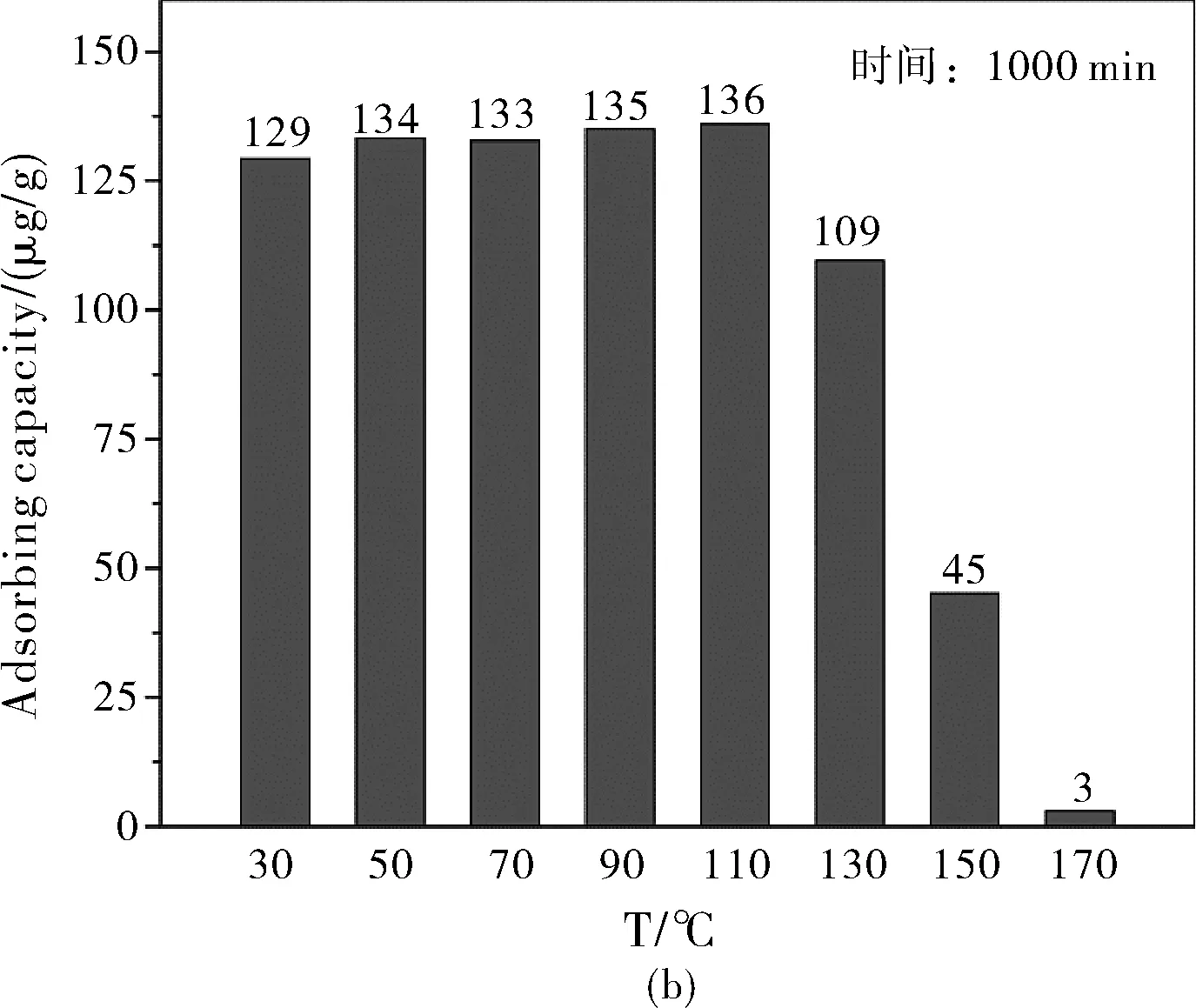
图5 5% SA/AC在不同温度下的汞捕获率随反应时间的关系图(a)和累计汞捕获量(b)
图5 给出了5% SA/AC不同温度的汞捕获实验结果 (其它实验条件与2.1相同),结果显示:在30~150 ℃之间,试样保持了好的汞捕获活性,110 ℃下吸附剂的活性最高。温度高于110 ℃时,随着温度的升高,吸附剂活性明显降低。170 ℃时,汞捕获能力已经很差。
吸附剂可分为物理作用型、化学作用型或物理化学共同作用型[18]。一般认为Hg0的捕获由物理吸附和化学氧化两步完成[19],吸附剂对Hg0的脱除效率主要取决于吸附剂的物化特性。温度升高不利于Hg0的物理吸附,而条件实验结果显示在30~110 ℃区间,温度越高活性越高,这说明物理吸附不是影响SA/AC的Hg0捕获活性的主要因素。因此,相对于未处理的AC,改性后AC的高活性是因为表面化学特性的改变提高了其对吸附在Hg0的化学氧化能力。文献认为增加AC表面的含氧官能团能够促进Hg0吸附氧化[12],谭增强[20]进一步证明具有碳氧双键结构的羧基、羧酐、内酯基是Hg0吸附氧化的活性位点,浸渍在AC表面的丁二酸的羧基基团同样具有催化氧化Hg0的能力,这就是丁二酸浸渍处理后AC的汞捕获活性大幅提高的原因。
3 结 论
为了提高AC对烟气Hg0的脱除能力,找到了一种新颖、高效的改性工艺:丁二酸浸渍法。实验结果显示,丁二酸改性处理后AC的Hg0的捕获能力显著提高。从室温到150 ℃的温度区间表现出很好的活性,其中,在110 ℃下5% SA/AC的活性最高,最大汞吸附量达到890 μg·g-1。丁二酸处理后AC的汞捕获活性的大幅提高是因为丁二酸的羧基官能团对Hg0的催化氧化作用。
[1]Pacyna EG, Pacyna JM, Steenhuisen F, et al. Global anthropogenic mercury emission inventory for 2000[J]. Atmospheric Environment, 2006,40(22):4048-4063.
[2]Pacyna EG, Pacyna JM, Sundseth K, et al. Global emission of mercury to the atmosphere from anthropogenic sources in 2005 and projections to 2020[J]. Atmospheric Environment, 2010,44(20):2487-2499.
[3]Harada M. Minamata disease methylmercury poisoning in japan caused by environmental-pollution[J]. Critical Reviews in Toxicology, 1995,25(1):1-24.
[4]Pavlish JH, Sondreal EA, Mann MD, et al. Status review of mercury control options for coal-fired power plants[J]. Fuel Processing Technology, 2003,82(2-3): 89-165.
[5]Pavlish JH, Holmes MJ, Benson SA, et al. Application of sorbents for mercury control for utilities burning lignite coal[J]. Fuel Processing Technology, 2004,85(6-7): 563-576.
[6]Streets DG, Zhang Q, Wu Y. Projections of global mercury emissions in 2050[J]. Environ Sci Technol, 2009,43(8): 2983-2988.
[7]Galbreath KC, Zygarlicke CJ. Mercury transformations in coal combustion flue gas[J]. Fuel Processing Technology, 2000,65-66(0): 289-310.
[8]Senior CL, Sarofim AF, Zeng T, et al. Gas-phase transformations of mercury in coal-fired power plants[J]. Fuel Processing Technology, 2000,63(2-3): 197-213.
[9]Srivastava RK, Hutson N, Martin B, et al. Control of Mercury Emissions from Coal-Fired Electric Utility Boilers[J]. Environ Sci Technol, 2006,40(5): 1385-1393.
[10]Lee S-H, Park Y-O. Gas-phase mercury removal by carbon-based sorbents[J]. Fuel Processing Technology, 2003,84(1-3): 197-206.
[11]Skodras G, Diamantopoulou I, Zabaniotou A, et al. Enhanced mercury adsorption in activated carbons from biomass materials and waste tires[J]. Fuel Processing Technology, 2007,88(8): 749-758.
[12]Ma J, Li C, Zhao L, et al. Study on removal of elemental mercury from simulated flue gas over activated coke treated by acid[J]. Applied Surface Science, 2015,329(0): 292-300.
[13]Lopez-Anton MA, Rumayor M, Díaz-Somoano M, et al. Influence of a CO2-enriched flue gas on mercury capture by activated carbons[J]. Chemical Engineering Journal, 2015,262(0): 1237-1243.
[14]Wang J, Yang J, Liu Z. Gas-phase elemental mercury capture by a V2O5/AC catalyst[J]. Fuel Processing Technology, 2010,91(6): 676-680.
[15]Hu C, Zhou J, He S, et al. Effect of chemical activation of an activated carbon using zinc chloride on elemental mercury adsorption[J]. Fuel Processing Technology, 2009,90(6): 812-817.
[16]Reddy KSK, Al Shoaibi A, Srinivasakannan C. Elemental mercury adsorption on sulfur-impregnated porous carbon -A review[J]. Environmental Technology, 2014,35(1): 18-26.
[17]Li YH, Lee CW, Gullett BK. Importance of activated carbon’s oxygen surface functional groups on elemental mercury adsorption[J]. Fuel, 2003,82(4): 451-457.
[18]Boehm HP. Some aspects of the surface-chemistry of carbon-blacks and other carbons[J]. Carbon, 1994,32(5): 759-769.
[19]Zhang B, Xu P, Qiu Y, et al. Increasing oxygen functional groups of activated carbon with non-thermal plasma to enhance mercury removal efficiency for flue gases[J]. Chemical Engineering Journal, 2015,263: 1-8.
[20]Tan Z, Sun L, Xiang J, et al. Gas-phase elemental mercury removal by novel carbon-based sorbents[J]. Carbon, 2012,50(2): 362-371.
Activated Carbon Impregnated with Succinic Acid Used for Capturing Elemental Mercury in Simulated Flue Gas
HOUQi-xiong1,HUANGZhang-gen2,HUTuo-ping1,CUIYan2
(1 North university of China,Shanxi Taiyuan 030051; 2 Shanxi Institute of Coal Chemistry,Chinese Academy of Science,Shanxi Taiyuan 030001,China)
To improve gas-phase elemental mercury (Hg0) removal efficiency of activated carbon (AC), a novel and efficient method was proposed. AC was impregnated with succinic acid (SA/AC). The effects of SA loading value, temperature, and space velocity on Hg0removal efficiency of SA/AC were investigated under simulated flue gas conditions. The results showed that the Hg0capture capability of SA/AC was much higher than virginal AC, and the maximum promotion succinic acid loading value and reaction temperature was around 5wt% and 110 ℃, respectively.
activated carbon;succinic acid;elemental mercury;flue gas
侯启雄(1986-),男,硕士,主要从事燃煤烟气中汞的脱除。
黄张根(1974-),男,研究员,主要从事燃煤烟气污染物的一体化脱除。
X511
A
1001-9677(2016)07-0110-04
