尼妥珠单抗增强食管鳞癌放疗敏感性的研究*
2016-09-03原强兰胜民郭汝元李红卫曹建忠
原强 兰胜民 郭汝元 李红卫 曹建忠
·基础研究·
尼妥珠单抗增强食管鳞癌放疗敏感性的研究*
原强①兰胜民②郭汝元②李红卫②曹建忠②
目的:研究尼妥珠单抗(h-R3)对人食管鳞癌KYSE450细胞的放射增敏效应。方法:利用四氮唑盐(MTT)比色法分析h-R3、X线照射及两者联合对人食管癌KYSE450细胞的生长抑制作用,通过流式细胞仪分析细胞周期分布及细胞凋亡的变化。采用克隆形成实验检测h-R3对食管癌细胞系放射敏感性的影响,多靶单击模型拟合细胞存活曲线。同时采用基因芯片技术对h-R3组、h-R3联合照射组两组进行检测,筛选不同组之间的差异基因,用生物信息学分析差异基因功能。结果:h-R3组、照射组和h-R3联合照射组对KYSE450细胞生长均有抑制作用,且联合照射组对KYSE450细胞的生长抑制作用最强(35.25±5.62)%,明显高于h-R3组(16.12±8.73)%和照射组(27.64±6.66)%(F=10.953,P<0.001)。联合照射组细胞出现明显的G2期阻滞和细胞凋亡,G2期细胞和凋亡细胞所占比例最高,分别达到(29.37±7.29)%(F=17.299,P<0.001)和(18.80±2.03)%(F=85.691,P<0.001)。多靶单击模型显示,h-R3联合照射组的SF2、Do、Dq值均较单纯照射组减小(SER=1.63),提示h-R3对KYSE450细胞有放射增敏作用。基因芯片分析发现h-R3可通过下调EGF/PDGF信号传导通路的相关基因发挥放疗增敏作用。结论:尼妥珠单抗能有效抑制人食管癌KYSE450细胞的生长,与X射线照射联合后能够促进细胞凋亡,增强G2期阻滞效应,能够增强食管癌KYSE450细胞对X射线的放疗敏感性,此效应与下调表皮生长因子受体(epidermal growth factor receptor,EGFR)信号传导通路的相关基因有关。
尼妥珠单抗食管癌照射表皮生长因子受体放疗敏感性
食管癌是我国高发的消化道恶性肿瘤,国内食管癌每年新发病例25.9万例,发病率为16.7/10万,居各类恶性肿瘤第5位;死亡率为13.4/10万,高居第4位[1]。目前对早、中期食管癌患者治疗主要以手术或放疗为主,对晚期食管癌患者采用放化疗联合的综合治疗。放射治疗是食管癌最主要的治疗手段之一。目前,食管癌综合治疗后5年生存率仍然低于20%[2],可能原因是肿瘤细胞对放疗的抵抗降低了治疗的效果。因此,如何增强肿瘤的放射治疗敏感性,提高治疗效果成为放射治疗食管癌的研究热点。
有研究表明,表皮生长因子受体(epidermal growth factor receptor,EGFR)在人类的多种实体肿瘤组织中都有过表达,且其表达异常与恶性肿瘤的增殖、分化、血管形成、凋亡抑制、侵袭转移和放疗抵抗性有关,是目前最受关注的抗肿瘤靶点之一[3]。食管鳞癌EGFR的表达率为40%~80%,属于中、高度表达[4-5]。尼妥珠单抗(h-R3,泰欣生)是人源化的EGFR单抗药物,在大多EGFR高表达的肿瘤中,h-R3能够竞争性抑制内源性配体与EGFR的结合,阻断EGFR介导的下游信号传导通路,从而促进肿瘤细胞的凋亡,增强放射治疗的敏感性,具有特异性强、人源化程度高、半衰期长、不良反应小等特点[6]。本实验研究了h-R3联合X线对人食管鳞癌细胞系KYSE450生长的影响,并初步探讨其放疗增敏机制,为临床治疗提供实验依据。
1 材料与方法
1.1.1细胞系及培养条件人食管鳞癌细胞株KYSE450购于北京赛默飞世尔生物化学制品有限公司,含10%胎牛血清的RPMI 1640培养基,置于5% CO2、饱和湿度、37℃培养箱中培养。
1.1.2主要试剂和仪器尼妥珠单抗(泰欣生,h-R3)由北京百泰生物药业有限公司提供,RPMI 1640培养基购于北京赛默飞世尔生物化学制品有限公司,无噬菌体胎牛血清购于浙江天杭生物科技有限公司,MTT、分析纯DMSO、PBS、Giemsa染液购于北京索莱宝科技有限公司(Solarbio),Annexin V细胞凋亡试剂盒、细胞周期试剂盒购于联科生物,TRIzol试剂购于美国英杰生命技术有限公司(Invitrogen),医用电子直线加速器(Elekta Synergy)由山西医学科学院山西大医院提供,酶标仪(深圳雷杜生命科学股份有限公司)中国辐射防护研究院提供,流式细胞仪(Beckman Coulter)中国辐射防护研究院提供。
1.1.3分组采用数字随机表法分为空白对照组(不做任何处理)、h-R3组、照射组(直线加速器照射4 Gy,源皮距100 cm,照射剂量率为0.60 Gy/min)、h-R3联合照射组(h-R3干预作用24 h后进行4 Gy照射)。
1.2方法
1.2.1MTT法测定KYSE 450细胞的生长抑制作用取对数生长期KYSE 450细胞,8×103个/孔接种于96孔板,每孔200 μL,每组做6个复孔,贴壁过夜。h-R3组细胞经50 μg/mL h-R3处理24 h后继续培养72 h,h-R3联合照射组经50 μg/mL h-R3处理24 h后给予4 Gy X线照射,继续培养72 h,照射组只在同一时间给予4 Gy X线照射。到达培养时间后,每孔加入0.5%的MTT液20 μL,孵育4 h后弃去原培养液并加入150 μL DMSO,振荡12 min后酶标仪测定492 nm处吸光度(A)值。并计算细胞生长抑制率。
生长抑制率(%)=(1-实验组A值/对照组A值)× 100%
1.2.2流式细胞仪检测细胞周期分布及细胞凋亡取对数生长期的KYSE 450细胞,4×105个/孔接种于6孔培养板,按上述分组设4组,每组设3复孔。贴壁过夜后,h-R3组细胞经50 μg/mL h-R3处理,h-R3联合照射组经50 μg/mL h-R3处理24 h后给予4 Gy X线照射,照射组只在同一时间给予4 Gy X线照射。24 h后消化、离心、PBS洗涤收集用于细胞周期检测的细胞,48h后收集用于细胞凋亡检测的细胞。严格按照细胞周期试剂盒和Annexin V细胞凋亡试剂盒的说明书操作,用流式细胞仪检测细胞周期和凋亡。
1.2.3平板克隆形成实验检测放疗敏感性设单纯照射组、h-R3联合照射组,收集对数生长期KYSE450细胞,制成单细胞悬液接种于6孔板,设0、2、4、6和8 Gy剂量点,分别接种500、1 000、1 500、2 000、2 500个/孔,每组每个剂量点均设3个复孔,贴壁过夜,h-R3联合照射组更换含50 μL/mL h-R3培养液,作用24 h后分别给予上述不同剂量X线照射,继续培养72 h后,弃去原培养液,更换常规培养液继续培养10 d后,甲醇固定,Giemsa染色,低倍镜下计数>50个细胞的克隆数,计算不同射线剂量下的克隆形成率(PE)和存活分数(SF)。
PE(%)=克隆数/接种细胞数×100%
SF=PE联合组/PE单纯照射组×100%
将取得的平均数用Sigmaplot软件,根据多靶单击模型S=1-(1-e-Do/D)N拟合细胞存活曲线,并计算细胞放射敏感性参数:平均致死剂量(Do)、准阈剂量(Dq)、外推值(N)、照射2 Gy时的细胞存活分数(SF2)和放射增敏比(SER)。
1.2.4基因芯片技术检测单纯照射组与h-R3联合照射组差异基因采用TRIzol一步法提取两种细胞系的总RNA,-80℃冷冻后,干冰包裹运输,由上海欧易生物医学科技有限公司采用Agillengt人类全基因组表达谱芯片(8×60K)进行检测,取每种样品100 μL,利用NanoDrop ND-2000(Thermo Scientific)定量并经Agilent Bioanalyzer 2100(Agilent Technologies)检测RNA完整性。RNA质检合格后,样本的标记、芯片的杂交以及洗脱参照芯片标准流程。首先,总RNA反转录成双链cDNA,再进一步合成用Cyanine-3-CTP (Cy3)标记的cRNA。标记好的cRNA和芯片杂交,洗脱后利用Agilent Scanner G2505C(Agilent Technologies)扫描得到原始图像。
1.3统计学分析
2 结果
2.1MTT测定KYSE 450细胞的生长抑制作用
h-R3组、照射组和联合照射组对KYSE450细胞生长均有抑制作用,且联合照射组对KYSE450细胞的生长抑制作用最强(35.25±5.62)%,明显高于h-R3组(16.12±8.73)%和照射组(27.64±6.66)%(F= 10.953,P<0.001),见表1。结果表明h-R3与照射联合更能有效地抑制KYSE450细胞的生长,两者具有协同效应。
2.2h-R3联合照射组对KYSE450细胞周期分布及凋亡的影响
流式细胞仪分析结果显示,与无药对照组比较,各实验组细胞停留在G2/M期的细胞比例均增加,联合组G2/M期细胞所占比例最高(29.37±7.29)%(F= 17.299,P<0.001)。与无药对照组比较,各实验组细胞凋亡率均明显升高,联合组凋亡率最高(18.80± 2.03)%(F=85.691,P<0.01),与h-R3组和照射组比较具有增加凋亡的趋势(表2)。图1A为对照组周期分布图,图1b为放疗组,图1C为药物组,图1D联合组,图中三个高峰从左到右分别为G1期、S期、G2期。图2A为对照组细胞凋亡图,图2B为放疗组,图2C为药物组,图2D联合组,L1象限代表坏死细胞,L2、L4象限代表凋亡细胞。
2.3平板克隆形成实验结果
根据不同照射剂量得到的平均存活分数,拟合存活曲线(图3),h-R3能够抑制KYSE450细胞的克隆性增殖,并计算各组的放射敏感性参数。实验结果显示,h-R3对KYSE450细胞有放射增敏作用,SER 为1.63,联合组Do、Dq、N、SF2与单纯照射组比较均降低(表3)。
2.4基因芯片结果分析
单纯照射组及h-R3联合照射组细胞系RNA样品检测结果均满足质控标准(2100 RIN≥7.0,28S/ 18S≥0.7),样品RNA纯度好,未降解,符合芯片实验要求(表4)。h-R3联合照射组与单纯照射组相比筛选出463条与EGFR通路相关基因,其中上调基因352条,下调基因111条。
表1 h-R3作用48h后不同实验组KYSE450细胞的生长抑制率 (±s)Table 1 Growth inhibition rates of KYSE450 cells in different experimental groups(±s)

表1 h-R3作用48h后不同实验组KYSE450细胞的生长抑制率 (±s)Table 1 Growth inhibition rates of KYSE450 cells in different experimental groups(±s)
F±s(%)P Group h-R3 IR IR+h-R3 16.12±8.73 27.64±6.66 35.25±5.62 10.953<0.001
表2 不同实验组KYSE450细胞的细胞周期分布与凋亡率 (±s)Table 2 Cell cycle distribution and apoptosis rates of KYSE450 cellsin different experimental groups(±s)

表2 不同实验组KYSE450细胞的细胞周期分布与凋亡率 (±s)Table 2 Cell cycle distribution and apoptosis rates of KYSE450 cellsin different experimental groups(±s)
Group Control h-R3 IR IR+h-R3 S F P G0/G154.57±3.43 57.43±5.08 62.00±1.92 36.40±2.65 3.232 0.082 G2/M 6.57±1.25 12.10±1.39 20.30±3.47 29.37±7.29 17.299 <0.001 38.87±4.51 30.50±6.38 17.67±2.80 34.23±14.26 3.652 0.063 Apoptosis rates (%)2.00±0.26 8.97±1.58 13.37±0.61 18.80±2.03 85.691 <0.001

表3 KYSE450细胞在h-R3联合照射作用下的放射敏感性参数Table 3 Radiation sensitivity parameters of KYSE450 cellsin different experimental groups

图1 流式细胞仪检测各组细胞周期分布图(图中3个高峰从左到右分别为G1期,S期,G2期)Figure 1 Flow cytometry instrument testing of cell cycle distribution(three peaks from left to right:G1phase,S phase,and G2phase)

图2 流式细胞仪检测细胞凋亡分布图(图中L1象限代表坏死细胞,L2、L4象限代表凋亡细胞)Figure 2 Flow cytometry instrument testing of cell apoptosis distribution(L1:dead cells,L2,L4:apoptotic cells)
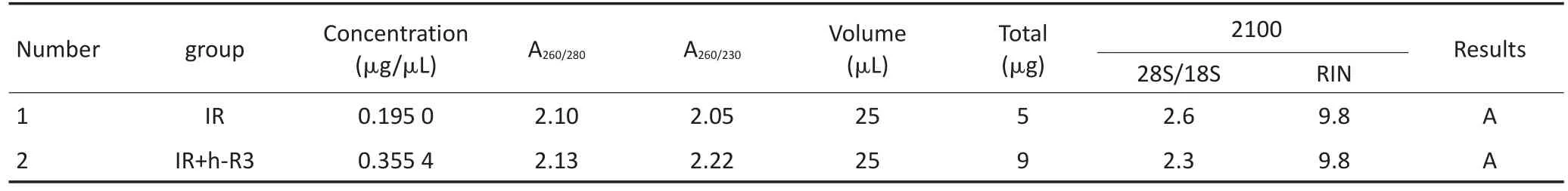
表4 RNA样品质检基本信息Table 4 Basic information of RNA sample quality
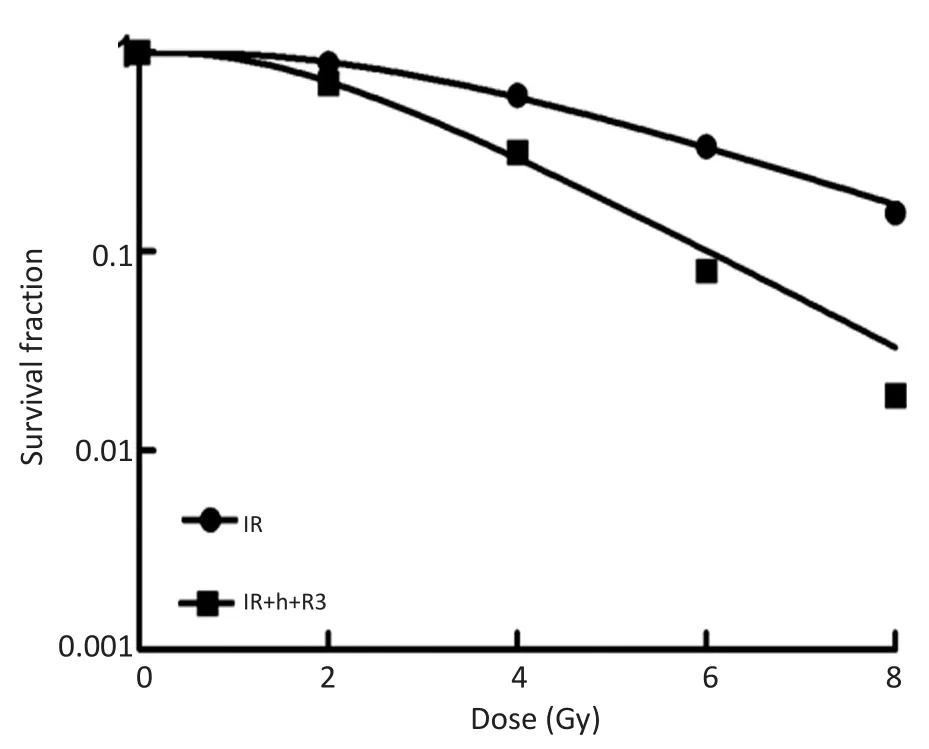
图3 h-R3组与联合组KYSE450细胞生长曲线Figure 3 Cell growth curves of IR group and IR+h-R3 group
3 讨论
近年来分子靶向治疗的研究日新月异,越来越多肿瘤分子靶点得以识别,如EGFR、VEGF、C0X-2等,为晚期食管癌患者的治疗带来了新的希望[7]。表皮生长因子受体(EGFR)属Ⅰ型跨膜酪氨酸激酶生长因子受体,是原癌基因C-erbB-1的表达产物,在人类多种实体肿瘤特别是头颈部肿瘤、非小细胞肺癌中均有过表达,与肿瘤分期成正相关,与预后及放化疗敏感性成负相关[8]。EGFR信号转导通路的激活与肿瘤细胞的增殖、分化、血管形成、药物耐药、侵袭转移等密切相关[9]。尼妥珠单抗(h-R3,泰欣生)正是针对EGFR的单抗药物,能够竞争性抑制内源性配体与EGFR的结合,阻断EGFR介导的下游信号传导通路,从而促进肿瘤细胞的凋亡,增强放射治疗的敏感性。
MTT结果表明,尼妥珠单抗体外作用于食管鳞癌KYSE450细胞,可显著抑制其增殖,并与X线照射有一定的协同作用。克隆形成实验结果显示,尼妥珠单抗联合照射组的SF2、D0、Dq及N值和单纯照射组相比均显著降低,SER为1.63,表明尼妥珠单抗能够提高食管鳞癌细胞KYSE450的放射敏感性。EG-FR的高表达能引起下游信号传导通路异常活化,异常活化的EGFR通路可以改变细胞的生长特性,以EGF等配体依赖的方式促进细胞恶性转化,导致肿瘤的发生。而后形成的肿瘤细胞又能以自分泌和旁分泌方式产生EGFR的特异性配体,从而抑制肿瘤细胞的凋亡,促进肿瘤细胞的增殖。尼妥珠单抗能够识别肿瘤细胞EGFR的表达,通过竞争性抑制内源化配体与EGFR的结合,阻断EGFR介导的下游信号通路的传导,从而抑制肿瘤细胞的增殖,促进肿瘤细胞的凋亡,增强肿瘤细胞的放射敏感性。此外,尼妥珠单抗还可以导致肿瘤细胞血管内皮生长因子(VEGF)在RNA和蛋白质水平表达的下调,抑制肿瘤血管生成,从而抑制肿瘤细胞生长[10]。
流式细胞仪检测细胞周期分布及细胞凋亡结果表明尼妥珠单抗和X线照射能使KYSE450细胞阻滞于G2期,尼妥珠单抗与X线联合作用后G2期细胞比例明显增多,并且细胞凋亡率也增加显著。G2期是细胞DNA合成和修复的重要时期,细胞阻滞在这一周期,一方面无法继续增殖分化,另一方面也无法进行X线照射引起的DNA损伤修复[11]。G2期为肿瘤细胞的放射敏感期,在此期给予X线照射会使对放射敏感的肿瘤细胞出现凋亡或者坏死,细胞生长抑制率和凋亡率显著升高,从而提高肿瘤细胞的放射敏感性。此外,X线照射肿瘤细胞,可引起其EGFR的表达水平短暂升高[12],尼妥珠单抗通过阻断肿瘤细胞TGFa-EGFR-MAPK信号传导通路,减少EGFR短暂高表达引起的DNA辐射损伤修复,抑制细胞增殖,从而提高放射敏感性[13],增加凋亡,所以联合组细胞凋亡率最高。
基因芯片结果提示加入尼妥珠单抗的细胞系与单纯接受照射的细胞系在基因表达上出现很大程度的差异,主要集中在与EGFR相关的通路包括:MAPK、ErbB、Ras、Rap1、HIF-1、FoxO、Calcium、PI3KAkt,cytokine-cytokine receptor interaction,endocytosis等。这些信号通路不仅与肿瘤细胞的增殖、分化、侵袭转移密切相关[14],而且在肿瘤的治疗中也起到关键作用。在对乳腺癌的放射治疗研究中发现,EGFR/ PI3K/Akt等信号通路与放疗的敏感性和抗辐射性有关,且与放疗过程中肿瘤细胞的增殖、分化、缺氧密切相关[15]。尼妥珠单抗联合放射治疗可明显阻断EGFR/PI3K/Akt等信号通路,促进细胞凋亡,从而提高放射治疗敏感性。
肿瘤细胞对放射线的敏感性取决于DNA的损伤修复和细胞凋亡等多种因素。其中DNA双链断裂(DNA double strand break,DSB)的修复能力是主要因素,DSB的修复能力越差,其放射敏感性则越高[16]。电离辐射使DNA双链断裂时,H2AX C末端的SQ基因序列发生磷酸化,磷酸化的H2AX C末端多肽使呈不连续点状分布的γH2AX分子形成焦点。γH2AX焦点形成是DNA双链断裂程度的一个敏感指标,γH2AX焦点形成越多,残留的未修复的断裂DNA也就越多,意味着此肿瘤细胞放射敏感性越强[17]。有研究表明尼妥珠单抗联合X线,能够使食管癌细胞的γH2AX焦点明显增多,增加了未被修复的DNA损伤数量,促进肿瘤细胞凋亡,从而增加食管癌放射治疗的敏感性。放射线除了直接引起DSB导致DNA损伤,还可以使细胞间的水电离中和,产生大量氧自由基,细胞外的氧自由基通过活化的膜EGF受体直接通过胞质进入胞核,和DNA-PK结合,引起DNA-PK的催化亚基DNA-PKcs的激活,进行DNA损伤修复。尼妥珠单抗还可以抑制放疗后活化的EGFR进入核内激活DNA-PK,从而阻止DSB的修复[18]。
综上所述,尼妥珠单抗能够抑制食管鳞癌细胞系KYSE450的生长,促进细胞凋亡,尼妥珠单抗联合X线作用于KYSE450细胞,能够更显著地抑制其生长,促进细胞凋亡,具有放射增敏作用,此效应与下调EGFR信导传导通路的相关基因有关。由于肿瘤信号传导是一个多因素、多途径、交叉作用的复杂系统,因此针对分子靶点的靶向药物的机制研究是复杂而艰巨的,目前基于EGFR/PI3K/Akt等抑制剂与放化疗联合的治疗技术才刚刚起步,其作用机制尚不完全清晰,还需要进一步研究探索。
[1]Zheng RS,Zhang SW,Wu LY,et al.Analysis of cancer incidence and death in Chinese cancer registration areas,2008[J].China Cancer,2012,21(3):1-12.
[2]Jemal A,Mnrray T,Ward E,et a1.Cancer statistics,2005[J].CA Cancer J Clin,2005,55(1):10-30.
[3]Hu Jin.Targeted therapy of esophageal cancer[J].Modem Oncology,2014,22(7):1728-1732.
[4]Wang J,Yu JM,Jing SW,et al.Relationship between EGFR over-expression and clinicopathologic characteristics in squamous cell carcinoma of the esophagus:a meta-analysis[J].Asian Pac J Cancer Prev,2014,15(14):5889-5893.
[5]Li JC,Zhao YH,Wang XY,et al.Clinical significance of the expression of EGFR signaling pathway-related proteins in esophageal squamous cell carcinoma[J].Tumour Biol,2014,35(1):651-657.
[6]Tundidor Y,García-Hernández CP,Pupo A,et al.Delineating the functional map of the interaction between nimotuzumab and the epidermal growth factor receptor[J].MAbs,2014,6(4):1013-1025.
[7]Yang Y,Ling JC,Chen JQ,et al.Concurrent Chemoradiotherapy Combined with Nimotuzumab in the Treatment of Esophageal Carcinoma[J].Journal of Basic and Clinical Oncology,2014,27(5):400-404.[杨燕,李建成,陈俊强,等.同步放化疗联合尼妥珠单抗治疗食管癌[J].肿瘤基础与临床,2014,27(5):400-404.]
[8]Vladimirova LY,Agieva AA,Engibaryan MA,et al.Anti-EGFR monoclonal antibodies in locally advanced head and neck squamous cell cancer[J].Vopr Onkol,2015,61(4):580-592.
[9]Dahle-Smith Å,Stevenson D,Massie D,et al.Epidermal Growth Factor(EGFR)copy number aberrations in esophageal and gastroesophageal junctional carcinoma[J].Mol Cytogenet,2015,17(8):78-84.
[10]Song H,Pan B,Yi J,et al.Featured article:autophagic activation with nimotuzumab enhanced chemosensitivity and radiosensitivity of esophageal squamous cell carcinoma[J].Exp Biol Med(Maywood),2014,239(5):529-541.
[11]Liu H,Yang W,Gao H,et al.Nimotuzumab abrogates acquired radioresistance of KYSE-150R esophageal cancer cells by inhibiting EGFR signaling and cellular DNA repair[J].Onco Targets Ther,2015,25(8):509-518.
[12]Hatanpaa KJ,Burma S,Zhao D,et al.Epidermal growth factor receptor in glioma:signal transduction,neuropathology,imaging,and radioresistance[J].Neoplasia,2010,12(2):675-684.
[13]Velic D,Couturier AM,Ferreira MT,et al.DNA Damage Signalling and Repair Inhibitors:The Long-Sought-After Achilles'Heel of Cancer[J].Biomolecules,2015,20,5(4):3204-3259.
[14]Bhat FA,Sharmila G,Balakrishnan S,et al.Quercetin reverses EGF-induced epithelial to mesenchymal transition and invasiveness in prostate cancer(PC-3)cell line via EGFR/PI3K/Akt pathway[J].J Nutr Biochem,2014,25(11):1132-1139.
[15]Kaidar-Person O,Lai C,Kuten A,et al.The Infinite Maze of breast cancer,signaling pathway and radioresistance[J].Breast,2013,22 (4):411-418.
[16]Liu XQ,Qiao TK.Effect of silencing of ATM expression by siRNA on radiosensitivity of human lung adenocarcinoma A549 cells[J].Chinese Journal of Radiation Oncology,2014,1(23):73-77.[刘小群,乔田奎.靶向沉默ATM基因对人肺腺癌A549细胞放射敏感性影响[J].中华放射肿瘤学杂志,2014,1(23):73-77.]
[17]Klokov D,MacPhail SM,Banath JP,et al.Phosphorylated histone H2AX in relation to cell survival in tumor cells and xenografts exposed to single and fractionated doses of X-rays[J].Radiotherapy oncology,2006,80(2):223-229.
[18]Abdel-Fatah TM,Arora A,Moseley P,et al.ATM,ATR and DNA-PKcs expressions correlate to adverse clinical outcomes in epithelial ovarian cancers[J].BBA Clin,2014,14,14(2):10-17.
(2015-12-07收稿)
(2016-01-10修回)
(编辑:周晓颖校对:杨红欣)

原强专业方向为肿瘤放射治疗。
E-mail:184047174@qq.com
Nimotuzumab enhanced the radio sensitivity of esophageal squamous cell carcinoma
Qiang YUAN1,Shengmin LAN2,Ruyuan GUO2,Hongwei LI2,Jianzhong CAO2
Correspondence to:Jianzhong CAO;E-mail:Caolv2000@sina.com
1Institute of Medical Imaging,Shanxi Medical University,Taiyuan 030001,China;2Shanxi Medical University Affiliated Tumor Hospital,Shanxi Province Tumor Hospital(Institute),Radiation Therapy Center in Shanxi Province,Taiyuan 030013,China This work was supported by the Health and Family Planning Commission of Shanxi Province Scientific Research Project(No.2015051)
Objective:To study the radiation-sensitizing effects of nimotuzumab and X-ray radiotherapy on human esophageal carcinoma KYSE450 cells.Methods:Human esophageal carcinoma cells KYSE450 were treated with nimotuzumab,irradiation,and the combination of both.Cell growth inhibition was evaluated by MTT assay,and cell cycle distribution and apoptosis were analyzed by flow cytometry assay.Cell radiosensitivity was tested by clonogenic assay,and the survival curve was fitted using multi-target single-hit model.The combination and accelerated radiation groups were tested by microarray technology,and the differentially expressed genes were screened among the two groups.Results:The growth of KYSE450 cells was inhibited in three groups,namely,the group treated with nimotuzumab,the group treated with irradiation,and the group treated with both.The group treated with both nimotuzumab and irradiation resulted in the highest inhibition rate(35.25%±5.62%)compared with that of the nimotuzumab(16.12%±8.73%)and irradiation groups(27.64%±6.66%)(F=10.953,P<0.001).The highest rates of G2phase arrest and cell apoptosis were observed in the group treated with the combination of nimotuzumab(29.37%±7.29%)(F=17.299,P<0.001)and irradiation(18.80%±2.03%)(F=85.691,P<0.001).Multi-target single-hit model showed that the values of SF2,Do,and Dq in the group with both treatments were smaller than those of the irradiation group with sensitization enhancement ratio of 1.63,which confirmed the radiosensitization effect of nimotuzumab on KYSE450 cells.Microarray technology analysis found that nimotuzumab can enhance the radiosensitivity of esophageal squamous cell carcinoma by cutting the genes of EGF/PDGF signaling pathways.Conclusion:This experiment shows that nimotuzumab can effectively inhibit the growth of human esophageal cancer cell KYSE450.Nimotuzumab can also promote apoptosis and G2 phase arrest when combined with X-ray radiotherapy,thereby enhancing the radiosensitivity of KYSE450 cells.This effect is associated with cutting the genes of EGFR signaling pathways.
nimotuzumab,esophageal carcinoma,radiation,epidermal growth factor receptor,radiosensitivity
10.3969/j.issn.1000-8179.2016.04.361
①山西医科大学医学影像学系(太原市030001);②山西医科大学附属肿瘤医院,山西省肿瘤研究所,山西省放疗中心
*本文课题受山西省卫生计生委科研课题项目(编号:2015051)资助
曹建忠Caolv2000@sina.com
