秦皮乙素对荷瘤小鼠红细胞免疫功能的影响
2016-09-02许冉达邵天宇贾绍华
许冉达,邵天宇,贾绍华
(哈尔滨商业大学药学院,哈尔滨150076)
秦皮乙素对荷瘤小鼠红细胞免疫功能的影响
许冉达,邵天宇,贾绍华
(哈尔滨商业大学药学院,哈尔滨150076)
研究秦皮乙素对S180荷瘤小鼠红细胞免疫功能的影响,探讨秦皮乙素红细胞免疫抗肿瘤机制.采用体内移植S180肿瘤细胞株复制S180荷瘤小鼠模型.以红细胞免疫花环实验检测红细胞免疫黏附肿瘤细胞的能力;采用分光光度法测定荷瘤小鼠红细胞膜唾液酸含量、Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性.采用Western blot测定带3蛋白含量.结果表明:秦皮乙素能够增强S180荷瘤小鼠红细胞免疫黏附肿瘤细胞的能力;增加红细胞膜唾液酸含量及带3蛋白含量;提高红细胞膜Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性.秦皮乙素可能通过改善S180荷瘤小鼠红细胞膜的功能状态,提高膜的稳定性,增强红细胞免疫黏附肿瘤细胞的能力,从而发挥其抗肿瘤作用.
秦皮乙素;S180荷瘤小鼠;红细胞免疫;抗肿瘤
秦皮为常用中药,始载于神农本草经,为木犀科植物苦枥白蜡树 (Fraxinus rhynchop hylla Hance)、白蜡树(F.chinensis Roxb.)、尖叶白蜡树(F.sz aboana Lingelsh.)或宿柱白蜡树(F.stylosa Lingelsh.)等的干燥枝皮或干皮[1].现代药理学研究表明,秦皮具有抗肿瘤作用、抗炎镇痛作用、抗病原微生物作用、抗氧化作用以及神经保护和血管保护等作用[2].秦皮乙素(Aesculetin,AES)又称七叶亭,是秦皮的主要有效成分,化学名称为6,7-二羟基香豆素.已有文献报道AES在体内外均显示抗肿瘤和免疫调节作用,毒性较低,能够免疫调节鼠类的巨噬细胞和淋巴细胞[3].红细胞免疫是机体免疫不可或缺的一个组成部分,在研究中药抗肿瘤免疫调节作用中占有重要地位.因此,本研究初步探讨了秦皮乙素与荷瘤小鼠红细胞免疫功能的关系,为今后进一步研究其抗肿瘤作用机制提供帮助.
1 材料
1.1主要仪器
UV-2102紫外可见分光光度计(上海龙尼柯仪器有限公司),HH-2数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司),低温高速离心机(AvantiTM68 centrifuge,Beckman),低速自动平衡离心机(LDZ5-2型,北京医用离心机厂),DYY-8C型电泳仪电源(北京市六一仪器厂),干式恒温器(K30型,杭州奥盛仪器有限公司),超灵敏多功能成像仪(Amersham Imager 600型,GE Healthcare Bio-Sciernces AB).
1.2试剂与动物
秦皮乙素(上海源叶生物科技有限公司,HPLC ≥98%,批号CMO317YA14);黄芪多糖注射液(河南中亚沈鹏医药科技有限公司,批号160202711);苯甲基磺酰氟(PMSF,上海源叶生物科技有限公司);氯化钠注射液(哈尔滨三联药业有限公司,批号140111F1);肝素钠(Solarbio);唾液酸测定试剂盒、ATP酶测定试剂盒以及考马斯亮蓝蛋白测定试剂盒购自南京建成生物工程研究所;三甲基氨基甲烷(Tris,中国惠世生化试剂有限公司);SPF级封闭群ICR小鼠,雌雄各半,体重(20±2)g,购自长春市亿斯实验动物技术有限责任公司,许可证号:SCXK(吉-2011-0004).
2 实验方法
2.1实验分组、给药剂量及途径
将S180瘤株腹水(乳白色透明状态,血性腹水不可用)用无菌生理盐水按1∶4比例稀释,然后于ICR小鼠右腋下接种0.2 mL.小鼠随机分组,分为正常对照组(不接种瘤株的正常鼠)、模型组、黄芪多糖组100 mg/kg、AES低剂量组20 mg/kg、中剂量组40 mg/kg和高剂量组80 mg/kg,每组10只.接种(除正常对照组外)第二天小鼠按0.2 mL/次进行腹腔注射给药,每天1次,连续7 d.
2.2红细胞对肿瘤细胞免疫黏附能力的测定
依照郭峰[4]建立的红细胞黏附肿瘤红细胞花环实验,测定DTER.
2.3小鼠红细胞膜影泡的制备
停药24 h后,小鼠摘眼球采血,3 000 r/min离心5min,弃上清及中间白色绒毛状膜成分,下层红细胞沉淀用等渗磷酸缓冲液(PBS)洗涤3次,再悬浮于PBS(1∶1)中.取上述红细胞悬液按1∶20加入预冷的10 mmol/L pH 8.0 Tris-HCl缓冲溶液,同时加入蛋白酶抑制剂PMSF,4℃过夜后,4℃条件下13 500 r/min离心15 min,然后用10 mmol/L pH 8.0的Tris-HCl溶液洗涤1次,再用PBS洗涤2次,最后将白色沉淀物1∶1悬浮PBS中,即为红细胞膜影泡(亦称为不封闭悬液).
2.4红细胞膜唾液酸(Sialic acid,SA)浓度的测定
先用考马斯亮蓝蛋白测定试剂盒,应用分光光度计测定红细胞膜不封闭影泡影泡(制备方法同2.2)总蛋白OD值,根据公式计算出红细胞膜影泡总蛋白的质量浓度,再稀释红细胞膜影泡悬液到终质量浓度0.1g/L.按照唾液酸浓度测定试剂盒要求,进行唾液酸浓度的测定.
2.5红细胞膜Na+,K+-ATP酶、Ca2+,Mg2+-ATP酶活性的测定
测定红细胞膜不封闭影泡总蛋白质量浓度,再稀释到终质量浓度0.1 g/L(方法同2.3).按照试剂盒要求测定Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性.
2.6AES对带3蛋白(Band3)的影响
采用Western blot测定Band3蛋白质量浓度.配制5%浓缩胶、10%分离胶,80 V转100 V电泳1.5 h,200 mA转膜2 h,5%脱脂奶粉封闭1 h,4℃孵育一抗过夜,第二天回收一抗,TBST洗膜3次,室温孵育二抗1 h,TBST洗膜后在成像仪中显影.
2.7AES对红细胞膜阴离子转运活性的影响
制备2%红细胞悬液.按文献[5]进行红细胞膜阴离子转运活性的测定.
2.8数据处理
3 实验结果
3.1AES对红细胞黏附肿瘤细胞能力的影响
与正常组小鼠相比较,模型组红细胞黏附肿瘤细胞的能力明显下降(P<0.01).给予AES后荷瘤小鼠红细胞黏附肿瘤细胞的能力有所恢复各剂量组与模型组相比具有统计学差异(P<0.05,P<0.01).结果见表1.
表1 AES对红细胞黏附肿瘤细胞能力的影响(n=10,±S)
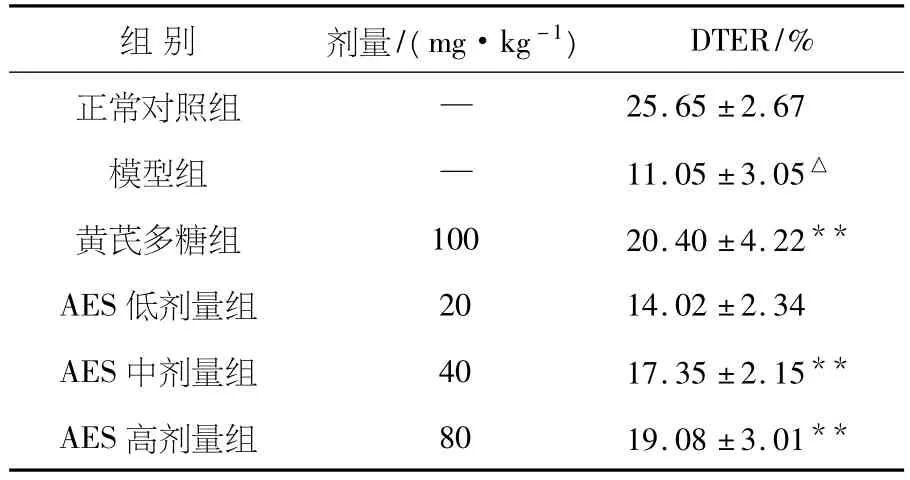
表1 AES对红细胞黏附肿瘤细胞能力的影响(n=10,±S)
注:与正常组相比,△P<0.01;与模型组相比,*P<0.05,**P <0.01.
25.65±2.67模型组 — 11.05±3.05△黄芪多糖组 100 20.40±4.22**AES低剂量组 20 14.02±2.34 AES中剂量组 40 17.35±2.15**AES高剂量组 80 19.08±3.01 DTER/%正常对照组 —组别 剂量/(mg·kg-1)**
3.2AES对红细胞膜SA浓度的影响
模型组荷瘤小鼠与正常组相比,红细胞膜SA浓度有明显的下降趋势(P<0.01).给予不同浓度AES作用后,荷瘤小鼠红细胞膜SA浓度有所升高,与模型组相比,中剂量和高剂量组具有统计学差异,见表2.
表2 AES对红细胞膜SA浓度的影响(n=10,±S)

表2 AES对红细胞膜SA浓度的影响(n=10,±S)
注:与正常组相比,△P<0.01;与模型组相比,**P<0.01.
组别 剂量/(mg·kg-1)SA浓度/(mmol·L-1)0.104±0.028模型组 — 0.021±0.010△黄芪多糖组 100 0.078±0.046**AES低剂量组 20 0.024±0.013 AES中剂量组 40 0.062±0.021**AES高剂量组 80 0.072±0.029正常对照组 —**
3.3AES对红细胞膜Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性的影响
结果见表3.模型组荷瘤小鼠红细胞膜Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性较正常组明显下降(P<0.01).给予不同浓度AES作用后两种酶活性显著上升,中高剂量组与模型组相比差异非常显著(P<0.01).
表3 AES对红细胞膜Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性的影响(n=10,±S)

表3 AES对红细胞膜Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性的影响(n=10,±S)
注:与正常组相比,△P<0.01;与模型组相比,**P<0.01.
组别 剂量/(mg·kg-1)Na+,K+-ATP酶活性/(μmolPi·mgprot-1·h-1)Ca2+,Mg2+-ATP酶活性/(μmolPi·mgprot-1·h-1)2.81±0.81 3.34±0.55模型组 — 1.03±0.52△ 1.35±0.36△黄芪多糖组 100 2.59±1.38** 3.03±0.60**AES低剂量组 20 1.47±0.60 1.54±1.03 AES中剂量组 40 2.12±0.50** 2.43±0.50**AES高剂量组 80 2.29±0.55** 2.57±1.00正常对照组 —**
3.4AES对Band3蛋白表达和阴离子转运活性的影响的影响
如图1所示,模型组荷瘤小鼠红细胞膜Band3蛋白的表达较正常组明显减少,随着给予AES浓度的增加,Band3蛋白的表达呈现上升趋势;而与正常组比较,模型组荷瘤小鼠的红细胞膜阴离子转运活性降低,给予AES治疗后荷瘤小鼠红细胞膜阴离子转运活性均有所恢复.与模型组相比,低剂量组有显著提高(P<0.05),中、高剂量组荷瘤小鼠有非常显著提高(P<0.04),结果见表4.常显著提高(P<0.01),AES中剂量组有显著提高(P<0.05),结果见表4.
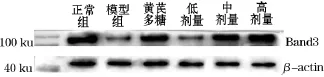
图1 红细胞膜Band3蛋白western表达图谱
表4 AES对红细胞膜阴离子转运活性的影响(n=10,±S)
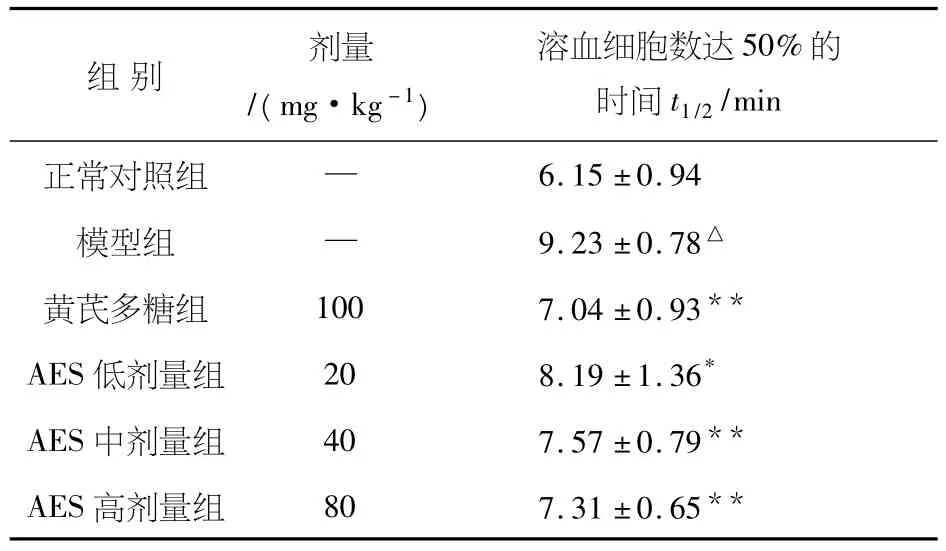
表4 AES对红细胞膜阴离子转运活性的影响(n=10,±S)
注:与正常组相比,△P<0.01;与模型组相比,*P<0.05**P<0.01.
组别 剂量/(mg·kg-1)溶血细胞数达50%的时间t1/26.15±0.94模型组 — 9.23±0.78△黄芪多糖组 100 7.04±0.93**AES低剂量组 20 8.19±1.36*AES中剂量组 40 7.57±0.79**AES高剂量组 80 7.31±0.65 /min正常对照组 —**
4 讨论
AES作为秦皮的主要有效成分,受到国内外学者的广泛关注,已被证明具有抗菌[6]、抗氧化[7]、抗炎[8]、抗肿瘤[9],保护神经和血管[10]以及抑制5-脂氧合酶[11]等作用.抗肿瘤方面,AES对体内外多种肿瘤细胞均有抑制作用和免疫调节作用,但针对荷瘤小鼠红细胞免疫功能的影响研究未见报道,故而对此进行初步研究.
红细胞免疫新兴于20世纪末,是机体免疫系统不可分割的一部分,创造了免疫抗肿瘤的新途径,而红细胞膜的结构与功能以及存在于红细胞膜上的相关物质是实现其免疫功能的重要保障.红细胞天然免疫黏附功能主要依赖于红细胞膜上所含补体受体Ⅰ型(CR1),也被称为C3b受体或CD35.肿瘤细胞可经旁路途径激活补体系统,结合C3b(补体C3的裂解物),而红细胞可以通过其膜上CR1与C3b结合从而识别和黏附肿瘤抗原,进而达到清除免疫复合物的作用,因此CR1的数量与活性与红细胞免疫抗肿瘤作用密切相关.SA是红细胞膜上CR1的重要构成,其特殊结构是细胞负电荷的主要来源,肿瘤患者的红细胞膜表面SA浓度减少,会导致红细胞的老化增加,细胞膜无法维持红细胞的正常结构,崩解破裂的红细胞增多,最终影响红细胞发挥其免疫作用,并且红细胞数量的骤减可能是肿瘤与贫血经常相伴而生的原因之一.从实验结果可以发现,与正常组相比较,模型组荷瘤小鼠的DTER与SA浓度显著降低,而AES可明显提高荷瘤小鼠DTER和SA浓度,说明AES可能通过提高SA浓度来恢复CR1的数量或活性,从而提高受到抑制的荷瘤小鼠的红细胞天然免疫黏附能力.
Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶是红细胞膜上重要的酶蛋白,膜内外离子平衡、物质交换、渗透压等均依赖于ATP酶,也是衡量红细胞膜结构完整性及反映氧化应激损伤程度的敏感指标[12].当红细胞膜ATP酶活性降低时,红细胞的离子通透性改变,胞内外电解质稳态会发生紊乱,进而导致红细胞膜脆性增大、流变性降低[13]. Band3蛋白是骨架网络在膜上的主要附着点,影响膜结构和功能,其介导的HCO3-/Cl-跨膜转运保障了红细胞正常的载运气体功能,因此Band3蛋白又称阴离子转运蛋白.在细胞中,Cl-是与Na+、K+、Ca2+等阳离子共同稳定细胞内离子环境的阴离子,等渗状态下,Cl-通过Band3蛋白可以从胞外转运入胞内,因此红细胞溶血时间的长短能够间接反映红细胞阴离子转运活性.Band3蛋白的表达多,即红细胞阴离子转运活性强,Cl-快速进入胞内于是缩短了红细胞的溶血时间;反之亦然.本实验研究发现,模型组红细胞膜上 ATP酶活性、Band3蛋白表达及阴离子转运活性较正常组相比明显降低,而AES能够升高荷瘤小鼠红细胞膜上Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶活性,增加Band3蛋白的表达以及阴离子转运活性,即可能通过调节各种阴阳离子的跨膜,维持膜的稳态,这可能是AES抗肿瘤的机制之一.
通过以上的研究发现,红细胞膜作为红细胞的基础结构,其上SA浓度保障了红细胞天然免疫黏附能力,膜上Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶及Band3蛋白,可能通过对各种阴阳离子跨膜的调节,保障了红细胞的稳态.而AES通过提高荷瘤小鼠红细胞膜上SA浓度以及Na+,K+-ATP酶和Ca2+,Mg2+-ATP酶的活性,恢复荷瘤小鼠红细胞Band3蛋白的表达和阴离子转运活性,提高红细胞膜的稳定性,改善荷瘤小鼠红细胞天然免疫黏附能力,从而增强红细胞免疫功能,达到抗肿瘤的作用.
[1]国家药典委员会.中华人民共和国药典一部[M].北京:化学工业出版社,2010.255.
[2]汪国松,杨亚滨,丁中涛,等.秦皮的研究进展[J].国医国药:植物药分册,2017,22(3):108-111.
[3] LEUNG K N,LEUNG PY,KONG L P,et al.Immunomodulatory effects of esculetin(6,7-dihydroxycoumarin)on murine lymphocytes and peritonealmacrophages[J].Cellular&Molecular Immunology,2005,2(3):181.
[4]郭峰.现代红细胞免疫学[M].上海:第一军医人学出版社,2002:62,87.
[5]余果宇,田兴亚,李家林.G6PD缺乏红细胞膜Band3蛋白阴离子转运功能的改变[J].昆明医学院学报,2003,24 (1):5-7.
[6]DUNCAN SH,LEITCH E C,STANLEY K N,et al.Effects of esculin and esculetin on the survival of Escherichia coli O157 in human faecal slurries,continuous-flow simulationsof the rumen and colon and in calves[J].British Journal Nutrition,2004,91 (5):749-755.
[7]WANGC,PEIA,CHEN J,etal.A natural coumarin derivative esculetin offers neuroprotection on cerebral ischemia/reperfusion injury in mice[J].Journal of Neurochemistry,2012,121(6):1007-1013.
[8]方莲花,吕扬,杜冠华.秦皮的药理作用研究进展[J].中国中药杂志,2008,33(23):2732-2736.
[9] HU Y,CHEN X,DUAN H,et al.Chinese herbalmedicinal ingredients inhibit secretion of IL-6,IL-8,E-selectin and TXB2 in LPS-induced rat intestinal microvascular endothelial cells[J].Immunopharmacology and Immunotoxicology,2009,31(4):550-555.
[10]PARK S S,PARK S K,MOON S K,et al.Esculetin inhibits cell proliferation through the Ras/ERK1/2 pathway in human colon cancer cells[J].Oncology Reports,2011,25(1):223 -230.
[11]KWON O S,CHOI JS,KIM H P,et al.Inhibition of 5-lipoxygenase and skin inflammation by the aerial parts of Artemisia capillaris and its constituents[J].Archives of Pharmacal Research,2011,34(9):1561-1569.
[12]高维纬,史冀鹏.不同剂量牛磺酸对拳击运动员红细胞ATP酶活性的影响[J].北京体育大学学报,2011,34(3):49-51,63.
[13]周游,谭颖,张文群,等.小檗碱对糖尿病大鼠脑内与血中Aβ的影响[J].哈尔滨商业大学学报:自然科学版,2015,31(4):385-388.,392.
Effect of Aesculetin on function of erythrocytemembrane in tumor-bearing m ice
XU Ran-da,SHAO Tian-yu,JIA Shao-hua
(School of Pharmacy,Harbin University of Commerce,Harbin 150076)
To study the effect of Aesculetin on the function of erythrocytemembrane in S180tumor-bearingmice and its erythrocyte immune mechanism of antitumor the model of S180tumor-bearingmice was obtained by transplanting S180tumor cell line in vivo.Erythrocytic immunity was assayed by red blood cell immune complexes rosette.The tumor-bearingmice red cellmembrane sialic acid content,activities of Na+,K+-ATPase and Ca2+,Mg2+-ATPase were tested by spectrophotometric method.Western Blot was used to determine the content of Band3 protein.Results indicate that Aesculetin can enhance the ability of S180tumor-bearingmice red cell immune adhesion of tumor cells,increase the content of saliva acid and Band3 protein in erythrocyte membrane and improve the activities of Na+,K+-ATPase and Ca2+,Mg2+-ATPase.Aesculetin may improve the function of erythrocyte membrane in S180tumor bearingmice,improve the stability of themembrane and enhance the ability of erythrocyte immune adherence to tumor cells,so as to fulfill its antitumor effect.
Aesculetin;S180tumor-bearingmice;erythrocyte immune;antitumor
R285
A
1672-0946(2016)02-0146-04
2015-12-02.
哈尔滨商业大学研究生创新科研项目(YJSCX2014-336HSD);哈尔滨商业大学博士科研启动项目(14LG01)
许冉达(1991-),男,硕士,研究方向:抗肿瘤药物活性及其机制.
贾绍华(1969-),男,博士,教授,研究方向:抗肿瘤药物活性及其机制.
