高效液相色谱法检测蜂蜜中大米糖浆掺假
2016-09-02张其安杨少波王坤丁晓敏卢德梅山东华康蜂业有限公司日照76500山东华瀚食品有限公司日照7686咸阳健康蜂业有限公司咸阳7400
张其安杨少波王坤丁晓敏卢德梅(山东华康蜂业有限公司,日照76500;山东华瀚食品有限公司,日照7686;咸阳健康蜂业有限公司,咸阳7400)
高效液相色谱法检测蜂蜜中大米糖浆掺假
张其安1杨少波1王坤2丁晓敏2卢德梅3
(1山东华康蜂业有限公司,日照276500;2山东华瀚食品有限公司,日照276826;3咸阳健康蜂业有限公司,咸阳713400)
建立了反相色谱快速测定蜂蜜中大米糖浆含量的分析方法。蜂蜜样品用水溶解后,直接上样至C18固相萃取柱净化,甲醇洗脱。洗脱液经浓缩、溶解、过滤后进行HPLC分析。采用Sinochrom ODS-BP柱,以水+乙腈=93+7为流动相,紫外检测波长300nm,外标法定量。结果表明,蜂蜜中大米糖浆掺假检出限(LOD)为20mg/m l,在50~200mg/g范围内线性关系良好,r≥0.9986;在线性范围内的添加水平平均回收率为82.7~96.3%,相对标准偏差(RSD)≤5.5%。该方法具有良好的精密度和重现性,适用于蜂蜜中大米糖浆掺假的检测。
高效液相色谱;紫外检测器;蜂蜜掺假;大米糖浆
蜂蜜是蜜蜂采集植物花蜜、分泌物或蜜露,与自身分泌物结合后,在巢脾内转化、脱水贮存至成熟而成的天然甜物质[1-2]。蜂蜜中含有多种活性物质,其主要成分为果糖和葡萄糖及4~5%的低聚果糖,另外蜂蜜中还含有丰富的氨基酸、维生素、活性酶、类黄酮、多酚类、类胡萝卜素等活性物质及多种矿物质[3],蜂蜜既具有极高的营养价值又具有保健作用[4]。我国是养蜂及蜂蜜出口大国,20世纪90年代我国蜂蜜出口量占世界年贸易量的40%。然而,蜂蜜是一种极易掺假的食品,近年来由于掺假等质量问题,使我国蜂蜜产品的信誉越来越低,出口量逐年下降[5]。为了规范蜂蜜市场,国家质量监督检验检疫总局、国家标准化委员会于2005年10月26日发布了GB18796-2005《蜂蜜》国家强制性标准,规定蜂蜜中不得添加或混入任何淀粉类、糖类、代糖类物质;不得在蜂蜜中添加其他任何防腐剂、澄清剂、增稠剂等异物。
目前针对蜂蜜掺假的检测方法主要有:薄层色谱法[6]、差示扫描热量法(DSC)[7]、离子色谱法[8]、近红外光谱法[9-10]、傅里叶转换-拉曼光谱法(FT-Ihman)[11]、C4植物糖含量法[12],13C/12C同位素比值法[13]、天然同位素核磁共振法(SNIF-NMR)[14-16]等。以上方法都是基于对蜂蜜和掺假蜂蜜中糖分的检测比较,只能对蜂蜜中掺入的蔗糖、高果糖浆、C4植物转化糖等成分进行检测,而且对试剂、进样样品要求较高,样品前处理步骤要求严格,仪器、设备昂贵。大米糖浆主要成分为果糖和葡萄糖,属于C3植物糖,是由大米淀粉经化学和生物方法转化后,再经过净化处理得到的,大米糖浆在糖的组成及同位素比值方面与蜂蜜极为相似。因此以上现行的国家标准和检测方法很难对其进行鉴别检测。本研究比较了大米糖浆和蜂蜜中紫外吸收物质的差异,发现了一种大米糖浆中特有的紫外吸收物质,通过高效液相色谱-紫外检测法检测该物质,能精确的检测蜂蜜中是否掺有大米糖浆。该方法具有快速、准确、灵敏等特点,并且能降低企业的检测成本,易于在蜂蜜生产企业内普及,指导其生产。
1 材料与方法
1.1材料、试剂与仪器
蜂蜜样品采自于山东华康蜂业有限公司合作社蜂场;大米糖浆购自于芜湖秦氏糖业有限公司。
甲醇、乙腈(均为色谱纯)天津市科密欧化学试剂开发中心;水为超纯水。
LC-10AVP Plus高效液相色谱仪(配有SPD-10AVP紫外检测器、DGU-20A3在线脱气机、LC-20ATXL泵、CTO-10ASVP柱温箱、手动进样器、LC-Solution数据处理软件)和SHIMADZU AUY220型分析天平日本岛津公司;
756PC紫外可见分光光度计上海舜宇恒平科学仪器有限公司。
1.2方法
1.2.1 HPLC检测波长的选择
准确称取蜂蜜以及大米糖浆0.5g,分别置于10 ml容量瓶,加去离子水定容至刻度,混匀,超声溶解30 min,3000 r/min离心5 min,然后取2 ml于石英比色皿内进行紫外光谱扫描,以水作空白对照。
1.2.2大米糖浆标准工作液的配制
准确称取适量的大米糖浆,分别用基质空白溶液配制成质量浓度为5~200mg/ml的标准工作液,以0.45μm微孔滤膜过滤后,准备HPLC分析。
1.2.3样品的制备
准确称取0.5g蜂蜜样品,置于10m l容量瓶,加去离子水定容至刻度,混匀,超声溶解30min。取1ml过预先依次用3m l甲醇、6ml水活化好的C18固相萃取柱,3mL水洗C18柱,弃去流出液。在65kPa的压力下抽干60min。然后用3ml甲醇洗脱,收集洗脱液于60℃下氮气吹干,1m l水溶解,涡旋振荡器振荡混匀1min,以0.45μm微孔滤膜过滤后,准备HPLC分析。
1.2.4色谱条件的选择
将1.2.2中大米糖浆标准液及1.2.3中蜂蜜样品以0.45μm微孔滤膜过滤后,进行HPLC分析。色谱条件如下:检测波长300nm,流速0.80m l/min,柱温30℃,进样量100μl。分别考察了Sinochrom ODS-BP柱(250mm× 4.6mm,5μm)、SHIMADZU VP-ODS C18柱(250mm× 4.6mm,5μm),以及不同的流动相对大米糖浆及蜂蜜样品中紫外吸收物质的分离情况,选择分离度较好的色谱柱和流动相作为分析HPLC流动相条件。
2 结果与分析
2.1 HPLC检测波长的选择
蜂蜜样品和大米糖浆紫外扫描图谱1所示,可以看出,蜂蜜样品和大米糖浆最大吸收均出现在220nm左右,在此波长下对大米糖浆进行检测可能会受到蜂蜜中基质的干扰。同时,大米糖浆在280nm附近也有一吸收峰,而蜂蜜则在260nm附近有一吸收峰。因此,选择300nm为检测波长,能够对大米糖浆进行检测,并且能够减少蜂蜜中基质的干扰,以后的试验也验证了300nm处检测灵敏度最高。
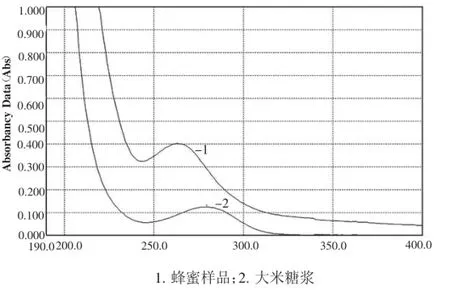
图1 大米糖浆和蜂蜜样品紫外扫描图谱
2.2样品净化条件的选择
蜂蜜基质比较复杂,对蜂蜜中大米糖浆的检测造成干扰,因此测定前需对样品进行净化处理。试验对Sep-pak C18、OASIS HLB、OASIS MCX三种固相萃取柱的萃取效率进行了比较。结果发现:在OASIS MCX柱洗脱液中没有检测到大米糖浆,OASIS HLB柱和Seppak C18柱对大米糖浆回收率分别为88.6%和86.7%。综合考虑,本方法选择Sep-pak C18柱为净化柱。
试验发现,氮气吹干过程中,在45~80℃范围内温度与吹干时间成反比,且对大米糖浆中的紫外吸收物质的回收率没有明显的影响。但是温度过高容易在氮吹仪的玻璃盖上形成水滴,综合考虑,本试验选择60℃为浓缩温度。
2.3色谱条件的选择
试验中考察了Sinochrom ODS-BP柱(250mm× 4.6mm,5μm)、SHIMADZU VP-ODS C18柱(250mm× 4.6mm,5μm)为分离色谱柱对大米糖浆中紫外吸收物质的分离效果。结果表明,大米糖浆紫外吸收物质在Sinochrom ODS-BP柱中能获得较好的分离。Sinochrom ODS-BP柱填料经过技术改良,增加了在其它C18柱上不保留或者保留较弱的极性化合物和亲水性化合物的选择性,即使在以纯水作为流动相的条件下也可以使用,进一步验证了大米糖浆中的紫外吸收物质可能为极性化合物或亲水性化合物。所以本试验选择Sinochrom ODS-BP柱为该方法的分离色谱柱。

图2 水+乙腈=95+5作为流动相时大米糖浆(A)和蜂蜜样品(B)色谱图
考虑到大米糖浆中紫外吸收物质可能为亲水性化合物,极性较强,因此最初选择水+乙腈=95+5作为流动相,对大米糖浆和蜂蜜样品进行分析,色谱图见图2。可以看出,大米糖浆在此时间之后出现两个色谱峰,保留时间分别12.48min、13.57min;蜂蜜样品在12.48min未检测到色谱峰,只有保留时间为13.57的一个色谱峰。因此,可以确定保留时间为12.48min色谱峰所代表的组份为大米糖浆特征物质。
由图2(A)可以看出,保留时间分别为12.48min、13.51min的两个色谱峰的分离度不好,影响对大米糖浆的准确定量。为改善分离度,试验增大流动相中有机相的比例,以水+乙腈=93+7作为流动相,对大米糖浆和蜂蜜样品进行分析,色谱图见图3。可以看出,该流动相对大米糖浆中两种组份有较好的分离,且峰形对称,可以满足对大米糖浆定量的要求。

图3 水+乙腈=93+7作为流动相时大米糖浆(A)和蜂蜜样品(B)色谱图
2.4线性范围与检出限
将大米糖浆用基质空白溶液稀释成系列质量浓度的标准工作液,按上述优化好的条件测定,进样量为100μL,以大米糖浆的质量浓度为横坐标、大米糖浆特征物质(RT=9.78min)的峰面积为纵坐标作线性回归。结果表明,大米糖浆在50~200mg/g范围内响应值在仪器线性范围之内,且线性关系良好。回归方程为Y= 53.2245X+7.3541,相关系数r=0.9986。
根据最终样品所代表试样的质量、定容体积、进样量等情况,以S/N>3为原则,确定本方法对大米糖浆的检出限为20 mg/g。
2.5方法的回收率与精密度
用不含大米糖浆的蜂蜜样品进行添加回收和精密度试验。蜂蜜样品中分别添加50 mg/g、100 mg/g、150 mg/g、200 mg/g的大米糖浆,充分震荡混匀,按照本方法进行净化及分析,其回收率和精密度见表1。

表1 方法加标回收率和精密度实验(%)
从表1中的回收率和精密度数据可以看出,本方法回收率全部数据在82.7~96.3%之间,室内四个水平的标准偏差≤5.5%,说明方法的回收率和精密度良好,可以满足对蜂蜜中大米糖浆掺假的检测要求。
3 讨论
本方法首先通过紫外光谱扫描获得大米糖浆中紫外吸收物质的吸收波长;然后在此波长下通过HPLC对这些紫外吸收物质进行分离,获得大米糖浆特征物质的色谱峰信息;再通过大米糖浆特征物质色谱峰对大米糖浆进行定量测定。用该方法检测蜂蜜中的大米糖浆掺假,方法准确可靠、重复性好、灵敏度高,适用于实验室日常大批量的样品检测。但是本试验仅获得大米糖浆特征物质的色谱信息,对其组成、结构等信息尚未获取,今后的试验将借助LC-MS、NMR等手段对大米糖浆特征物质的组成及结构进行分析,以期能更精确的检测蜂蜜中大米糖浆掺假。
蜂蜜是一种极易掺假的食品,仅仅通过一种或几种方法很难做到对其品质和真伪全面的判定。尤其是近几年来随着蜂蜜造假原料越来越精细化、多样化,造假技术越来越专业化,仅靠检测其中的几种指标已经远远不能满足对其品质和真伪做出判定的要求。运用包括同位素分析法、色谱法、光谱法(红外光谱分析及核磁共振分析)、电化学分析法,针对蜂蜜中某些活性成分的生物分析法(蛋白印迹法、免疫法)以及基于遗传基因的实时荧光定量PCR法等相结合,建立多元化的检测指标,这将是今后蜂蜜品质控制的发展方向。
[1]olaitan P B,adeleke O E,ola I O.Honey:a reservoir for microorganisms and an inhibitory agent for microbes[J].African Health Sciences,2007,7(3):159-165.
[2]中国国家标准化管理委员会.GB 18796—2005蜜蜂[S].北京:中国标准出版社,2005.
[3]ezz el-arab A M,girgis S M,hegazy E M,et al.Effect of dietary honey on intestinal microflora and toxicity of mycotoxins in mice[J]. BMC Complementary and Alternative Medicine,2006,6(1):6.
[4]Arvanitoyannis IS,Chalhoub C,Gotsiou P,et al.Novel quality control methods in conjunction with chemometrics(multivariate analysis)for detecting honey authenticity[J].Crit Rev Food Sci Nutr,2005, 45(3):193-203.
[5]朱青,王毕妮,梁艳,等.蜂蜜掺假检测方法的研究进展[J].中国蜂业,2008,59(10):35-37.
[6]中华人民共和国国家质量监督检验检疫总局.GB 18932.2—2002蜜蜂中高果糖淀粉糖浆测定方法薄层色谱法[S].北京:中国标准出版社,2005.
[7]黄文诚编译.差示扫描热量法(DSC)是检测蜂蜜掺假的一项新技术[M].中国蜂业,2007,58(9):33.
[8]Cordella C,Militao J,Clement M,Drajnudel P,et al.Detection and quantification of honey adulteration via direct incorporation of sugar syrups or bee-feeding:preliminary study using high-performance anion exchange chromatography with pulsed amperometric detection (HPAECPAD)and chemometrics[J].Analytica Chimica Acta,2005, 531,239-248.
[9]屠振华,籍保平,孟超英,等.近红外光谱法测定蜂蜜中主要成分的可行性研究[J].光谱学与光谱分析,2009,29(12):3291-3294. [10]J.F.Daniel Kelly,Gerard Downey,Vanessa Fouratier.Initial Study of Honey Adulteration by Sugar Solutions Using Mid-infrared (MIR)Spectroscopy and Chemometrics[J].J Agric Food Chem,2004, 52(1):33-39.
[11]Paradkar M,Irudayaraj J.Discrimination and classification of beet and cane inverts in honey by FT-Raman spectroscopy[J].J Agric Food Chem,2001,76:231-239.
[12]中华人民共和国国家质量监督检验检疫总局.GB 18932.1—2002蜜蜂中碳-4植物糖含量测定方法稳定同位素比率法[S].北京:中国标准出版社,2005.
[13]Padovana G.J,De Jongb D,Rodriguesa L P,et al.Detection of adulteration of commercial honey samples by the 13C/12C isotopic ratio[J].J Agric Food Chem,2003,82(4):633-636.
[14]Martin G.J,Martin.M L.Deuterium labeling at the natural abundance level as studied by high field quantitative 2H NMR[J].Tetrahedron Lett,1981,22(36),3525-3528.
[15]阎政礼,杨明生,李添宝,等.蜂蜜中葡萄糖、果糖、和蔗糖NMR定量分析研究[J].食品科学,2009,30(14):253-255.
[16]Arvanitoyannis I S,Chalhoub C,Gotsiou P,et al.Novel quality control methods in conjunction with chemo metrics(multivariate analysis)for detecting honey authenticity[J].Crit Rev Food Sci Nutr, 2005,45(3):193-203.
Determination of honey adulteration by addition of rice syrup using HPLC
Zhang QiAn1Yang Shaobo1Wang Kun2Ding Xiaomin2Lu Demei3
(1 Shandong Huakang Honey Products Co.,Ltd,Rizhao 276500;2.Shandong Huahan Foods Co.,Ltd, Rizhao 276826;3.Xianyang Jiankang Honey Products Co.,Ltd,Xianyang 713400)
A reversed-phase high performance liquid chromatographic method for the rapid determination of honey adulteration by addition of rice syrup.The honey sample was dissolved in water and the solution was cleaned with a C18 SPE cartridge.The cartridge was eluted with methanol.The solution was concentrated and then analyzed by HPLC. The HPLC conditions were as follows:Sinochrom ODS-BP column was used with water+acetonitrile=93+7 as the mobile phase,and detection with ultraviolet detector and ration with external standard.The results showed that the detection limit of rice syrup was 20mg/m l.Linear range was 50mg/g~200mg/g.Within its linear,ranger≥0.9986 and the recoveris were between 82.7%and 96.3%,RSD≤5.5%.This method,due to its sensitivity and reliability,has good suitability for determination of honey adulteration by addition of rice syrup.
high-performance liquid chromatographic;ultraviolet detector;honey adulteration;rice syrup
张其安(1966-),男,本科,研究方向为蜂产品加工与检测,E-mail:sdhkfy@126.com。
杨少波(1978-),男,硕士,研究方向为蜂产品加工与检测,E-mail:hkhoney@126.com。
