赤霉素对干旱胁迫下高羊茅萌发及幼苗生长的缓解效应
2016-09-01陈志飞宋书红张晓娜张莹李欣悦杨云贵
陈志飞,宋书红,张晓娜,张莹,李欣悦,杨云贵
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
赤霉素对干旱胁迫下高羊茅萌发及幼苗生长的缓解效应
陈志飞,宋书红,张晓娜,张莹,李欣悦,杨云贵*
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
为研究PEG胁迫下赤霉素浸种对高羊茅种子萌发的影响,试验选用5个赤霉素浸种处理:0,100,200,300,400 mg/L,浸种后分别在0%,5%,10%,15%,20% 5个浓度PEG胁迫下进行萌发试验,对浸种后种子的丙二醛,电导率和萌发及幼苗生长情况进行测定。结果表明:0和100 mg/L赤霉素浸种后种子的电导率显著高于(P≤0.05)其他3个浓度,丙二醛含量显著低于(P≤0.05)其他3个浓度。随着PEG浓度的升高,对种子的萌发和幼苗的抑制作用逐渐增强,当PEG浓度高于15%时,种子发芽率和根,芽长有明显下降。在5%和10%PEG胁迫时,100 mg/L赤霉素与0 mg/L浸种相比发芽势提高了47.06%、37.33%,发芽率提高了19.46%、16.95%。在5%,10%PEG胁迫时,200 mg/L赤霉素与0 mg/L浸种相比根长分别提高了53.26%、30.12%,芽长提高了79.87%、50.75%,随着PEG胁迫增大,赤霉素缓解PEG胁迫抑制根芽生长的作用逐渐减弱。另外,PEG胁迫对芽长的抑制作用比根长更强,而且经赤霉素浸种后幼苗的根冠比明显变小。综上所述,促进高羊茅种子萌发,幼苗生长和缓解干旱胁迫最适宜的赤霉素浓度为100~200 mg/L。
高羊茅;赤霉素;聚乙二醇(PEG);种子萌发;缓解效应
我国干旱半干旱地区面积占国土面积的47%,干旱一直是我国干旱与半干旱地区草坪建植的重要限制因素[1]。如今,水资源日益缺乏,草坪建植过程中和草坪蒸腾[2]需要大量用水,因此草坪的抗旱性研究具有很大的实际意义。种子在萌发过程中有一个临界水势,为种子萌发的最低水势,当外界环境水势低于这个临界水势时就产生水分胁迫[3]。研究发现,当外界的水势高于临界点时,种子萌发速率与外界水势呈正相关,且种子最终发芽率随水势的降低而降低[4-5]。
高羊茅又叫苇状羊茅(Festucaarundinacea),为禾本科羊茅属,是应用最广泛的冷季型草坪草之一。有较强的耐践踏性,抗病性强,适应性广泛等优势[6],另外高羊茅耐旱性和耐寒性较强,对土壤要求不严格,在我国的干旱,半干旱地区广泛种植[7]。
聚乙二醇(PEG)是一种干旱胁迫的渗透胁迫剂,利用PEG模拟干旱胁迫已成为种子萌发抗旱性研究的重要手段[8-9]。植物激素已经被广泛应用于草坪草的抗旱性研究。赤霉素(GA)是最常用的植物激素之一,在植物的生长发育过程中起着重要的作用,能打破种子休眠,促进发芽[10],还有促进植物细胞伸长,茎秆伸长,叶片扩展等作用[11],被广泛应用于播种前浸种处理。目前,干旱胁迫,赤霉素在禾谷类和抗旱性等植物种子萌发方面的研究已有报道,Rifat和Karmoker[12]通过对黑小麦(Triticale,Triticumaestivum)的研究证实,赤霉素可提高黑小麦种子萌发的抗盐性。杨阳等[13]的研究指出,外源赤霉素对干旱胁迫下沙冬青(Ammopiptanthusmongolicus)种子的萌发和幼苗生长具有缓解效应。而在赤霉素对干旱胁迫下草坪草种子萌发缓解效应的研究尚不多见。
本试验用PEG溶液模拟干旱胁迫,研究不同浓度赤霉素对干旱胁迫下高羊茅种子萌发及幼苗生长的缓解作用,以期了解高羊茅种子萌发的抗旱性特征和赤霉素缓解干旱胁迫的最适宜浓度。水分条件一直是限制草坪建植的重要因素,本研究不仅为合理使用植物激素缓解种子萌发干旱胁迫提供理论依据,而且对我国干旱,半干旱地区的高羊茅草坪建植有重要的参考和指导价值。
1 材料与方法
1.1试验材料
试验选用高羊茅种子,品种为猎狗五号,种子购买于2012年7月,在常温避光下保存。发芽试验于2014年11月进行。
1.2试验方法

表1 PEG浓度相对应的水势Table 1 PEG concentration corresponding to water potential
试验选用0,100,200,300,400 mg/L 5个赤霉素浓度对高羊茅种子进行浸种处理。浸种结束后分别在0%,5%,10%,15%,20% PEG-6000模拟干旱的条件下进行发芽,不同的PEG浓度对应的水势[14]如表1所示。试验采用完全随机试验设计, 共25个处理, 每个处理3个重复,以0 mg/L赤霉素浸种和0% PEG-6000处理为对照组CK。
选择成熟,饱满,健康的种子为萌发材料。试验开始前,将高羊茅种子用10%的H2O2溶液浸种20 min进行消毒[15],消毒后用蒸馏水漂洗3次。然后分别用6 mL 0,100,200,300,400 mg/L赤霉素(GA)对高羊茅种子浸种2 d,浸种结束后转移到铺有双层滤纸的培养皿中回干24 h。回干后进行电导率和丙二醛(MDA)的测定。
在培养皿中铺好双层滤纸,分别用0%(蒸馏水),5%,10%,15%,20%的PEG-6000浸透滤纸,将回干后的种子放在发芽床上,每个培养皿摆放100粒种子,放入恒温光照培养箱中发芽,培养条件为:光照14 h,温度为25℃;黑暗10 h,温度为20℃。每天称重补充散失的水分,每4 d更换1次滤纸保持渗透势稳定。
1.3试验测定指标
电导率的测定:浸种结束后,取50粒种子于试管中,每处理3个重复,加15 mL超纯水浸泡24 h,用雷磁DDS-307电导率仪测定其电导率值。
丙二醛(MDA)的测定:取50粒种子,加5%三氯乙酸(TCA)5 mL,研磨后所得匀浆在3000 r/min下离心10 min。而后取上清液2 mL,加0.67%TBA(硫代巴比妥酸) 2 mL,混合后在100℃水浴上煮沸30 min,冷却后再离心一次。分别测定上清液在450,532和600 nm处的吸光度值,并按公式C=6.45(A532-A600)-0.56A450算出MDA浓度,再换算单位鲜重的MDA含量(μmol/g)。
每天记录各培养皿的发芽状况,直到第15天发芽结束,在发芽结束后从各培养皿中随机选取10株幼苗测定根长和芽长,并计算根冠比。发芽结束后测定每个培养皿所有发芽幼苗的鲜重并记录对应的幼苗数。分别计算发芽率(%),发芽势(%),芽抑制率(%),根抑制率(%),根冠比。
发芽率=n15/M×100%
发芽势=n7/M×100%
芽抑制率=(处理芽长-对照芽长)/对照芽长×100%
根抑制率=(处理根长-对照根长)/对照根长×100%
根冠比=根长/芽长
公式中,n7,n15分别为发芽第7天和第15天的发芽种子数,M为供试种子总数(100粒)。
1.4数据统计与分析
试验数据采用Excel 2010进行统计处理和制图,采用SPSS 17.0进行方差分析,Duncan’s进行多重比较。
2 结果与分析
2.1赤霉素对不同PEG浓度下高羊茅种子萌发的影响
通过比较不同PEG胁迫下赤霉素浸种对高羊茅种子萌发的影响可知,随着PEG浓度的升高,高羊茅种子的发芽势和发芽率整体上呈下降趋势,是因为随着干旱胁迫的增加,种子萌发受到的抑制作用加重。当低浓度PEG(5%、10%)胁迫时,种子的发芽势与0% PEG处理时下降不明显,而发芽率与0%处理没有明显差异。当PEG浓度高于15%时,高羊茅的发芽势和发芽率都有明显下降(图1)。

图1 PEG胁迫处理下赤霉素对高羊茅种子发芽率和发芽势的影响Fig.1 Effect of GA and PEG on germination rate and germination energy of tall fescue PEG:聚乙二醇Polyethylene glycol;GA:赤霉素Gibberellin.图中不同字母表示差异达到显著水平(P≤0.05),下同。Different letters mean significant difference at 0.05 level. The same below.
在0%、5%和10% PEG处理时,均是100 mg/L的赤霉素浸种下高羊茅的发芽势最高,分别为62.00%、50.00%、38.00%,显著高于(P≤0.05)其他浓度,相比0 mg/L浸种(50.33%、34.00%、27.67%)分别提高了23.19%、47.06%和37.33%。在添加15%和20% PEG时,各浓度赤霉素浸种的发芽势基本上都为0,因此没有显著性差异。0% PEG处理时,赤霉素浸种处理高羊茅的发芽率和0 mg/L浸种没有显著性差异,5% PEG处理时,100 mg/L的赤霉素浸种的发芽率最高(73.67%),显著高于(P≤0.05)0 mg/L浸种(61.67%),提高了19.46%。在10% PEG处理时, 200 mg/L的赤霉素浸种的发芽率最高(69.00%),显著高于(P≤0.05)0 mg/L浸种(59.00%),提高了16.95%。15% PEG处理时,赤霉素浸种处理高羊茅的发芽率和0 mg/L没有显著性差异。在20% PEG处理时,只有200 mg/L的赤霉素浸种的高羊茅发芽率显著高于(P≤0.05)0 mg/L浸种,为0 mg/L浸种的2倍。
在干旱胁迫的情况下,适当浓度(100~200 mg/L)的赤霉素浸种可以打破种子休眠,显著提高高羊茅种子的发芽势和发芽率,加快高羊茅种子萌发和成坪速度。高浓度(300、400 mg/L)的赤霉素浸种对高羊茅种子萌发有轻微抑制作用。整体上表现为低浓度促进萌发,高浓度轻微抑制。
2.2赤霉素对不同PEG浓度下高羊茅幼苗生长的影响
随着PEG胁迫的增大,高羊茅种子的根长和芽长逐渐变小,在低浓度PEG胁迫处理下根长和芽长下降不明显,但当PEG浓度高于15%时,幼苗的根长和芽长有明显下降。表明当PEG胁迫大于15%时,干旱胁迫达到高羊茅幼苗生长的临界时,会明显抑制根芽的生长(图2和图3)。
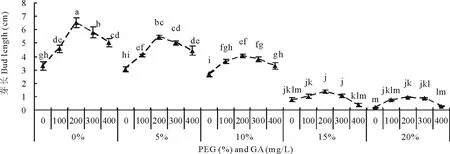
图2 赤霉素对不同浓度PEG处理下高羊茅种子芽长的影响Fig.2 Effect of GA and PEG on bud length of tall fescue

图3 赤霉素对不同浓度PEG处理下高羊茅种子根长的影响Fig.3 Effect of GA and PEG on root length of tall fescue
通过比较不同PEG胁迫下赤霉素对高羊茅芽长的影响可知,在0% PEG处理时,不同浓度赤霉素浸种的幼苗芽长之间均存在显著性差异(P≤0.05),从大到小依次为200 mg/L(6.51 cm)、300 mg/L(5.78 cm)、400 mg/L(5.04 cm)、100 mg/L(4.57 cm)、0 mg/L(3.30 cm),可知200 mg/L赤霉素浸种下的芽长比0 mg/L浸种芽长提高了97.27%。在5% PEG胁迫处理时,200 mg/L(5.45 cm)赤霉素浸种的芽长与300 mg/L浸种的没有显著性差异,但显著高于(P≤0.05)其他浓度赤霉素浸种,相比0 mg/L浸种下(3.03 cm)提高了79.87%。在10% PEG处理时,200 mg/L(4.04 cm)赤霉素浸种的芽长与100和300 mg/L的赤霉素浸种的芽长之间无显著性差异,但显著高于(P≤0.05)0 mg/L浸种和400 mg/L赤霉素浸种,相比0 mg/L浸种(2.68 cm)则提高了50.75%。在15% PEG处理时,赤霉素浸种的幼苗芽长与0 mg/L浸种没有显著性差异。在20% PEG处理时,最终的萌发种子较少,芽长测定结果误差较大,但也是在200 mg/L的赤霉素浸种的幼苗芽长最大(图2)。
通过比较不同PEG胁迫下赤霉素对高羊茅根长的影响可知,在0%、5%和10% PEG胁迫处理时,均是200和300 mg/L的赤霉素浸种的幼苗根长显著高于(P≤0.05)0 mg/L浸种。但在100和400 mg/L的赤霉素浸种时,幼苗根长与0 mg/L浸种没有显著性差异。在0% PEG处理时,200 mg/L的赤霉素浸种的幼苗根长最长,为6.33 cm,相比0 mg/L浸种(4.19 cm)提高了51.07%。在5% PEG胁迫处理时,300 mg/L的赤霉素浸种的幼苗根长最长(5.50 cm),相比0 mg/L浸种(3.53 cm)提高了55.81%。在10% PEG胁迫处理时,200 mg/L的赤霉素浸种的幼苗根长最长(4.19 cm),相比0 mg/L浸种(3.22 cm)提高了30.12%。而在15% PEG胁迫时赤霉素浸种的幼苗根长与0 mg/L浸种没有显著性差异。同样的在20% PEG处理时测定结果误差较大,但也是在200 mg/L的赤霉素浸种的幼苗根长最大(图3)。
在PEG浓度为0%、5%、10%时,200 mg/L赤霉素浸种与0 mg/L浸种相比根长提高了51.07%、53.26%、30.12%,芽长提高了97.27%、79.87%、50.75%,在15% PEG处理时,赤霉素浸种的幼苗根长和芽长与0 mg/L浸种均没有显著性差异。表明随着PEG胁迫的增大,赤霉素浸种缓解PEG胁迫对根,芽长抑制的作用逐渐减弱。
通过上述分析发现PEG胁迫对根长和芽长的抑制作用并不一样,因此通过分析各处理下根冠比的变化可进一步反映出根长和芽长的变化规律,当PEG胁迫浓度小于10%时,干旱胁迫下赤霉素浸种对高羊茅根冠比没有显著性影响。而当PEG浓度大于15%时, 0 mg/L浸种的根冠比显著高于(P≤0.05)低浓度PEG胁迫,而且赤霉素浸种下幼苗的根冠比显著低于(P≤0.05)0 mg/L浸种,由此可知,PEG胁迫对芽长的抑制作用比根长更强,幼苗在干旱胁迫下通过增加根长来扩大根系以获取更多的水分,而且在高浓度PEG胁迫下,经赤霉素浸种后幼苗的根冠比变小(图4)。

图4 赤霉素对不同浓度PEG处理下高羊茅根冠比的影响Fig.4 Effect of GA and PEG on root-bud ratio of tall fescue
2.3赤霉素对不同PEG浓度下高羊茅幼苗抑制率的影响
通过分析根抑制率和芽抑制率的变化规律,可以进一步了解在PEG胁迫下赤霉素对幼苗根芽抑制的缓解作用,对于芽抑制率来说,在0%、5%和10% PEG胁迫处理时芽抑制率为负值,在低浓度PEG胁迫下相比对照表现为赤霉素促进芽的生长。在0% PEG处理时,除了100和400 mg/L,不同浓度赤霉素浸种下的芽抑制率均存在显著性差异(P≤0.05),从小到大依次为200 mg/L、300 mg/L、400 mg/L、100 mg/L、0 mg/L。在5% PEG胁迫处理时,200和300 mg/L赤霉素浸种下的芽抑制率显著低于(P≤0.05)其他浓度。在10% PEG胁迫处理时,100、200和300 mg/L赤霉素浸种下的芽抑制率没有显著性差异,但都显著低于(P≤0.05)0 mg/L浸种处理。在15%、20% PEG胁迫下芽抑制率有明显升高,均是200 mg/L赤霉素浸种下的芽抑制率显著低于(P≤0.05)0和400 mg/L浸种(图5)。
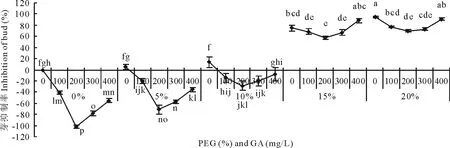
图5 赤霉素对不同浓度PEG处理下高羊茅芽抑制的缓解作用Fig.5 Effect of GA and PEG on inhibition of tall fescue bud
而对于根抑制率来说,在0%和5% PEG胁迫处理时根抑制率为负值,在0%、10% PEG下相比对照表现为赤霉素促进根的生长。且都是200和300 mg/L赤霉素浸种下高羊茅的根抑制率显著低于(P≤0.05)其他浓度。在10% PEG胁迫处理时,只有200 mg/L赤霉素浸种显著低于(P≤0.05)0 mg/L浸种。在15%、20% PEG胁迫下芽抑制率相比低浓度PEG胁迫有明显升高,但不同浓度赤霉素浸种没有显著性差异(图6)。表明200和300 mg/L赤霉素浸种处理可以明显缓解PEG胁迫对根,芽的抑制,而且在高浓度PEG下赤霉素浸种缓解干旱胁迫的作用不明显。

图6 赤霉素对不同浓度PEG处理下高羊茅根抑制的缓解作用Fig.6 Effect of GA and PEG on inhibition of tall fescue root
2.4赤霉素对不同PEG浓度下各发芽指标影响的均方和主效应分析
由均方可看出赤霉素和PEG对发芽率和发芽势的影响均极显著(P≤0.01),而赤霉素和PEG交互只对发芽率影响极显著(P≤0.01),而对发芽势没有显著性影响。进一步主效应分析可知,随着PEG浓度的升高,发芽率和发芽势逐渐降低,且各浓度之间均存在显著性差异。在0% PEG时,发芽率和发芽势分别高达70.27%和54.93%,而在20% PEG胁迫处理时,发芽率仅为15.27%,发芽势为0%。100 mg/L赤霉素浸种下高羊茅的发芽率(52.60%)和发芽势(28.31%)均最高,且显著高于其他浓度(P≤0.05)(表2)。
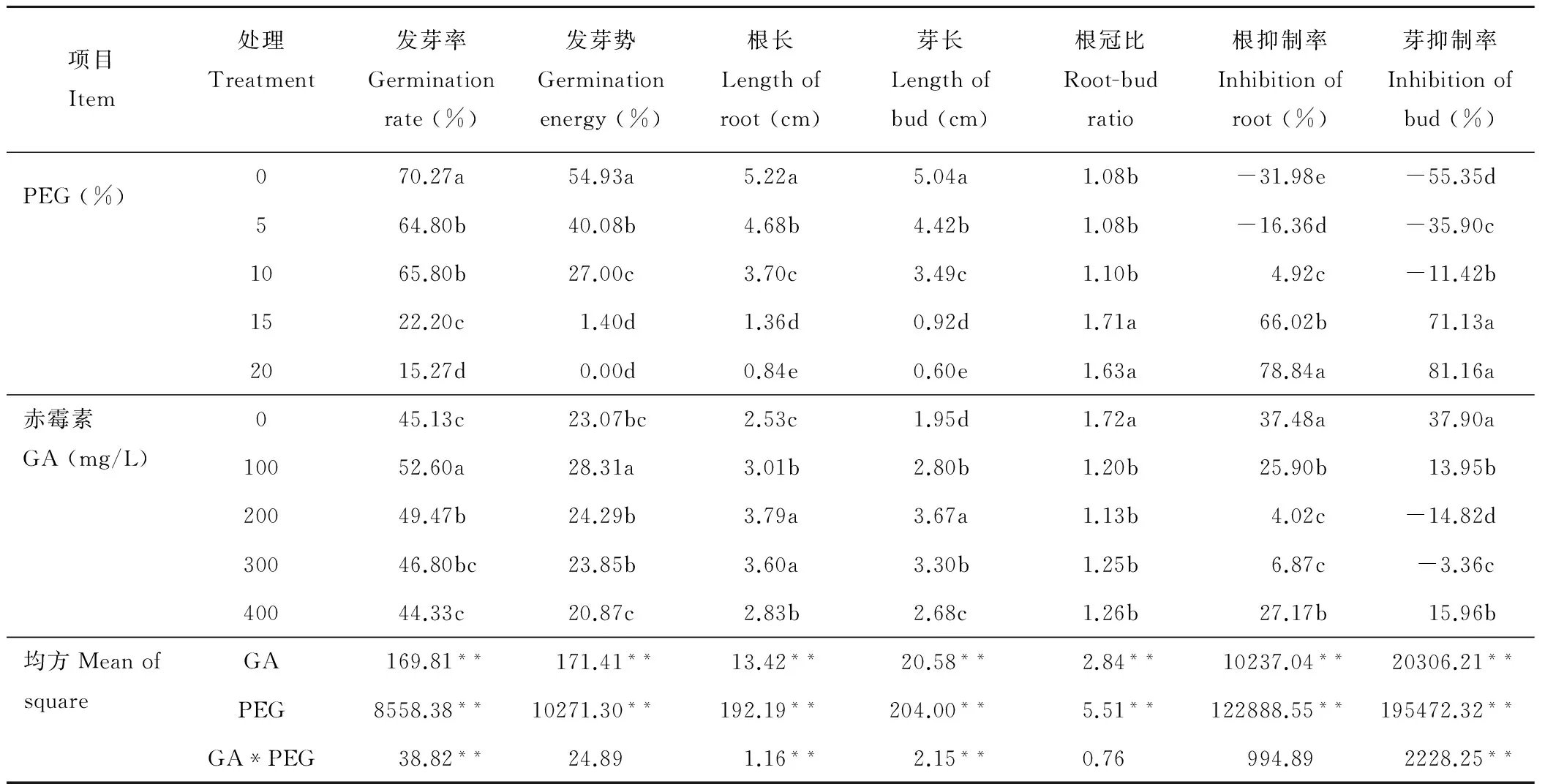
表2 各发芽指标的均方和主效应分析结果Table 2 Mean of square and main effect for germination characteristics
注:*:P≤0.05,**:P≤0.01。同列数据后标注不同小写字母表示差异显著(P≤0.05)。
Note: *:P≤0.05, **:P≤0.01. Different letters in the same column mean significant difference atP≤0.05.
赤霉素,PEG和两者的交互作用对根长,芽长和根冠比的影响均达到了极显著水平(P≤0.01)。主效应分析表明根长和芽长随着PEG浓度的升高呈逐渐下降趋势,且各浓度之间均存在显著性差异。根长依次为5.22、4.68、3.70、1.36、0.84 cm,芽长依次为5.04、4.42、3.49、0.92、0.60 cm。在200 mg/L下赤霉素浸种高羊茅的根长(3.79 cm)和芽长(3.67 cm)最高,都显著高于(P≤0.05)其他浓度。而根冠比随着PEG浓度的升高逐渐升高,而且各浓度之间同样存在显著性差异,表明PEG胁迫对芽长的抑制作用比根长更强。200 mg/L下赤霉素浸种高羊茅的根冠比显著小于(P≤0.05)其他浓度。
根抑制率和芽抑制率能更加清晰地反映PEG对根,芽抑制的缓解作用。随着PEG浓度的升高,根抑制率和芽抑制率逐渐升高,并且各浓度之间都存在着显著性差异(P≤1.05)。从赤霉素缓解根,芽抑制率的效应来看,同样是200mg/L赤霉素浸种下的根,芽抑制率显著低于(P≤0.05)其他浓度。

图7 不同浓度赤霉素浸种处理对高羊茅种子电导率和丙二醛的影响Fig.7 Effect of different concentration of gibberellin on conductivity and malondialdehyde of tall fescue
2.5赤霉素浸种对高羊茅种子电导率和丙二醛的影响
通过测定赤霉素浸种后种子的电导率和丙二醛含量可进一步解释赤霉素打破种子休眠时的内部变化,随着赤霉素浓度的增加,高羊茅种子浸出液的电导率逐渐降低,0和100 mg/L赤霉素浸种的电导率显著高于(P≤0.05)300和 400 mg/L,而200、300和400 mg/L赤霉素浸种下电导率没有显著性差异(图7)。电导率可作为判断种子细胞膜完整性和种子活力的依据,赤霉素浸种下种子浸出液电导率明显下降,表明赤霉素对细胞膜有一定的修复作用,并且浓度越高,修复能力越强。
种子丙二醛含量随着赤霉素浓度的增加呈逐渐升高趋势,0 mg/L赤霉素浸种处理后种子丙二醛的含量显著低于(P≤0.05)赤霉素浸种处理。100 mg/L赤霉素浸种的丙二醛含量显著低于(P≤0.05)其他3个浓度,而200、300和400 mg/L赤霉素浸种下种子丙二醛含量没有显著性差异。丙二醛作为抵抗逆境胁迫的产物之一,赤霉素浸种后丙二醛含量升高,说明赤霉素打破种子休眠,种子内部新陈代谢剧烈,产生大量代谢物。
3 讨论
依据植物激素调节休眠理论可知[16],种子休眠和萌发主要取决于种子各激素的存在状况和相对含量[17]。赤霉素在促进种子萌发和幼苗生长等方面的应用和研究已经非常广泛。PEG已经广泛应用于种子的抗旱性研究,但不同植物种子萌发的抵抗PEG胁迫的差异较大[18-20]。本试验通过对赤霉素和PEG胁迫对高羊茅种子萌发影响的研究,得出高羊茅种子在PEG胁迫下的萌发规律和赤霉素浸种在打破高羊茅种子休眠和缓解干旱胁迫上的作用规律。
3.1赤霉素浸种对干旱胁迫下高羊茅种子萌发的影响
赤霉素可以打破种子休眠,这是因为赤霉素可诱导α-淀粉酶,蛋白酶等水解酶的合成,催化种子内营养物质的分别和转化,为胚的萌发提供物质和能量保障[21]。本试验用赤霉素浸种后的种子,不同PEG胁迫下均是100~200 mg/L赤霉素处理下的发芽势和发芽率最高,但当赤霉素浓度高于200 mg/L时,对种子的萌发均有不同程度的抑制,整体表现为低浓度促进萌发,高浓度轻微抑制。试验结果与杨阳等[13]、邱鹏飞等[22]的研究相一致,但促进不同植物种子的萌发所需的赤霉素浓度不同。
3.2赤霉素浸种对干旱胁迫下高羊茅幼苗生长的影响
赤霉素还能刺激茎的节间伸长,但节间数不改变,节间长度的增加是由于细胞伸长和细胞分裂的结果,不同植物对赤霉素的反应差异较大[23-27]。本试验结果表明,赤霉素可以明显缓解干旱胁迫对幼苗根芽长的影响,而且从0% PEG胁迫到15% PEG胁迫,赤霉素浸种缓解PEG胁迫对根,芽长抑制的作用逐渐减弱。但在20%PEG胁迫时,赤霉素的缓解作用增强,这是由于在测定根长和芽长时是随机选择10株进行测量,而在20% PEG胁迫处理时最终的萌发种子较少,测定的根长和芽长误差较大的缘故。另外,随干旱胁迫程度的加重,幼苗的根冠比明显升高,胚芽受抑制程度比胚根重, 植物吸收水分优先供给胚根,从而利于幼苗的成活和生长,以适应外界干旱条件[28]。这是植物水分缺乏时适应环境的一种表现。孙艳茹等[29]对PEG模拟干旱胁迫下8种绿肥作物萌发特性的研究发现,随着胁迫程度的加剧,8种绿肥作物种子的发芽率,胚根长,胚芽长不断下降,而胚根/胚芽却持续上升。刘彩红和李成云[30]通过研究100~700 μg/g的GA3对吉生羊草(Leymuschinensis)和野生羊草幼苗生长的影响,得出随着GA3质量分数的增加,其根冠比逐渐减小。
3.3赤霉素浸种对高羊茅种子电导率和丙二醛的影响
种子浸出液的电导率是判断种子活力的一个重要指标[31],种子在贮存过程中会发生一定的劣变,使细胞膜结构和功能的完整性受到破坏,进而使细胞膜的透性增加,细胞的电解质会向外渗,使得周围溶液的电导率增加[22],适量的赤霉素可以提高种子的活力[32]。本试验中随着赤霉素浓度的增加,高羊茅种子浸出液的电导率逐渐降低,在200 mg/L赤霉素浸种液电导率达到最低,与400 mg/L没有显著性差异。赤霉素对种子细胞膜有一定的修复作用,并且在研究的浓度范围内随着赤霉素浓度增加其对细胞膜的修复能力增强。邱鹏飞[33]研究赤霉素浸种对沙冬青,花棒(Hedysarumscoparium),柠条(Caraganakorshinskii)种子萌发的影响得出,随着赤霉素浓度增加,浸种液的电导率降低。高春智等[34]通过研究赤霉素浸种对樟子松(Pinussylvestrisvar.mongholica)种子萌发的影响得出,随着赤霉素浓度的增加,浸出液的电导率也明显降低,而且贮藏时间短种子的电导率小于贮藏时间长的电导率。
丙二醛(MDA)是抵抗逆境胁迫的主要产物之一。本实验研究发现,种子浸出液的丙二醛含量随着赤霉素浓度的升高而逐渐升高,高春智等[34]的研究也已表明这一结果。这是因为赤霉素在打破种子休眠的过程中,种子内部活动剧烈,产生了大量的无用代谢物,使种子受到的伤害比较高,丙二醛含量增加。
本文仅从种子的萌发和幼苗生长形态方面反映了赤霉素对高羊茅抗旱性的作用,为全面的了解和研究赤霉素对高羊茅萌发抗旱性的内部机理,尚需在赤霉素打破种子休眠以及缓解干旱胁迫的基因表达和生理生化机制等方面有进一步的探索和研究。
4 结论
1)随着PEG浓度的升高,种子的发芽率,发芽势,根长和芽长均呈逐渐下降趋势,当PEG浓度低于10%时,相比对照没有明显下降,而当PEG浓度高于15%时,种子发芽率,发芽势和根芽长有明显下降,20% PEG胁迫下发芽率仅为15.27%。
2)在5%和10% PEG胁迫时,100 mg/L赤霉素浸种与0 mg/L浸种相比发芽率提高了19.46%和16.95%,在5%、10% PEG胁迫时,200 mg/L赤霉素浸种下幼苗的根长和芽长最大,与0 mg/L浸种相比根长分别提高了53.26%、30.12%,芽长提高了79.87%、50.75%,表明适当浓度赤霉素可以明显缓解PEG胁迫对萌发和根芽的抑制,而且随着PEG胁迫增大,赤霉素浸种缓解PEG胁迫抑制的作用逐渐减弱。PEG胁迫对芽长的抑制作用比根长更强,而且经赤霉素浸种后幼苗的根冠比明显变小。
3)0和100 mg/L赤霉素浸种后高羊茅种子的电导率显著高于(P≤0.05)其他3个浓度,丙二醛含量显著低于(P≤0.05)其他3个浓度。而200、300和400 mg/L赤霉素浸种下电导率和丙二醛含量没有显著性差异。
综上所述,赤霉素对PEG胁迫抑制高羊茅种子萌发和幼苗生长有着不同程度的缓解,结果表明促进高羊茅种子萌发,幼苗生长和缓解干旱胁迫最适宜的赤霉素浓度为100~200 mg/L。
References:
[1]Gao N, Gao H Y, Shi D S,etal. Evaluation method of drought resistance for 16 varieties cold season turf grasses. Journal of Xinjiang Agricultural University, 1995, 1: 68-72.
[2]Han J G, Pan Q S, Wang P. A study on the evapotranspiration and drought resistance of turfgrass species. Acta Prataculturae Sinica, 2001, (4): 56-63.
[3]Li T S, Wang J, Hu X W. Response of four Vicia species seed germination to water stress. Pratacultural Science, 2013, 8: 1200-1207.
[4]Yang J N, Wang Y R. Effect of drought stress simulated by PEG on seed germination of four desert plant species. Acta Prataculturae Sinica, 2012, (6): 23-29.
[5]Zhu J J, Li Z H, Kang H Z,etal. Effects of polyethylene glycol (PEG)-simulated drought stress onPinussylvestrisvar.mongolicaseed germination on sandy land. Chinese Journal of Applied Ecology, 2005, 5: 801-804.
[6]Han L B, Yang B, Deng J F. Turfgrass Varieties[M]. Beijing: China Forestry Publishing House, 1999: 186-187.
[7]Zhou F. Effect of different treatment on four tall fescue varieties seed germination. Southwest Horticulture, 2006, 2: 25-26.
[8]Liang G L, Zhou Q P, Yan H B. Effect of polyethylene glycol (PEG) on seed germination characteristics of four species ofFestuca. Pratacultural Science, 2007, 6: 50-54.
[9]Wu C H, Wang Q Z, Xie B,etal. Effects of drought and salt stress on seed germination of three leguminous species. African Journal of Biotechnology, 2011, 10(78): 17954-17961.
[10]Duan C R, Wang B C, Liu W Q,etal. Effect of chemical and physical factors to improve the germination rate of Echinacea Angustifolia seeds. Colloids and Surfaces B: Biointerfacea, 2004, 37: 101-105.
[11]Li B Z, Zhao X, An G Y. Recent advances in research of gibberellin. Chinese Agricultural Science Bulletin, 2011, 1: 1-5.
[12]Rifat S, Karmoker J. Effects of gibberellin acid and Kn on seed germination and accumulation of Na+and K+in the seedling of triticale under salinity stress. Bangladesh Journal of Botany, 2012,41(2): 123-129.
[13]Yang Y, Liu B R, Jia Q M,etal. Effect of drought stress on seed germination ofAmmopiptanthusmongolicuswith gibberellin. Jiangsu Agricultural Sciences, 2014, 5: 271-275.
[14]Michel B E, Kaufmann M R. The osmotic potential of polyethylene glycol 6000. Plant Physiology, 1973, 51: 914-916.
[15]Yang Y G, Wang H J, Yang X J,etal. Effects of disinfection treatments on the seeds germination of tall fescue (Festucaarundinacea). Acta Agrestia Sinica, 2014, 2: 380-385.
[16]Fu J R. Seed Physiology[M]. Beijing: Science Press, 1985.
[17]Khan A A. The Physiology and Biochemistry of Seed Development Dormancy and Germination[M]. New York, U. S. A: Elsevier Biomedical Press, 1982.
[18]Yang J P, Chen X Z, Wang W P. The establishment of the simulated system of drought for soybean in laboratory. Chinese Agricultural Science Bulletin, 2003, 19(3): 65-68.
[19]Wang H Z, Ma J, Li X Y,etal. Study on drought resistance and screening of the drought resistance assessment indexes at germinating stage of rice. Southwest China Journal of Agricultural Sciences, 2004, 5: 594-599.
[20]Mahdiyeh G, Majid R, Bahman K. Effect of drought stress induced by polyethylene glycol on seed germination of four wild almond species. Australian Journal of Basic and Applied Sciences, 2010, 4(5): 785-791.
[21]Jian Z Y, Lu J L, Jiang R J. Effect of temperature on the induction of α-Amylase by gibberellin acid. Plant Physiology Communications, 1989, 5: 44-46, 80.
[22]Qiu P F, He Y H, Tian Y L. Effect of gibberellin on the seed germination ofAmmopiptanthusmongolicus(Maxim.)Cheng f. Modern Agricultural Sciences and Technology, 2010, 3: 221-222,225.
[23]Cui S. Effect of Gibberellin (GA3) on the Growth and Biomass ofLeymus[D]. Changchun: Northeast Normal University, 2004.
[24]Zeng Y J, Zhou S L. Influences of phytohormone on germination ofAlpiniazerumbet(Pers.) Burtt. et Smith. Journal of Anhui Agricultural Sciences, 2009, 26: 12485-12486.
[25]Yan F, Zhang C M, Wang Q L,etal. Effects of GA3and 6-BA on seeds germination and physiological characteristics ofSophoraalopecuroidesL. Chinese Wild Plant Resources, 2012, 6: 28-31.
[26]Ren Y Q, Guan K Y. Effects of moist-chilling and GA3applications on seed germination of three Pedicularis species from Yunnan, China. Seed Science and Technology, 2008, 36: 225-229.
[27]Yu J, Zhou F, Xu R,etal. Effects of GA on seed germination of Cistanche. China Seed Industry, 2010, 10: 59-61.
[28]Hu X Y, Hu T M, Li H X. Comparison of drought resistance ofDichondrarepensandZoysiajaponicaat emergence stage. Pratacultural Science, 2006, (1): 89-92.
[29]Sun Y R, Shi Q, Chen G J,etal. Evaluation of the germination characteristics and drought resistance of green manure crops under PEG stress. Acta Prataculturae Sinica, 2015, (3): 89-98.
[30]Liu C H, Li C Y. Effect of soaking time and GA3concentration on germination and growth ofLeymuschinenseseeds. Pratacultural Science, 2011, (5): 797-801.
[31]Wang H J, Chen Z F, Zhang Y,etal. Influence of soaking times and agent on the seeds germination ofPoapratensis. Pratacultural Science, 2014, (11): 2095-2104.
[32]Li Q X, Li K, Ding W L,etal. Effect of different treatments on seed germination ofKobresiabellardii. Pratacultural Science, 2009, (8): 112-117.
[33]Qiu P F. The Seed Germinate ofAmmopiptanthusmongolicus(Maxim.),HedysarumscopariumandCaraganakorshinskiiKom Dealed with Gibberellin[D]. Hohhot: Inner Mongolia Agricultural University, 2010.
[34]Gao C Z, He Y H, Tian Y L,etal. Effect of different concentration of gibberellin on the seed germination ofPinussylvestrisvar.mongolicaLitv. Journal of Inner Mongolia Agricultural University (Natural Science Edition), 2012, 3: 67-72.
[1]高宁, 高辉远, 石定燧, 等. 16种(品种)寒地型草坪草抗旱性及评定方法初探. 八一农学院学报, 1995, 1: 68-72.
[2]韩建国, 潘全山, 王培. 不同草种草坪蒸散量及各草种抗旱性的研究. 草业学报, 2001, (4): 56-63.
[3]李廷山, 王娟, 胡小文. 4种野豌豆种子萌发对水分胁迫的响应. 草业科学, 2013, (8): 1200-1207.
[4]杨景宁, 王彦荣. PEG模拟干旱胁迫对四种荒漠植物种子萌发的影响. 草业学报, 2012, (6): 23-29.
[5]朱教君, 李智辉, 康宏樟, 等. 聚乙二醇模拟水分胁迫对沙地樟子松种子萌发影响研究. 应用生态学报, 2005, 5: 801-804.
[6]韩烈保, 杨碚, 邓菊芬. 草坪草种及其品种[M]. 北京: 中国林业出版社, 1999: 186-187.
[7]邹芬. 不同处理对四个高羊茅品种种子发芽的影响. 西南园艺, 2006, 2: 25-26.
[8]梁国玲, 周青平, 颜红波. 聚乙二醇对羊茅属4种植物种子萌发特性的影响研究. 草业科学, 2007, 6: 50-54.
[11]李保珠, 赵翔, 安国勇. 赤霉素的研究进展. 中国农学通报, 2011, 1: 1-5.
[13]杨阳, 刘秉儒, 贾倩民, 等. 赤霉素对干旱胁迫下沙冬青种子萌发的影响. 江苏农业科学, 2014, 5: 271-275.
[15]杨云贵, 王红俊, 杨雪娇, 等. 消毒处理对高羊茅种子发芽的影响. 草地学报, 2014, 2: 380-385.
[16]傅家瑞. 种子生理[M]. 北京: 科学出版社, 1985.
[18]杨剑平, 陈学珍, 王文平. 大豆实验室PEG6000模拟干旱体系的建立. 中国农学通报, 2003, 19(3): 65-68.
[19]王贺正, 马均, 李旭毅, 等. 水稻种质芽期抗旱性和抗旱性鉴定指标的筛选研究. 西南农业学报, 2004, 5: 594-599.
[21]简志英, 陆嘉陵, 蒋瑞君. 温度对赤霉素诱导α-淀粉酶的影响. 植物生理学通讯, 1989, 5: 44-46, 80.
[22]邱鹏飞, 何炎红, 田有亮. 赤霉素浸种对沙冬青种子萌发的影响. 现代农业科技, 2010, 3: 221-222, 225.
[23]崔爽. 外源赤霉素(GA3)对羊草生长发育及生物量的影响[D]. 长春: 东北师范大学, 2004.
[24]曾亚军, 周仕林. 植物激素对艳山姜种子发芽的影响. 安徽农业科学, 2009, 26: 12485-12486.
[25]闫芳, 张春梅, 王勤礼, 等. 赤霉素和6-BA对苦豆子种子萌发生理特性的影响. 中国野生植物资源, 2012, 6: 28-31.
[27]于晶, 周峰, 徐荣, 等. 赤霉素对肉苁蓉种子萌发的影响研究. 中国种业, 2010, 10: 59-61.
[28]胡晓艳, 呼天明, 李红星. 草坪草马蹄金与结缕草种子萌发期抗旱性比较. 草业科学, 2006, (1): 89-92.
[29]孙艳茹, 石屹, 陈国军, 等. PEG模拟干旱胁迫下8种绿肥作物萌发特性与抗旱性评价. 草业学报, 2015, (3): 89-98.
[30]刘彩红, 李成云. GA3浸种对羊草种子发芽和幼苗生长的影响. 草业科学, 2011, (5): 797-801.
[31]王红俊, 陈志飞, 张莹, 等. 浸种时间和浸种剂对草地早熟禾种子发芽的影响. 草业科学, 2014, (11): 2095-2104.
[32]李巧峡, 李凯, 丁文龙, 等. 不同处理对北方嵩草种子萌发的影响. 草业科学, 2009, (8): 112-117.
[33]邱鹏飞. 赤霉素浸种对沙冬青,花棒,柠条种子萌发的影响[D]. 呼和浩特: 内蒙古农业大学, 2010.
[34]高春智, 何炎红, 田有亮, 等. 不同浓度赤霉素浸种对樟子松种子萌发的影响. 内蒙古农业大学学报(自然科学版), 2012, 3: 67-72.
*Effects of gibberellin on seed germination and seedling growth of tall fescue under drought stress
CHEN Zhi-Fei, SONG Shu-Hong, ZHANG Xiao-Na, ZHANG Ying, LI Xin-Yue, YANG Yun-Gui*
CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling712100,China
This study investigated the effects of gibberellin concentrations on seed germination and seedling growth of tall fescue (Festucaarundinacea) under drought stress. The seed germination experiment was conducted at 5 polyethylene glycol (PEG) levels (0%, 5%, 10%, 15% and 20%) after soaking seeds in 5 gibberellin concentrations (0,100, 200, 300 and 400 mg/L). The malondialdehyde concentration (MDA) and electrical conductivity of seeds were determined before germination, then the seedling growth, seed germination rate and potential were measured during germination. The electrical conductivities of seeds soaked in 0 and 100 mg/L gibberellin were significantly (P≤0.05) higher than those of seeds soaked at the other three gibberellin concentrations, and MDA concentrations of seeds soaked with 0 and 100 mg/L gibberellin solution were significantly lower (P≤0.05) than those of seeds soaked at the three higher gibberellin concentrations. Compared to seeds soaked in pure water, the 5% and 10% PEG treatments had, respectively, 47.06% and 37.33% greater germination potential, and 19.46% and 16.95% higher germination rate. However, the germination rate, and root and bud length were obviously decreased when the PEG concentration was 15% or higher. After soaking in 200 mg/L gibberellin solution, root length was increased 53.26%, 30.12% (compared with soaking in pure water) and the corresponding increases in bud length were 79.87% and 50.75% at 5% and 10% PEG solutions. The effect of gibberellin decreased with increase in PEG level. The inhibition of PEG stress on bud length was stronger than on root length, but the root length: bud length ratio was obviously decreased water after gibberellin treatment, compared to that of seeds soaked in pure. In summary, the optimum gibberellin concentration for enhancing the seed germination and seedling growth of tall fescue under drought stress was 100-200 mg/L. Key words: tall fescue; gibberellin; PEG; seed germination; alleviating action
10.11686/cyxb2015409
http://cyxb.lzu.edu.cn
2015-09-26;改回日期:2015-10-21
国家牧草产业技术体系“优质牧草产品标准化生产关键技术”(CASR-35-01A)和国家燕麦产业技术体系“燕麦加工利用”(CARS-08-D1)资助。
陈志飞(1987-),男,山西运城人,在读硕士。E-mail:995846656@qq.com
Corresponding author. E-mail:yungui999@163.com
陈志飞,宋书红,张晓娜,张莹,李欣悦,杨云贵. 赤霉素对干旱胁迫下高羊茅萌发及幼苗生长的缓解效应. 草业学报, 2016, 25(6): 51-61.
CHEN Zhi-Fei, SONG Shu-Hong, ZHANG Xiao-Na, ZHANG Ying, LI Xin-Yue, YANG Yun-Gui. Effects of gibberellin on seed germination and seedling growth of tall fescue under drought stress. Acta Prataculturae Sinica, 2016, 25(6): 51-61.
