抗CD71单抗与蓖麻毒蛋白A链免疫毒素的制备及其体外抗肝癌细胞效应的研究
2016-09-01申苏建郑波蔡振寨徐昌隆薛战雄
申苏建,郑波,蔡振寨,徐昌隆,薛战雄
·论著·
抗CD71单抗与蓖麻毒蛋白A链免疫毒素的制备及其体外抗肝癌细胞效应的研究
申苏建,郑波,蔡振寨,徐昌隆,薛战雄
目的因抗CD71单抗具有靶向定位特性,及利用蓖麻毒蛋白A链(RTA)的细胞毒性,将两者进行偶联,构建免疫毒素CD71 Mab-RTA,并研究其体外抗肝癌细胞效应。方法从蓖麻籽中提纯RTA,以N-琥珀酰胺-3(-2-吡啶二硫)丙酸酯[N-succinimidyl-3(-2-pyridyldithio)-propionate,SPDP]作为偶联剂,偶联抗CD71单抗,构建免疫毒素(IT),以SDS-PAGE检测IT,以间接ELISA方法测定IT的免疫反应性,以WST-1法测定IT的体外抗肝癌细胞效应。结果蓖麻籽经过研磨、过滤、亲和层析、凝胶层析、离子交换层析等步骤成功提纯RTA。提纯的RTA与CD71mab进行偶联,成功构建免疫毒素CD71 Mab-RTA,SDS-PAGE结果显示,在非还原状态下,为一条分子量>116 kD的单一电泳条带,在还原状态下,为三条电泳条带,分别位于约55 kD处、约32 kD处及约28 kD处。间接ELISA结果显示,免疫毒素与单抗的曲线走势一致,但各浓度下OD值均较单抗组略低。WST-1结果显示,IT在各浓度梯度下均表现出对HepG2细胞和LO2细胞不同的杀伤作用(<0.05)。结论CD71 mab-RTA基本保留了免疫反应性,及表现出对HepG2细胞和LO2细胞的不同体外细胞毒效应,提示对肝癌细胞具有较好的靶向细胞毒作用,有望成为新型的抗肝癌药物。
肝肿瘤;癌;免疫毒素;蓖麻毒蛋白;CD71
[Modern FracicalMedicine, 2016,28(7):847-850]
1 资料与方法
1.1仪器、试剂与细胞株蓖麻籽(浙江可得丰种业有限公司);UV-2800型紫外可见分光光度计(尤尼柯仪器有限公司);SPDP(sigma公司);sepharose 4B、sephadex G-100、DEAE-Sephadex A-50、CM-sephadex C-50、sephadex G-25、sephadex G-150、Blue-sepharose CL-6B(Amershan Bioscience公司);D-半乳糖、DTT、-巯基乙醇(西安沃尔森生物技术有限公司);胎牛血清(杭州四季青生物工程材料有限公司);HRP标记的羊抗小鼠IgG,DAB显色试剂盒(北京索莱宝科技有限公司);HepG2细胞株、LO2细胞株(广州市齐云生物技术有限公司);CD71 mab (ancell公司);WST-1试剂盒(上海碧云天生物技术有限公司);其他试剂均为市售分析纯。
1.2方法
1.2.1蓖麻毒蛋白的提取将80g去壳研碎的蓖麻籽在0.01mol/L,pH7.2的磷酸缓冲液中浸提24h后进行过滤。将所得滤液以硫酸铵(80%)进行盐析,离心,弃上清,留沉淀。将沉淀溶于同样浓度、pH值的磷酸缓冲液中透析24h,离心,上清液即为蓖麻毒蛋白粗提液。将上述粗提液上酸化后的 sepharose 4B柱,用含0~0.2 mol/L D-半乳糖的磷酸缓冲液进行梯度洗脱,得到凝集素和蓖麻毒蛋白的混合液。再将此混合液上SephadexG-100柱以上述磷酸缓冲液洗脱,得到蓖麻毒蛋白。
1.2.2蓖麻毒蛋白A的提纯将上述提纯的蓖麻毒蛋白上sepharose4B柱,以含 -巯基乙醇的Tris-HCl缓冲液进行洗脱,获得RTA粗品。将获得的RTA粗品以0.1 mol/L,pH8.5的Tris-HCl缓冲液透析过夜,上DEAE-Sephadex A-50柱进行洗脱,将得到洗脱蛋白峰液经过超滤浓缩后以0.005mol/L,pH6.5的磷酸缓冲液透析过夜,然后上CM-sephadexC-50柱,以0~0.4 mol/L的NaCl溶液进行梯度洗脱,即可获得RTA纯品。
1.2.3免疫毒素的制备及检测
1.2.3.1免疫毒素的制备将CD71 mab与溶于乙醇的SPDP(20 mol/L)进行混合反应30 min后,上sephadexG-25柱进行洗脱,除去游离的SPDP,得到单抗-PDP。在单抗-PDP溶液中加入还原剂二硫苏糖醇(DTT),反应20 min后再上sephadex G-25柱,除去游离的DTT,得到单抗-PDP-SH。在提纯的RTA中加入DTT,上sephadex G-25柱,洗脱除去多余的DTT,得到RTA-SH。将单抗-PDP-SH和过量RTASH混合反应16 h,离心,取上清,过sephadex G-150柱进行洗脱,提取IT粗品。将获得IT粗品上Bluesepharose CL-6B柱进行洗脱,提纯IT。
1.2.3.2以SDS-PAGE检测IT的偶联以分离胶浓度为12%,浓缩胶浓度为5%,分别将IT进行还原性(样品缓冲液加 -巯基乙醇)和非还原性(样品缓冲液未加 -巯基乙醇)两种处理。
1.2.3.3以间接ELISA方法测定免疫反应性肝癌HepG2细胞经培养、固定及封闭后,以PBST洗涤后,每孔(每个浓度设5个复孔)加入100μl倍比稀释的单抗CD71 mab和免疫毒素,孵育、洗涤后,每孔加入100μl稀释后的HRP标记的山羊抗小鼠IgG,再经孵育、洗涤,每孔加入OPD底物反应液100μl,室温避光反应10min,硫酸终止反应,在酶标仪上测定490 nm吸光度值。
1.2.3.4以WST-1法分别测定免疫毒素和蓖麻毒蛋白对人肝癌细胞HepG2细胞和人正常肝细胞LO2细胞的毒性作用分别取HepG2细胞和LO2细胞,以每孔5×103的细胞密度接种到96孔细胞培养板,置于37℃、5%CO2的培养箱中培养24 h,弃上清后分别加入各组相应培养液100μl:实验组为加入含一系列浓度梯度的免疫毒素或蓖麻毒蛋白的培养液,浓度梯度均设为0.1μg/ml、0.2μg/ml、0.3μg/ml、0.4μg/ml 和0.5μg/ml,每个浓度设5个复孔;对照组为加入不含免疫毒素或蓖麻毒蛋白的等量培养液;空白组为不含细胞只加等量空白培养液,以空白组调零。之后再将96孔细胞培养板置37℃,5%CO2培养条件中培养48 h。按照试剂盒使用说明配置 WST-1溶液,每孔加入10μl WST-1溶液,在细胞培养箱孵育2 h后,将96孔板置于摇床上摇动1 min,在450 nm测定吸光度。按照以下公示计算细胞生长抑制率:细胞生长抑制率(%)=(1—给药组OD值/对照组OD值)×100%。
1.3统计方法采用SPSS20.0统计软件进行统计学分析。所有数据采用均数±标准差表示,采用检验。P<0.05为差异有统计学意义。
2 结果
2.1蓖麻毒蛋白和RTA的提纯蓖麻毒蛋白粗提液经sepharose4B柱及sephadexG-100柱洗脱,因ricin和凝集素均具有与D-半乳糖结合能力及两者之间分子量不同(蓖麻毒蛋白约为66 kD,凝集素约为120 kD),故蓖麻毒蛋白可成功提纯。第一峰为凝集素,第二峰为蓖麻毒蛋白。见封二彩图1。
-巯基乙醇可还原ricin,使其分解为 RTA和RTB,经DEAE-sephadex A-50柱及 CM-sephadex C-50柱洗脱,因蓖麻毒蛋白、RTA及RTB与该柱的结合能力不同,故可提纯RTA,第二峰为RTA,见封二彩图2。
将经sephadexG-150柱获得的IT粗品,经Bluesepharose CL-6B柱,因其可吸附含RTA的偶联物,故可将免疫毒素和单抗-PDP分离,实现IT提纯,见封二彩图3。在样品缓冲液中未含有 -巯基乙醇时,免疫毒素表现为一条分子量大于116 kD的单一电泳条带(封二彩图4)。而在样品缓冲液中含有 -巯基乙醇时,免疫毒素结构中的二硫键断裂,表现为三条电泳条带,即约55 kD处的单抗重链、约28 kD处的单抗轻链及约32 kD处的RTA(封二彩图5)。
2.2间接ELISA方法测定IT的免疫反应性结果显示,免疫毒素组曲线与抗CD71单抗组曲线基本趋势一致,但各浓度吸光度比之抗CD71单抗组略有下降,见封二彩图6。 2.3WST-1法测定IT和蓖麻毒蛋白对HepG2细胞和LO2细胞增殖的抑制作用结果显示,在不同浓度下,蓖麻毒蛋白对两类细胞均具有明显的生长抑制作用;免疫毒素则表现出不同的生长抑制作用,对HepG2细胞的生长抑制明显强于LO2细胞(P<0.05),见封三彩图7和封三彩图8,及表1~2。
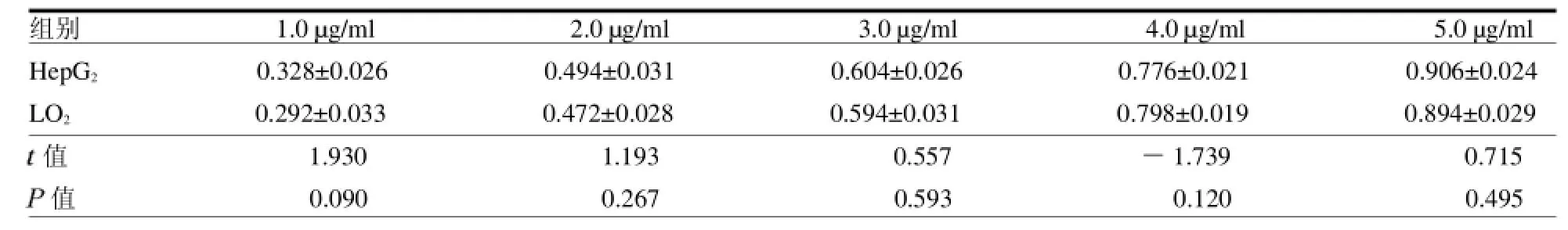
表1 不同浓度蓖麻毒蛋白对HepG2细胞和LO2细胞的生长抑制作用
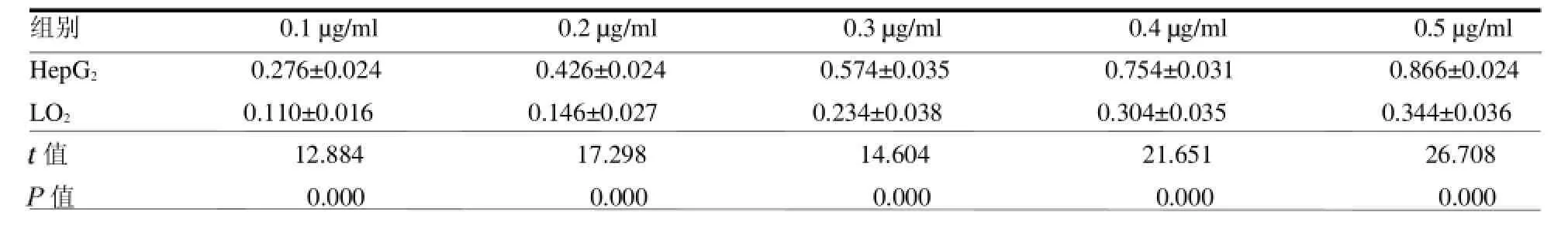
表2 不同浓度免疫毒素对HepG2细胞和LO2细胞的生长抑制作用
3 讨论
原发性肝癌(HCC)恶性程度高,传统治疗方式如手术、放化疗等难以使患者受益。因此,寻找更为有效、副作用小的治疗手段迫在眉睫[3-5]。
蓖麻毒蛋白是一种从蓖麻籽中分离得到的具有强烈毒性的天然毒素蛋白,其对所有哺乳动物真核细胞都有毒性作用,且对某些恶性肿瘤细胞的毒性更强,因此成为医学上用于杀伤肿瘤细胞的首选毒素之一。蓖麻毒蛋白由A、B两条链构成(RTA和RTB),RTA是活性链,即毒性链,相对分子质量约为31 kD,RTB是结合链,相对分子质量约为34 kD,其上含有半乳糖结合位点,故能与细胞上含半乳糖的糖蛋白或糖脂结合。RTA进入胞质后,可破坏核蛋白体60S亚单位,抑制蛋白质的合成,致使细胞死亡。由于RTB与细胞的结合是非特异的,因此限制了它在肿瘤治疗方面的应用[6-7]。
如何使蓖麻毒蛋白只作用于肝癌细胞,而不损伤正常细胞,是其应用于医学,尤其是肝癌治疗的关键。
近年来,分子靶向治疗的研究取得了较大进展,是现在肿瘤治疗领域的突破性和革命性的发展,代表了肿瘤生物治疗最新的发展方向,其利用肿瘤组织或细胞高度表达的具有特异性的结构分子作为靶点,选择某些能与这些靶分子特异性结合的抗体或配体等达到导向治疗目的一类疗法[8]。
CD71,即转铁蛋白受体,是一种通过与转铁蛋白相互作用调节铁吸收的跨膜糖蛋白,在细胞生长和增殖中发挥重要作用。在正常细胞中,转铁蛋白受体呈低水平表达,但在肝癌细胞中,由于其快速生长,故对铁的需求量明显增加,转铁蛋白受体的表达亦显著增加,可作为肝癌生物靶向治疗的特异性靶点[9-12]。
免疫毒素是一组人工构建的具有靶向细胞杀伤能力的杂合分子,其由毒性部分和靶向部分组成。毒性部分可以是植物、动物、微生物来源的细胞毒素,靶向部分可以是单克隆抗体或细胞因子[13-14]。本研究正是根据蓖麻毒蛋白 A链的高效生物毒性和CD71在肝癌细胞表面过量表达的特性,将抗CD71单抗与蓖麻毒蛋白A链进行偶联,构建新型免疫毒素。免疫毒素的制备有化学交联法和基因工程融合法。本研究采取化学交联法,以N-琥珀酰胺-3-(2-吡啶二硫)丙酸酯[N-succinimidyl-3-(2-pyridyldithio)-propionate,SPDP]作为交联剂[15]。
本实验应用SPDP作为交联剂,将RTA和CD71 mab进行偶联,根据SDS-PAGE结果,显示成功构建免疫毒素CD71 mab-RTA,及间接ELISA方法显示免疫毒素构建以后基本不影响免疫反应性。体外细胞毒性实验结果显示,IT对两类细胞的生长抑制作用有明显的差别,表明对高表达CD71的HepG2细胞,IT依靠CD71mab的靶向定位作用,通过与其特异性结合,导入RTA发挥毒性作用,而LO2细胞因其细胞表面CD71表达量较低,IT与其特异性结合较差,故而杀伤作用较弱。
目前免疫毒素在肿瘤治疗方面还存在以下几个方面的问题:(1)特异性,这是进行肿瘤靶向治疗的前提;(2)活性,取决于其半衰期和稳定性,这两者又取决于免疫毒素的分子结构、偶联活性及与肿瘤细胞的亲和力;(3)免疫原性,这可导致机体出现排斥反应。因此,寻求更为有效的生物毒素及特异性靶向分子,及改进偶联方式,修饰其中的免疫原性,是免疫毒素将来应用于临床的关键。
[1]ChakrabortyR,WielandCN,Comfere NI.Molecular targeted therapies in metastatic melanoma[J].Pharmgenomics Pers Med,2013,6:49-56.
[2]Weidle UH,Tiefenthaler G,Schiller C,et al.Prospects of bacterial and plant protein-based immunotoxins for treatment of cancer[J]. Cancer Genomics Proteomics,2014,11(1):25-38.
[3]马晓洁,宋明洋,谭榜宪.原发性肝癌放疗联合其他治疗的新进展[J].现代肿瘤医学,2015,23(1):139-141.
[4]商红叶.原发性肝癌治疗进展[J].黑龙江医学,2015,39(3):225-227. [5]赵海斌,杨琳.肝癌射频消融治疗合理选择与临床分析[J].中国医药指南,2015,13(3):152-153.
[6]BozzaWP,TollesonWH,Rosado LA,et al.Ricindetection:tracking active toxin[J].Biotechnol Adv,2015,33(1):117-123.
[7]张洪,敬永升,陈元,等.蓖麻种子毒蛋白抗癌活性及热稳定性的探讨[J].河南大学学报:医学版,2011,30(1):47-50.
[8]沈玮博,谭宏涛,姜洪池.肝细胞癌抗血管治疗:现状及新视野[J].中国医刊,2015,50(5):25-27,28.
[9]Wang SJ,GaoC,Chen BA,et al.Advancement of the study oniron metabolism and regulation in tumor cells[J].Chin J Cancer,2010,29 (4):451-455.
[10]Speeckaert MM,Speeckaert R,Delanghe JR.Biological and clinical aspects of soluble transferrin receptor[J].Crit Rev Clin Lab Sci,2010,47(5-6):213-228.
[11]张定林,陈玥琦,刘毅敏.转铁蛋白-转铁蛋白受体抗肿瘤作用研究进展[J].实用肿瘤学杂志,2015,29(1):65-68.
[12]邵明,刘煜.基于转铁蛋白受体(TfR1)的肿瘤与脑部疾病靶向治疗研究进展[J].医学信息,2014,27(6):657-659.
[13]AlewineC,HassanR,PastanI.Advancesinanticancerimmunotoxin therapy[J].Oncologist,2015,20(2):176-185.
[14]Gadadhar S,Karande AA.Abrin immunotoxin:targeted cytotoxicity and intracellular trafficking pathway[J].PloS One,2013,8(3):e58304.
[15]Wang LZ,Sun LR,Zhao YX,et al.Preparationand identification of a novel immunomodulator composed of muramyl dipeptide and anti-CD10 monoclonal antibody for treatment of minimal residual disease in acute leukemia children[J].International Immunopharmacology,2011,11(9):1211-1219.
Preparation of anti-CD71 monoclonal antibody with the ricin A chain immunotoxin and it's effect of anti-hepatocellular carcinoma cells in vitro
SHEN Su jian,ZHENG Bo,CAI Zhen zhai,XU Chang lng,XUE Zhan xiong.(The Second Amitated Hospital of Wenzhou medical University, Wenzhou 325000, Zhejiang , China)
【Abstract】ObjectiveAccording to the cytotoxicity of ricin A chain(RTA)and the target localization feature of CD71 monoclonal antibody(Mab),to research the effect of anti-hepatoma carcinoma cell in vitro of the immunotoxin(IT)composed by RTA and CD71 Mab.MethodsTaking SPDP as the coupling agent,RTApurified from castor bean was linked with CD71 Mab.After further purification,the construction of IT was detected by SDS-PAGE.The immunoreactivity was detected by indirect ELISA.The cytotoxicity in vitro was detected by WST-1 method.ResultsRTA was successfully purified by series of steps fromricin crude,such as grinding,filtration,affinity chromatography,gel chromatography,ion exchange chromatography and so on.The immunotoxin was constructed successfully,and there were two experimental results in the electropherogram of SDS-PAGE.Under non-reducing conditions,it migrated as a molecular weight exceeded about 116 kD;under reducing state,it migrated as three electrophoretic bands,which located at approximately 55 kD,32 kD and 28 kD.The experimental result of indirect ELISA showed that the curves of IT and Mab had the same trend,but the absorbance of IT was lower than that of Mab in a series of concentration gradient.By WST-1 method,in a series of concentration gradient,IT displayed a different cytotoxicity between HepG2cell and LO2cell(<0.05).ConclusionsIT retained a major part of the immunoreactivity.IT displayed a different cytotoxicity between HepG2and LO2cells.IT played a specific role in suppressing the multiplication of the hepatoma carcinoma cell and had a good prospect in liver cancer treatment.
Liver neoplasm;Carcinoma;Immunotoxin;Ricin;CD71
10.3969/j.issn.1671-0800.2016.07.003
R735.7
A
1671-0800(2016)07-0847-04
325000浙江省温州,温州医科大学附属第二医院通信作者: 薛战雄,Email:xuezhanxiong@126.com
鉴于目前肝癌治疗方式的效果不佳及副作用较大,寻求有效且针对性强的治疗方式是医学界的努力方向之一。免疫毒素(IT)是近年来新兴的肿瘤靶向治疗方法,为利用抗特定肿瘤细胞的单克隆抗体与肿瘤细胞的特异性结合的特点,将生物毒素(主要是细菌毒素、动物毒素和植物毒素)与该单抗进行偶联,靶向攻击肿瘤细胞,而其对正常组织细胞的杀伤性较小[1-2]。蓖麻毒蛋白由两条多肽链(RTA和RTB)组成,其中RTA为毒性多肽,RTB具有定位功能,但由于真核细胞表面普遍含有半乳糖基的糖蛋白或糖酯,故蓖麻毒蛋白对所有哺乳动物真核细胞都有毒害作用。如何有效发挥蓖麻毒蛋白的细胞毒作用,使其只作用于肝癌细胞,而不损伤正常肝细胞,成为肝癌治疗方面的研究难点。转铁蛋白受体(TFR/ CD71)在肝癌细胞上的表达水平明显高于正常细胞。以上述研究背景为基础,本研究采用N-琥珀酰胺-3-(2-吡啶二硫)丙酸酯[N-succinimidyl-3-(2-pyridyldithio)-propionate,SPDP]为偶联剂制备免疫毒素(CD71mab-RTA),并初步评价其体外抗肝癌细胞效应。现将结果报道如下。
2015-08-12(本文编辑:姜晓庆)
