3种茶叶中黄酮含量的测定分析
2016-08-31李春艳石登红
李春艳,石登红
(贵阳学院 生物与环境工程学院,贵州 贵阳 550005)
3种茶叶中黄酮含量的测定分析
李春艳,石登红
(贵阳学院 生物与环境工程学院,贵州 贵阳 550005)
确定茶叶中总黄酮含量。采用紫外分光光度法测定茶叶中总黄酮的含量。茶叶中总黄酮的最佳提取条件为85%乙醇,料液比为1∶40(g/mL),提取温度为80 ℃,提取时间为60 min。得出3种茶叶中春葵的黄酮化合物含量较高为37.45 mg/g,雪蕊次之为 34.87 mg/g,金毫最低为27.64 mg/g。所用方法简便,准确,快速、可靠、重复性好,回收率高达到98.355%,用于茶叶中总黄酮含量的测定分析。
总黄酮;紫外分光光度计;茶叶;测定
黄酮类化合物分布广泛,种类繁多,其中黄酮醇类化合物占黄酮类化合物总数的 1/3左右[1-2]。有研究显示其在抗氧化,抑制脂质过氧化反应,预防心血管疾病,防癌、抗癌方面效果明显[3-5],茶叶中的黄酮含量比较丰富。我国茶区辽阔,茶产量逐年增加且品种繁多[6]目前,对于茶叶中黄酮类化合物的研究比较多,但大多集中在单一茶叶中黄酮类物质的提取方法的工艺研究上,对于其含量的测定及不同品种黄酮类化合物含量的比较鲜有报道。本文通过研究其含量的测定,为茶叶的研究及购买提供一定的依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料
雪蕊、春葵(翠芽)、金毫(红茶)由德江县鸿泰茶业有限责任公司提供。
1.1.2 试剂
95%乙醇、无水乙醇、亚硝酸钠、氢氧化钠、硝酸铝、芦丁标准品(≥98%)。
1.1.3 仪器
UV-2550型紫外可见分光光度计(日本岛津公司);数显恒温水浴锅(上海梅香仪器有限公司);电子分析天平(梅特勒-托利多上海仪器有限公司)
1.2 方法
1.2.1 测定波长的选择
准确称取6.4 mg的芦丁标准品,用超纯水溶解、定容至刻度25 mL,浓度为0.256 mg/mL,即为芦丁标准溶液。移取芦丁标准溶液1 mL于10 mL的比色管中,依次加入超纯水1.5mL、0.5mL5%亚硝酸钠溶液,混匀,放置6 min后加入10%硝酸铝溶液0.5 mL,混匀,静置6min后加入5 mL4%氢氧化钠溶液,超纯水稀释至刻度10 mL,混匀,静置15 min。空白对照为以上不含5%的亚硝酸钠溶液。芦丁溶液在400-800nm范围内扫描,芦丁溶液的最大波长为513 nm,即为本实验的最大波长。
1.2.2 芦丁标准曲线的绘制
分别移取0、0.5、1.0、1.5、2.0、2.5、3.0 mL泸定标准溶液于10 mL比色管中,超纯水稀释至3.0 mL后加入0.5mL5%亚硝酸钠溶液,混匀,放置6 min后加入10%硝酸铝溶液0.5 mL,混匀,静置6 min后加入5mL 4%氢氧化钠溶液,超纯水稀释至刻度10 mL,混匀,静置15 min。依次在513 nm波长下测吸光度,并以芦丁溶液浓度(C)为横坐标,吸收度(A)为纵坐标,制得标准曲线,求出一元线性方程Y=9.782 61-0.118 23,相关系数r=0.999 76。结果说明,芦丁溶液在0.012~0.077 mg/mL范围内质量浓度与吸光度线性关系良好。
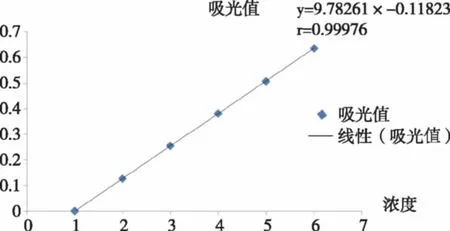
图1 芦丁标准曲线Fig.1 rutin standard curve
1.2.3 单因素实验
采用单因素实验设计分别研究4个因素,即乙醇浓度、料液比、提取温度和提取时间对茶叶黄酮提取量的影响。
1) 乙醇体积分数。精密称取4份干茶叶各1 g于100 mL圆底烧瓶中,分别加入体积分数为65%、75%、85%、95%的乙醇溶液25 mL,80 ℃下回流1 h,趁热过滤,收集滤液,滤渣重复提取一次,趁热过滤,合并滤液,用相应的体积浓度的乙醇定容至100 mL的容量瓶中,摇匀,制得茶叶黄酮提取液。移取1 mL,按1.2.1的方法显色,在513 nm波长测吸光度,代入1.2.2中一元线性方程求出样品溶液总黄酮浓度(mg/mL), 根据以下公式计算样品总黄酮质量和含量:样品中总黄酮质量(mg)=样品溶液总黄酮浓度×10×100/0.5,样品总黄酮含量(mg/g)=样品总黄酮质量/样品质量。
2) 料液比 精密称取4份1 g样品于100 mL圆底烧瓶中,加入体积分数为65%料液比分别为(1∶10、1∶25、1∶40、1∶55)g/mL的乙醇,水浴加热80 ℃回流提取1 h,趁热抽滤,用相应的体积浓度的乙醇定容至100mL容量瓶,摇匀,制得茶叶黄酮提取液。移取0.5 mL,按1.2.1的方法显色,测吸光度,计算总黄酮含量。
3)提取温度 精密称取4份1 g样品于100 mL圆底烧瓶中,加入25 mL体积分数为65%提取温度分别为(60 ℃、70 ℃、80 ℃、90 ℃)g/mL的乙醇,水浴加热回流提取1 h,趁热过滤,收集滤液,滤渣重复提取一次,趁热过滤,合并滤液,用相应的体积浓度的乙醇定容至100 mL的容量瓶中,摇匀,制得茶叶黄酮提取液。移取0.5 mL,按1.2.1的方法显色,测吸光度,计算总黄酮含量。
4)提取时间 精密称取4份1 g样品于100mL圆底烧瓶中,加入25 mL体积分数为65%提取温度分别为(20 min、40 min、60 min、80 min)g/mL的乙醇,水浴加热80 ℃回流提取1 h,趁热过滤,收集滤液,滤渣重复提取一次,趁热过滤,合并滤液,用相应的体积浓度的乙醇定容至100 mL的容量瓶中,摇匀,制得茶叶黄酮提取液。移取1 mL,按1.2.1的方法显色,测吸光度,计算总黄酮含量。
1.2.4 精密度试验
精密量取芦丁标准溶液0.25 mL,按1.2.1方法制备供液,于513 nm处连续测定6次,并计算吸光度的RSD。
1.2.5 稳定性试验
精密量取样品溶液1 mL,按1.2.1方法制备供液,分别在513 nm处于0、15、30、50、70、100 min时测吸光度,并计算吸光度的RSD。
1.2.6 重复性试验
精密量取样品溶液0.5 mL,按1.2.1方法制备供液,平行制备6份于513 nm处测定吸光度,并计算总黄酮平均含量和RSD。
1.2.6 加样回收试验
精密量取样品溶液6份,分别量取0,5 mL,分别加入芦丁标准溶液0.20、0.25、0.30 mL按标曲绘制的测定方法,分别在513 nm处测定吸光度,计算加样回收率和RSD。
2 结果与分析
2.1 黄酮类化合物是茶叶的主要有效成分之一,近年来对黄酮的提取是研究热点,目前对茶叶黄酮类化合物提取的方法也有很多,包括紫外分光广度提取法、超声波提取法、有机溶剂提取法。单因素实验表明乙醇浓度、提取时间、料液比以及提取温度均会影响总黄酮提取量,随着体积分数的增加黄酮的含量增大,85%时达到最高值,但是当乙醇体积分数超过 85%的时候,总黄酮的提取率反而降低。原因可能是随 着乙醇体积分数的增大,提取物中杂质含量增加,而有效成分含量降低,影响提取率。采用1∶10 、1∶25、1∶40、1∶55的料液比在80摄氏度条件下回流60 min,结果表明,随着料液比的增加,黄酮含量增大,当料液比超过1∶40时,提取量下降。采用紫外分光光度法对提取野生马齿苋的黄酮含量进行测定得到最佳提取工艺条件为乙醇浓度为85%,提取温度为80 ℃,提取时间是60 min,料液比为1∶40。
2.2 精密度试验
精密量取芦丁标准溶液0.25 mL,按1.2.1方法制备供液,于513 nm处连续测定6次,并计算吸光度的RSD。芦丁标准溶液的RSD=2.8%(n=6),表示在此试验的条件下精密度良好。
2.3 稳定性试验
精密量取样品溶液0.5 mL,按1.2.1方法制备供液,分别在513 nm处于0、15、30、50、70、100 min时测吸光度,并计算吸光度的RSD。样品溶液的吸光度RSD=0.856%,说明样品溶液在100 min内基本稳定。
2.4 重复性试验
精密量取样品溶液0.5 mL,按1.2.1方法制备供液,平行制备6份于513 nm处测定吸光度,并计算总黄酮平均含量和RSD。样品溶液的吸光度RSD=0.813%,表明该方法良好。
2.5 加样回收试验表1加样回收
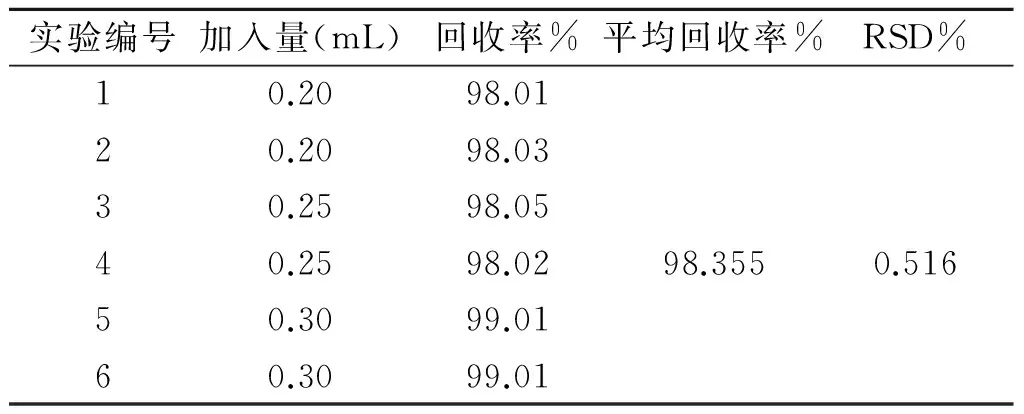
表1 加样回收Tab.1 Add sample collection
2.6 不同品种茶叶黄酮含量分析
由以上实验可知 ,提取黄酮的最佳方法为乙醇浓度为 85%, 温度在 80 ℃.提取时间为60 min,料液比1∶40。 在这个条件下 ,精密量取雪蕊、金毫、春葵1 g在此条件下提取测定。结果如下:
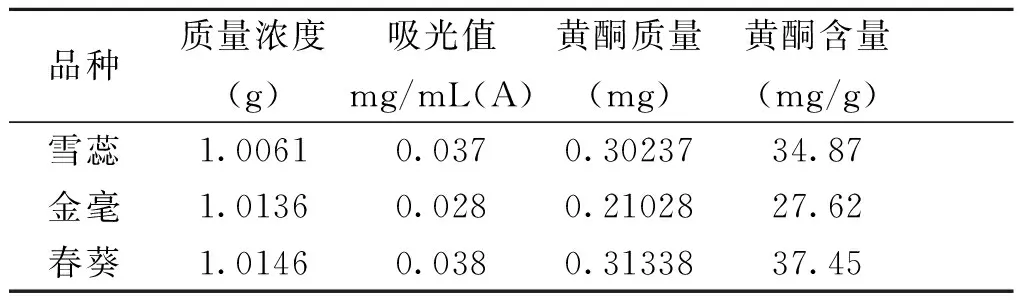
表2 不同品种茶叶黄酮含量Tab.2 Different varieties of tea flavonoids content
由表2可知,春葵的黄酮化合物含量较高为37.45 mg/g,雪蕊次之为34.87 mg/g,金毫最低为27.64 mg/g。
3 结论
采用紫外分光光度法测定总黄酮含量时 ,提取黄酮的最佳方法为乙醇浓度为 85%, 温度在80 ℃.提取时间为60 min,料液比1:40。 在 0.012~0.077 mg/mL 的浓度范围内线性关系良好 (r= 0.999 9) ,平均回收率 = 98.355%, RSD= 0.516%。三种茶叶中春葵的黄酮化合物含量较高为37.45 mg/g,雪蕊次之为34.87 mg/g但是和春葵相差不大, 金毫的含量最低为27.64 mg/g。
[1]Rice-Evans C A, Miller N J, PagangaG.Structure-antioxidant activity relationships of flavonoids andphenolic acids[J]. Free radical biology and medicine, 1996,20(7): 199-219.
[2]陶锋, 李向荣, 占洁. 黄酮醇类化合物提取分离方法的研究进展[J]. 中药材, 2008, 31(10): 1586-1589.
[3]Stanislaw B,Wieslaw O. Antioxident and antiradical activities of flavonoids[J]. Journal of Agricultural and Food Chemistry, 2001, 49(6): 2774-2779.
[4]Eleni P, Dimitris P. Evaluation of the antiradical and reducing properties of selected Greek white wines:correlationwith polyphenolic composition[J]. Journal of the Science of Food and Agriculture, 2002, 82: 1014-1020.
[5]钱建亚. 荞麦精粉中的黄酮及其自由基清除活性[J]. 食品与发酵工业, 2000, 26(3): 24-30.
[6]何书美,刘敬兰.茶叶中总黄酮含量测定方法的研究[J].分析化学,2007,35(9):1365-1368.
The determination of flavonoid in the tea
LI Chun-yan,SHI Deng-hong
(Biological and Environmental Engineering of Guiyang University,Guizhou Guiyang 550005,China)
to determine the determination methods of flavonoids content in tea.using uv spectrophotometry for determining the content of flavonoids in tea.the best extraction conditions of flavonoids in tea is 85% ethanol, ratio of feed liquid 1:40 (g/mL), extraction temperature is 80 ℃, extracting time for 60 min.the method is simple, accurate, fast, reliable, good repeatability, high recovery rate of 98.355%, can be suitable for content determination of flavonoids content in tea.
Flavonoids; Ultraviolet spectrophotometer;The tea; Content determination
2016-11-04
贵州省教育厅高等学校2015年大学生创新创业训练计划项目。
李春艳(1995-),女,穿青人,贵州织金人,生物与环境工程学院2013级生物工程专业本科生。 石登红(1980-),女,土家族,贵州德江人,副教授。主要从事方向:植物学,植物资源利用。
TS272
A
1673-6125(2016)04-0050-03
