产7α,15α-双羟基去氢表雄酮的球黑孢菌紫外诱变育种及发酵条件
2016-08-31唐洁,崔励,吴明杰
唐 洁, 崔 励, 吴 明 杰
(大连工业大学 轻工与化学工程学院, 辽宁 大连 116034 )
产7α,15α-双羟基去氢表雄酮的球黑孢菌紫外诱变育种及发酵条件
唐 洁,崔 励,吴 明 杰
(大连工业大学 轻工与化学工程学院, 辽宁 大连116034 )
球黑孢菌可以在去氢表雄酮(DHEA)的C-7α和C-15α位进行双羟基化反应,生成7α,15α-双羟基去氢表雄酮(7α,15α-diOH-DHEA)。以球黑孢菌FN-A127为出发菌株进行紫外诱变,筛选出最佳菌株FN-A7,并对FN-A7进行遗传稳定性研究和发酵条件优化。结果表明,紫外诱变最佳照射时间为15 min,菌株FN-A7的遗传稳定性良好。在发酵培养基中加入2 g/L的DHEA,在8%的接种量、30 ℃进行发酵,突变菌株FN-A7将DHEA转化为7α,15α-diOH-DHEA的产率可达到31.96%。
球黑孢菌;去氢表雄酮;紫外诱变;发酵条件
0 引 言
屈螺酮是新一代甾体类避孕药,由于其副作用小、毒性低、耐受性好,是目前最好的第4代口服避孕药之一。7α,15α-双羟基去氢表雄酮(7α,15α-diOH-DHEA)是合成屈螺酮的重要中间体[1-2]。多种真菌能进行7α,15α-diOH-DHEA的微生物转化,其中亚麻刺盘孢菌(Colletotrichumlini)和赤霉菌(Gibberellaintermedia)的使用较为广泛[3]。亚麻刺盘孢菌能引起植物炭疽病[4];赤霉菌引起的麦类赤霉病导致受侵小麦籽粒中含有真菌毒素对食品安全和人畜健康造成危害[5]。荷兰联合利华公司在2004年提出了球黑孢菌提取物可以作为化妆品中的添加剂使用[6],说明球黑孢菌具有较高的生物安全性。球黑孢菌作为甾体羟基化反应的微生物,之前报道可以进行的羟化反应位置有C-11α、C-15α和C-19位[7-8]。本文以球黑孢菌FN-A127为出发菌株,研究了使用球黑孢菌将去氢表雄酮(DHEA)转化为7α,15α-diOH-DHEA,并讨论了菌种的紫外诱变育种和发酵条件。
1 材料与方法
1.1材料
1.1.1菌种
球黑孢菌FN-A127(NigrosporasphaericaFN-A127),清华大学生命科学院提供。
1.1.2材料
去氢表雄酮、7α,15α-双羟基去氢表雄酮标准品,湖北方通药业有限公司。
1.1.3培养基
斜面培养基:PDA基础培养基。
种子培养基(g/L):葡萄糖30,玉米浆膏10,黄豆饼粉12.5,硝酸钠2,磷酸二氢钾1,磷酸氢二钾2,七水合硫酸镁0.5,七水合硫酸亚铁0.02,氯化钾 0.5,pH 自然。
发酵培养基:同“种子培养基”,pH 6.2。
脱氧胆酸钠平板:斜面培养基中加0.05%的脱氧胆酸钠,以抑制菌丝的生长。
以上培养基均在121 ℃下灭菌20 min.
1.2实验方法
1.2.1菌种活化
将原始球黑孢菌接入斜面培养基中,28 ℃培养7 d。250 mL三角瓶中装入50 mL不加琼脂的PDA培养基,接入一环球黑孢菌孢子,摇床28 ℃、220 r/min振荡培养5 d。
1.2.2菌悬液制备
取球黑孢菌FN-A127斜面2支,将适量无菌水倒入斜面菌苔上,清洗孢子。将菌液倒入已灭菌的装有玻璃珠的三角瓶内摇匀。将菌液倒入已灭菌装有2层纱布的漏斗内过滤,制成108个/mL左右的菌悬液。
1.2.3紫外诱变方法
取2~4 mL菌悬液于无菌培养皿中,放入一无菌磁力转子,置于磁力搅拌器上。关闭所有照明,30 W紫外灯下分别照射5、10、15、20、25、30 min,照射距离30 cm。紫外线照射菌液依次稀释至10-1、10-2、10-3、10-4、10-5、10-6,将稀释菌液移至PDA平板中,每个平板上加入0.1 mL 菌液,用无菌涂布器涂匀,每个梯度设置2个平行样,28 ℃避光培养6 d。
1.2.4单菌落筛选
初筛:从培养皿中挑选菌落单一、大小适中、边缘光滑的10株球黑孢菌单菌落转接至斜面培养基上,28 ℃避光培养5 d,待进一步筛选使用。
复筛:初筛获得的菌株上取一环孢子转入发酵培养基中,起始菌株FN-A127作对照,30 ℃、220 r/min摇床振荡培养52 h,测定7α,15α-diOH-DHEA的产率。
每个摇瓶装100 mL种子培养基,各接入5%的孢子菌悬液,30 ℃、220 r/min培养,每隔6 h取样,测定每瓶发酵液的总量,3 500 r/min离心后去上层清液测菌体的湿重。
1.2.6转化工艺
将5%、108个/mL的孢子菌悬液加入种子培养基中,30 ℃、220 r/min培养48 h,转接到发酵培养基中,30 ℃、220 r/min发酵转化52 h。
1.2.77α,15α-diOH-DHEA检测方法
取复筛后的发酵液1 mL,加入1 mL乙酸乙酯,充分萃取后在3 500 r/min转速下离心分层,取上清液蒸干,剩余固体用甲醇溶解、稀释后用孔径0.45 μm的有机滤膜过滤,作为待测样品。
HPLC分析。色谱条件:C18烷基硅烷键合反相柱;流动相V(甲醇)∶V(乙腈)∶V(水)=36∶24∶40;进样量20 μL;体积流量0.8 mL/min;色谱柱温25 ℃;紫外检测器波长210 nm。
将标准品7α,15α-diOH-DHEA制成质量浓度为1 g/L的甲醇溶液,梯度稀释至0.5、0.33、0.25、0.2 g/L,分别进行HPLC检测,绘制标准曲线。线性回归方程:y=5×10-7x,R=0.996 8,线性关系良好。
数据管理、预警管理与预警发布管理3个模块安装在服务器端,由于交互性较强,采用B/S架构,基于ASP.NET的MVC模式设计。预警分析引擎也安装在服务器端,由于不需要进行详细的配置,采用C/S架构。服务器端实现远程数据管理、预警规则设定、预警分析处理等功能,在接收到实时数据后,进行分析计算,判别是否超警,同时生成预警消息,推送至客户端。

1.2.8复筛菌株的遗传稳定性
将复筛的菌株做6次传代培养,测定每代菌株进行发酵转化后7α,15α-diOH-DHEA的产率。
2 结果与讨论
2.1紫外诱变时间对球黑孢菌致死率的影响
球黑孢菌紫外线照射后的致死率曲线如图1所示。照射5 min时,致死率较低,从10 min开始,致死率大幅提升,10~15 min致死率增加2倍多,说明此时的辐射量是处于多数孢子的敏感区域与耐受极限[9],照射15 min时致死率达到75%。致死率过低诱变的孢子活性不高,且正突变菌落较少;致死率过高诱变的孢子的存活率太低,且这些孢子可能因为紫外线照射的时间过长而使相应的酶活降低,甚至产生负突变。因此,选择致死率在75%左右为最佳,最佳紫外诱变时间为15 min。
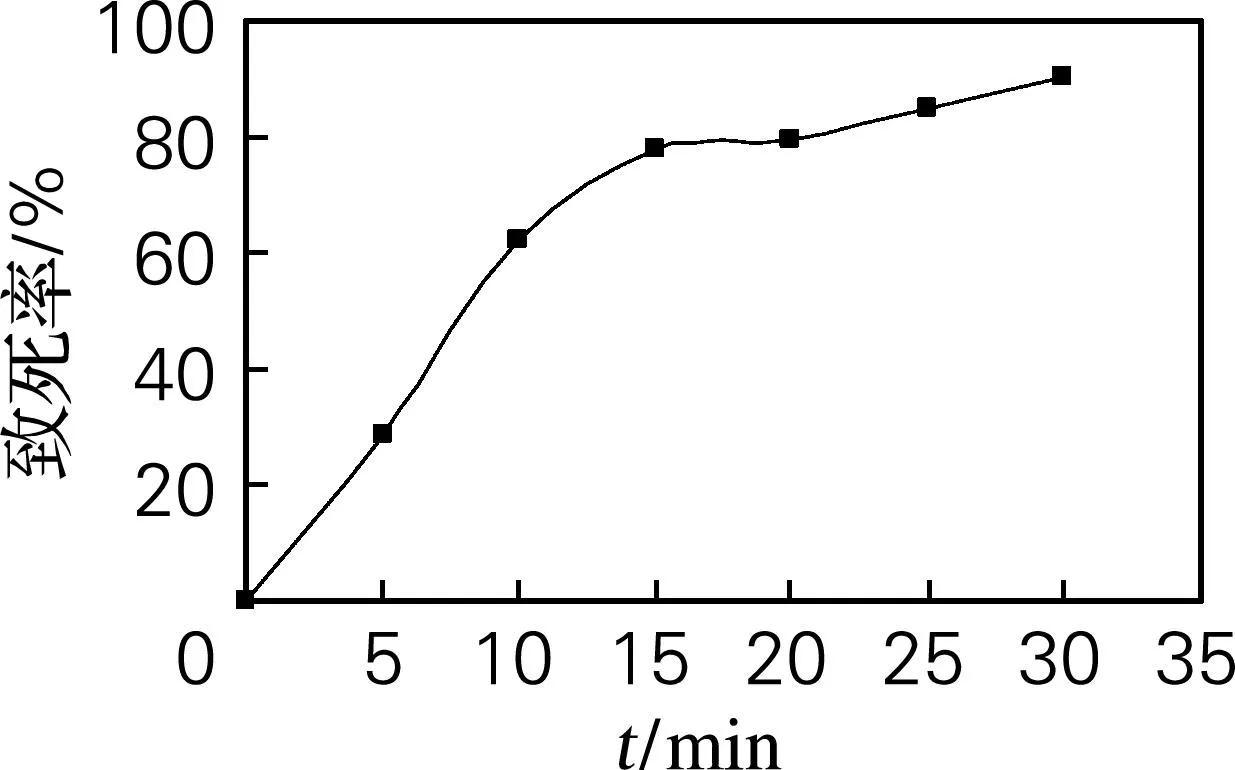
图1 紫外线照射时间对球黑孢菌致死率的影响
2.2复筛结果
对照实验组FN-A127菌株发酵培养52 h后,测得7α,15α-diOH-DHEA的产率为11.05%。
复筛的诱变菌株对7α,15α-diOH-DHEA的产率如表1所示。诱变菌株中FN-A1、FN-A2、FN-A3、FN-A5、FN-A6、FN-A7、FN-A8和FN-A9 的产率相对于对照实验组FN-A127菌株均有提高,其中FN-A7的转化效果最好。刘佩卉[10]在去氢表雄酮的生物法羟基化修饰研究中用紫外诱变选育青霉菌,仅将菌种的转化率提高到13.9%。本实验中菌株FN-A7将产率提高到17.34%,因此选定FN-A7为复筛最佳菌株。
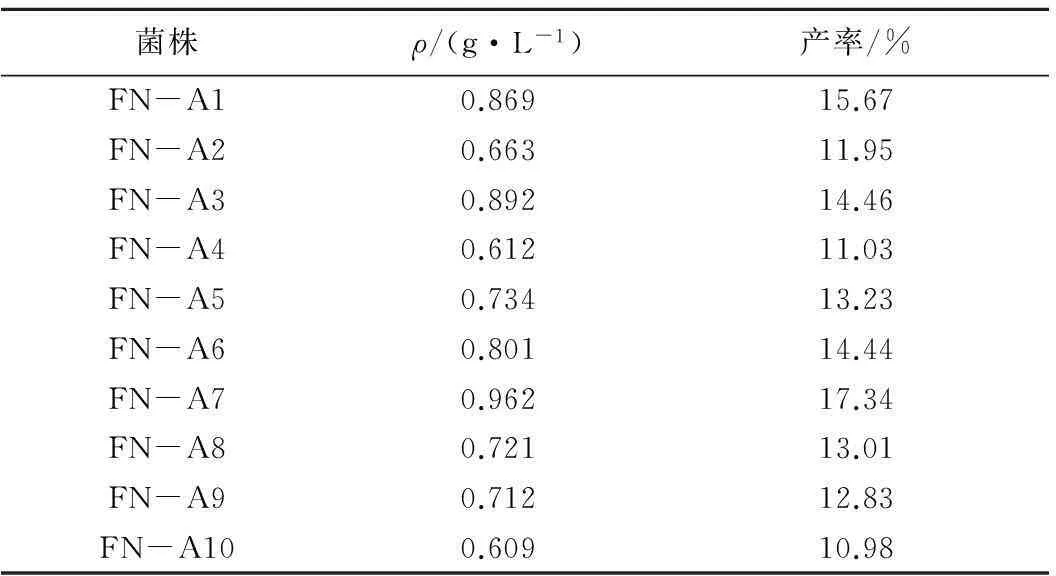
表1 复筛诱变菌株转化结果
2.3复筛菌株遗传稳定性
复筛最佳菌株FN-A7连续6次转接的斜面做发酵转化实验,结果如表2所示。复筛最佳菌株FN-A7连续6次传代斜面对底物进行发酵转化,发酵液中产物质量浓度基本稳定在0.99 g/L左右,表明其遗传稳定性良好。

表2 复筛最佳菌株遗传稳定性实验
2.4菌株FN-A7的生长曲线及接种时间
复筛菌株FN-A7的生长曲线如图2所示,24 h 前为生长迟缓期,培养24 h后进入对数生长期,54 h到达稳定期。对数生长期内,48 h时的菌浓较高,菌丝体处于生长旺盛期,菌体生理活性较高。种子培养时间过短会延缓菌体的生长代谢,过长又会造成菌体细胞老化、代谢功能衰退[11]。因此,确定FN-A7的接种时间为48 h,即可将培养48 h的种子液接入发酵培养基中进行下一步转化反应。

图2 菌株FN-7的生长曲线
2.5发酵转化条件
2.5.1DHEA加入时间对转化的影响
底物加入时间对菌体的微生物转化能力有重要的影响。李会等[12]在用赤霉菌将DHEA转化为7α,15α-diOH-DHEA的研究中,在培养24 h后加入底物可以使转化率达到最高。本实验分别于菌体培养0、6、12、24、30 h时加入5 g/L的DHEA,转化时间均为52 h。结果如图3所示,初始时加入底物,7α,15α-diOH-DHEA的产率最高,6 h时产率开始明显下降。发酵培养前先加底物,可能会对酶有诱导的作用,难溶的底物可以随着菌体的生长而被包覆在易成团的球黑孢菌体内,有利于转化的进行,所以产率反而高于菌体成熟后再加入底物。因此,确定底物的加入时间在培养初始时。

图3DHEA加入时间对7α,15α-diOH-DHEA产率的影响
Fig.3EffectofDHEAadditiontimeon7α,15α-diOH-DHEAyield
2.5.2发酵温度对转化的影响
温度一方面可以影响发酵过程中各种酶反应的速率和蛋白质的性质;另一方面会影响发酵液的物理性质[13]。在原培养条件30 ℃基础上,改变转化温度,选出菌体发酵转化最适宜的温度。本实验考察在26、28、30、32、34 ℃ 5个不同温度下进行发酵,52 h后检测7α,15α-diOH-DHEA的产率。结果如图4所示,26 ℃时产率较低,产率随着温度的升高而升高,30 ℃时产率达到最高。当温度继续升高,产率开始下降,可能是温度过高,使羟化酶的催化活力下降[14]。所以,选择30 ℃作为发酵转化的温度。
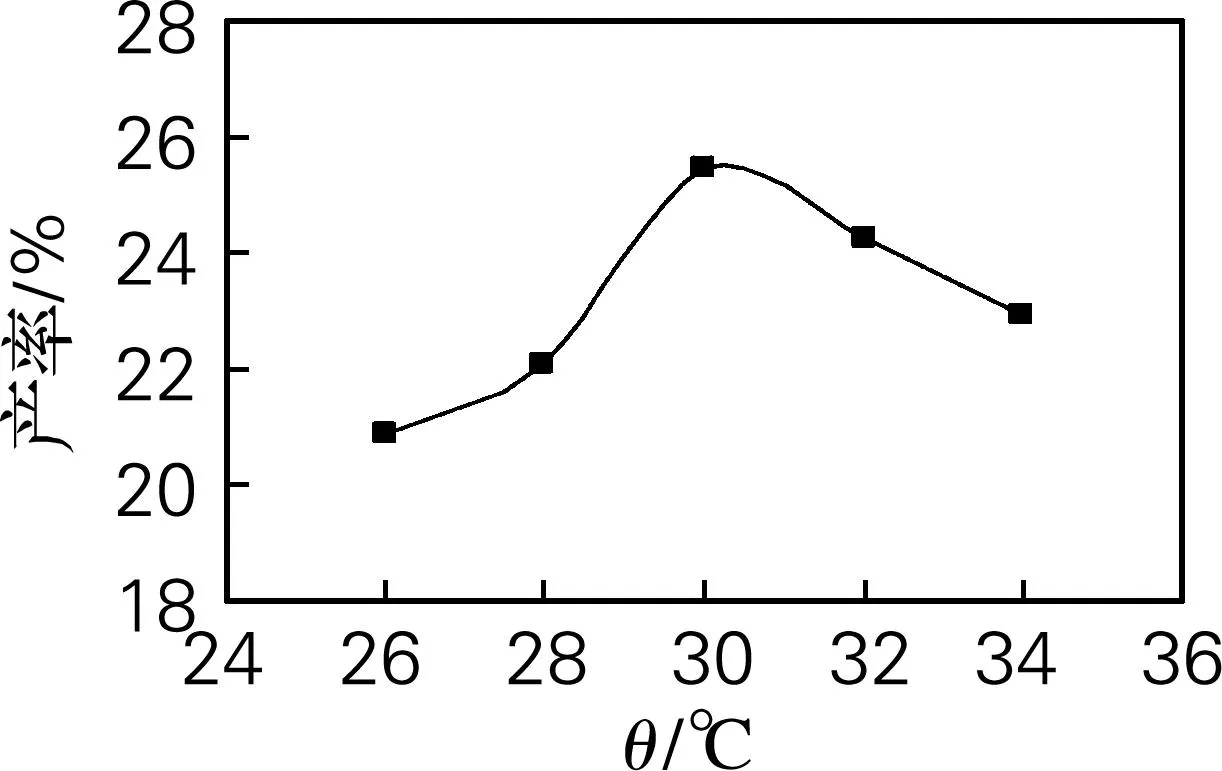
图4发酵温度对7α,15α-diOH-DHEA产率的影响
Fig.4Effectoffermentationtemperatureon7α,15α-diOH-DHEAyield
2.5.3DHEA质量浓度对转化的影响
甾体化合物的微生物转化是酶促反应,随着底物质量浓度增加,酶被底物饱和,底物的转化率不再升高,甚至下降[15]。本实验分别考察了2、5、8、15、20 g/L的DHEA添加量下发酵转化的产物得率。结果如图5所示,随着底物质量浓度增大,产率开始下降,到达8 g/L时,下降幅度更为明显。说明当底物质量浓度达到一定的临界值后,底物在菌体外堆积,而对菌体生长起到抑制作用,不利于转化的进行。底物质量浓度低于2 g/L,转化所得的实际产量过低,可能对以后实际生产的收益影响较大。袁东超等[16]在研究底物浓度对降解大豆甾醇生产雄甾烯酮的影响中发现,底物质量分数超过0.3%就能明显抑制分枝杆菌的生长,过高的底物浓度对最终转化率的提高无利。所以,选择2 g/L为所需底物浓度。
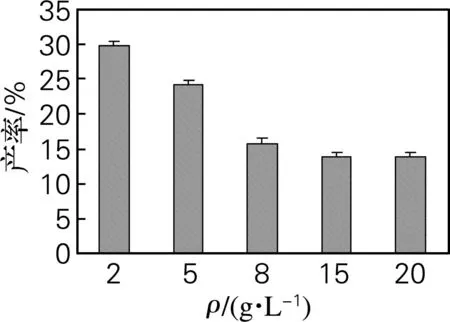
图5DHEA质量浓度对7α,15α-diOH-DHEA产率的影响
Fig.5EffectofDHEAconcentrationon7α,15α-diOH-DHEAyield
2.5.4接种量对转化的影响
接种量的大小决定了菌体的生长繁殖状态,从而影响菌体内酶对底物的催化作用。魏长龙等[17]在研究接种量对微生物转化生成9α-羟基雄烯二酮中得出,接种量仅为4.0%时甾体转化率提升最快。本实验考察了在不同接种量下反应的转化情况,结果如图6所示,接种量在8%时,7α,15α-diOH-DHEA产率较高。采用较大的接种量可以加快菌丝的繁殖速度,缩短调整期,减少反应时间。当接种量到10%时,产率大幅下降,可能是接种量过大,菌丝体生长的过多,易将菌体包裹成团,引起溶氧不足,影响产物的合成[18]。接种量过低使菌体生长较慢,导致用于转化的酶不足;过高则会使酶活力降低,抑制产率的提高。因此,选择8%为发酵转化的接种量。

图6 接种量对7α,15α-diOH-DHEA产率的影响
2.5.5助溶剂对转化的影响
甾体化合物在水中的溶解度很低,微生物转化过程中,底物不溶于水相的发酵液,会影响菌体对底物的吸收利用,且底物易包埋在析出的产物中 ,影响底物与酶的有效接触,限制最终产率[19]。骆健美等[20]研究不同有机溶剂对甾体C1,2脱氢反应发现,添加乙醇时简单节杆菌的细胞膜通透性最好,醋酸可的松的转化率最高。增大底物在反应体系中的溶解度对提高反应效率有重要作用。本文采用吐温80、无水酒精、豆油和PEG 4种不同助溶剂,添加量为2.0%。结果如图7所示,无水酒精对底物的转化效果最好。底物DHEA易结块,以水相为主的发酵液中添加少量极性的有机助溶剂,可以增加疏水性底物的溶解度[21],而其他几种助溶剂都不能很好地改善底物的分散情况,因此,选择无水酒精作为底物的助溶剂。

图7 助溶剂对7α,15α-diOH-DHEA产率的影响
3 结 论
球黑孢菌株FN-A127通过紫外线辐射15 min 的诱变,筛选出最佳菌株FN-A7,比出发菌株的7α,15α-diOH-DHEA产率提高了6.29%,且遗传稳定性良好。利用诱变复筛菌株FN-A7对发酵条件进行优化,配制发酵培养基同时加入用无水酒精溶解的底物,质量浓度为2 g/L,高温灭菌后接入8%的种子液,在30 ℃进行发酵,7α,15α-diOH-DHEA的产率提高到31.96%。
球黑孢菌是微生物转化DHEA产7α,15α-diOH-DHEA的新菌种,该菌在甾体羟基化反应方面的应用有所创新。球黑孢菌的生物安全性较高,可以作为潜在的工业菌,下一步需要用更好的优化手段来提高产率,以达到工业生产的目的。
[1] 林晓辉,章平荣,柯贤炳,等.屈螺酮的合成工艺研究[J].科协论坛,2007(6):33.
[2] 潘高峰,贺一君,尹金玉.屈螺酮关键中间体的合成[J].广东化工,2010,37(3):135-136.
[3] ROMANO A, ROMANO D, RAGG E, et al. Steroid hydroxylations withBotryodiplodiamalorumandColletotrichumlini[J]. Steroids, 2006, 71(6): 429-434.
[4] 沈瑞清,张萍,郭成瑾,等.宁夏炭疽菌属真菌资源研究[J].河南农业科学,2012,41(5):100-102.
[5] 喻大昭.麦类赤霉病研究进展[J].植物保护,2009,35(3):1-6.
[6] BAJOR J S, BARRATT M J, BOSKO C A. Cosmetic compositions containingnigrosporasphaericaextracts: EP20050780098[P]. 2008-07-02.
[7] MUIR R D, DODSON R M. Process for the oxygenation of steroids withnigrospora: US50773755A[P]. 1958-09-11.
[8] SCHERING A G. Process for the preparation of 19-hydroxy steroids of the androstane and pregnane series: US4284720[P]. 1981-08-18.
[9] 张学成,时艳侠,孟振.小球藻紫外线诱变及高产藻株筛选[J].中国海洋大学学报,2001,37(5):749-753.
[10] 刘佩卉.去氢表雄酮的生物法羟基化修饰研究[D].济南:山东轻工业学院,2010.
[11] 段少军,杜连祥,高艳玲,等.雷斯青霉15α-羟基化左旋乙基甾烯双酮的发酵工艺优化[J].化学与生物工程,2008,25(3):41-44.
[12] 李会,张明杰,张晓梅,等.三羟基雄甾烯酮转化菌株的选育及工艺优化[J].生物工程学报,2013,29(11)1687-1691.
[13] 熊宗贵.发酵工艺原理[M].北京:中国医药科技出版社,1995.
[14] TORSHABI M, BADIEE M, FARAMARZI M A, et al. Biotransformation of methyltestosterone by the flamentous fungusMucorracemosus[J]. Chemistry of Natural Compounds, 2011, 47(1): 59-63.
[15] 杨灿宇,杜连祥.甾体C11α-羟化菌株AF9612发酵条件的研究[J].天津轻工业学院学报,1999(1):10-14.
[16] 袁东超.降解大豆甾醇生产雄甾烯酮菌种选育和发酵条件的研究[D].天津:天津科技大学,2004.
[17] 魏长龙,赵树欣,王珊,等.NocardiacanicruriaBF313催化甾体9α-羟基化发酵工艺优化[J].食品工业科技,2014,35(18):320-323.
[18] 胡曦予,崔励,冯魁.黑根霉RN-M246催化雄甾-4-烯-3,17-二酮的11α-羟基化反应[J].大连工业大学学报,2013,32(4):249-251.
[19] 李福,王普,李荣贵.有机溶剂/水两液相体系中甾体激素的生物转化[J].生物技术,2004,14(3):76-78.
[20] 骆健美,宋妍,王建峰,等.基于细胞性质分析不同有机溶剂对简单节杆菌C1,2脱氢反应的影响[J].化学与生物工程,2012,29(5):49-53.
[21] 孙志浩.生物催化工艺学[M].北京:化学工业出版社,2005.
Mutantion ofNigrosporasphaericaby ultraviolet mutation to produce 7α,15α-dihydroxyl dehydroepiandrosterone and its fermentation condition
TANGJie,CUILi,WUMingjie
(School of Light Industry and Chemical Engineering, Dalian Polytechnic University, Dalian 116034, China )
Nigrospora sphaericacouldproduce7α,15α-dihydroxyldehydroepiandrosterone(7α,15α-diOH-DHEA)bydihydroxylationreactiononC-7αandC-15αofdehydroepiandrosterone(DHEA).AfterultravioletmutationonemutantFN-A7wasobtained.Itsgeneticscharacteristicwasstablein15minofmutationtimeandtheyieldof7α,15α-diOH-DHEAcouldreachto31.96%withinoculationof8%andDHEAof2g/Lat30 ℃.
Nigrosporasphaerica; dehydroepiandrosterone; ultraviolet mutation; fermentation condition
唐洁,崔励,吴明杰.产7α,15α-双羟基去氢表雄酮的球黑孢菌紫外诱变育种及发酵条件[J].大连工业大学学报,2016,35(4):254-258.
TANG Jie, CUI Li, WU Mingjie. Mutantion ofNigrosporasphaericaby ultraviolet mutation to produce 7α,15α-dihydroxyl dehydroepiandrosterone and its fermentation condition [J]. Journal of Dalian Polytechnic University, 2016, 35(4): 254-258.
2015-01-08.
唐 洁(1989-),女,硕士研究生;通信作者:崔 励(1964-),女,教授.
Q815
A
1674-1404(2016)04-0254-05
