Slit2在非酒精性脂肪肝中的作用
2016-08-31曾翠玲郑凌云邢丽英李香莉王丽京
曾翠玲,郑凌云,邢丽英,李香莉,王丽京
(广东药学院,血管生物学研究所,广州 510006)
Slit2在非酒精性脂肪肝中的作用
曾翠玲,郑凌云,邢丽英,李香莉,王丽京
(广东药学院,血管生物学研究所,广州 510006)
目的探讨Slit2蛋白在非酒精性脂肪肝中的作用。方法选取8周龄雄性LDLR-/-小鼠和LDLR-/-;Slit2-Tg小鼠,各6只,高脂喂养12周建立NAFLD模型后,眼眶静脉丛取血测定血清TC,TG,LDL-C,HDL-C的水平,取肝脏组织做切片染色观察病理改变并提取肝组织RNA用QPCR分析LDLR-/-小鼠和LDLR-/-;Slit2-Tg小鼠脂代谢相关基因的表达水平。结果LDLR-/-;Slit2-Tg小鼠血清中LDL-C水平明显低于LDLR-/-小鼠;与LDLR-/-小鼠相比, LDLR-/-;Slit2-Tg小鼠肝脏脂肪变性及肝损伤明显减轻, 且肝脏组织脂代谢相关基因表达明显减少。结论Slit2蛋白减轻了小鼠肝组织的病理损伤。
Slit2;非酒精性脂肪肝;脂代谢
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是指除酒精和其他明确的损肝因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[1]。随着生活水平的改善、生活方式的改变、肥胖患者的增加,NAFLD的发病率不断攀升,目前已成为全球慢性肝脏疾病的首要病因。其危害在于部分患者可进而发展为肝纤维化、肝硬化甚至肝癌,并易于并发心脑血管疾病而导致相关的致死致残率上升[2-4]。因此,研究NAFLD肝脂肪变性的发病机制具有十分重要的临床意义。
Slit2是一种最早从果蝇体内发现的分泌型细胞外基质蛋白,通过结合细胞膜上的roundabout(Robo)受体家族发挥作用。Slit/Robo信号作为神经导向因子在神经系统中的作用已经被阐述明确, 研究表明Slit/Robo信号还参与多种生理病程,如抑制白细胞趋化,参与血管的发生及肿瘤新生血管的形成[5-7]。我们实验室的前期研究也发现Slit2/Robo1信号在肝纤维化中具有重要作用,Slit2蛋白过表达可以促进小鼠肝纤维化发生,而slit2阻断剂治疗后可明显减轻小鼠肝纤维化[8],而Slit2蛋白在NAFLD中是否也有重要作用未见报道。本文选用Slit2蛋白过表达的LDLR-/-小鼠(即LDLR-/-;Slit2-Tg小鼠)为研究对象,以LDLR-/-小鼠为对照组,通过高脂喂养建立NAFLD模型,观察Slit2蛋白在NAFLD中的作用。
1 材料和方法
1.1材料
1.1 .1实验动物
LDLR-/-小鼠(B6.129S7-Ldlrtm1Her/J)12只(雄性4只,雌性8只)购自美国Jackson实验室,货号:002207。Slit2过表达小鼠(Slit2-Tg小鼠),由上海生命科学院构建赠送[9],共6只,6~8周龄。LDLR-/-小鼠与Slit2-Tg小鼠杂交后所得LDLR-/-;Slit2-Tg小鼠,通过6~8代回交且繁殖稳定后,用于本研究。所有小鼠均在广东药学院实验动物中心SPF级动物房饲养扩群【SYXK(粤)2012-0125】。
1.1.2仪器及试剂
试剂:甲醇、乙醇、异丙醇和苏木素-伊红染色套装( 康龙生物),琼脂糖(Biowest),PCR引物(Invitrogen),PCR Mix(Thermo),酶法血脂四项测定试剂盒(北京中生北控), RNA提取试剂盒(Takara),反转录试剂盒(Takara);2xRT SYBR Green Master Mix(Takara)。
仪器:组织包埋机(莱卡)、石蜡切片机(莱卡);PCR仪( 美国应用生物系统公司);荧光定量PCR仪(Bio-Rad);光学显微镜(Olympus);低温离心机 (Thermo);超速离心机(Beckman);制冰机( 北京长流科学仪器有限公司);凝胶成像仪(GE);电泳仪(Bio-Rad);旋转混合仪( 宁波新芝生物科技有限公司);超纯水系统(Millipore)。
1.2方法
1.2.1LDLR-/-小鼠的鉴定
剪取3周龄小鼠尾尖部约1 cm ,置于1 mL离心管中,加入180 μL 50 mmol/L的NaOH,100℃水浴裂解30 min后加入20 μL 1 mmol/L的Tri-HCL 充分混匀,离心所得上清液即为提取的DNA。将提取的DNA按以下条件鉴定:LDLR-/-基因引物P1:AATCCATCT TGTTCAATGGCCGATC;LDLR-/-基因引物P2:CCATATGCATCCCCAGTCTT;LDLR-/-基因引物P3:GCGATGGATACACTCACTGC。PCR反应条件为94℃预变性3 min,94℃变性30 s,65℃退火1 min,72℃延伸1 min,循环35次,72℃充分延伸2 min。PCR产物经琼脂糖凝胶电泳后用凝胶成像系统观察电泳结果: LDLR-/-基因的扩增产物片段长度约为350 bp,野生型扩增产物片段长度约为167 bp。
1.2.2LDLR-/-;Slit2-Tg小鼠的鉴定
LDLR-/-;Slit2-Tg小鼠的鉴定分为两部分,第一部分鉴定LDLR-/-基因,鉴定步骤见1.2.1;第二部分鉴定Slit2基因,Slit2基因的鉴定条件:Slit2基因引物P1: CCCTCCGGATCCTTTACCTGTCAAGG TCCT,Slit2基因引物P2: TGGAGAGAGCTCACAG AACAAGCCACTGTA。PCR反应条件为94℃预变性4 min,94℃变性45 s,60℃退火45 s,72℃延伸45 s,循环35次,72℃充分延伸10 min。PCR产物经琼脂糖凝胶电泳后用凝胶成像系统观察电泳结果。Slit2基因的扩增产物片段长度约为600 bp。在350 bp和600 bp处均有扩增产物的为LDLR-/-;Slit2-Tg小鼠。
1.2.3NAFLD动物模型构建
LDLR-/-小鼠与 LDLR-/-;Slit2-Tg小鼠每组各6只,8周龄左右,均为雄性,对照组给予普通饲料,模型组进行高脂饲料(普通饲料87.5%,猪油10%,胆酸盐0.5%,胆固醇2%)喂养12周建立NAFLD动物模型。高脂饲料喂养12周后取材,取材前一天禁食12 h,对各组小鼠分别进行眼眶静脉丛取血并取肝脏组织用于下一步实验。
1.2.4小鼠血脂分析
用北京中生北控血脂测定试剂盒,参照试剂盒说明书测定小鼠血脂,通过酶标仪测定相应的吸光值。TC,TG和HDL-C的浓度分别根据吸光度直接计算得出,TG<4.5 mmol/L时,LDL-C浓度由Friedewald公式法推算得到,LDL-C=TC-(HDL-C+TG/2.2)。
1.2.5小鼠肝脏组织病理学观察
用颈椎脱臼法处死小鼠,分别取对照组和模型组LDLR-/-小鼠与LDLR-/-;Slit2-Tg小鼠肝脏组织进行固定,经脱水后石蜡包埋、切片,进行HE染色,镜下观察各组肝脏组织的病理改变。
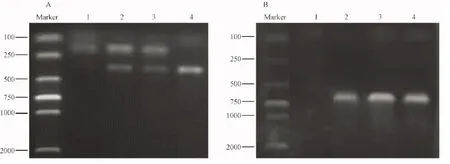
注:Marker: DNA marker 2000;1~4号为子代小鼠DNA扩增结果,其中1号为野生型小鼠;2和3号小鼠为LDLR+/-;Slit2-Tg小鼠,4号小鼠为 LDLR-/-;Slit2-Tg小鼠。图1 LDLR-/-小鼠与 LDLR-/-;Slit2-Tg小鼠鉴定图Note: Marker: DNA marker 2000;1~4:Identification results of the offsprings by PCR,No.1 is wild type mouse,No.2,3 are LDLR+/-;Slit2-Tg mice,No.4 is LDLR-/-;Slit2-Tg mouse.Fig.1 PCR results of LDLR gene and Slit2 gene for identification of LDLR-/- mice and LDLR-/-;Slit2-Tg mice
1.2.6小鼠肝组织脂代谢相关基因mRNA表达
分别取高脂饲料喂养12周后的LDLR-/-小鼠和LDLR-/-;Slit2-Tg小鼠肝组织,Trizol裂解法抽提总RNA。每个样品以1 μg RNA按Takara的试剂盒说明书进行反转录得到cDNA。采用Takara的SYBR Green试剂盒检测脂代谢相关基因LXR-α,LXR-β,SREBP-1c和FAS的表达水平。引物序列:Mouse GAPDH,5′-GGTGAAGGTCGGTGTGAACG-3′(Forward),5′-CTCGCTCCTGGAAGATGGTG-3′(Reverse), 产物大小233 bp;Mouse LXR-α,5′-CTCAATGCCTGATGTTTCTCCT-3′(Forward), 5′-TCCAACCCTATCCCTAAAGCAA-3′(Reverse),产物大小150 bp;Mouse LXR-β,5′-ATGTCTTCCCCC ACAAGTTCT-3′(Forward), 5′-GACCACGATGT AGGCAGAGC-3′(Reverse),产物大小156 bp;Mouse SREBP-1c,5′-GCAGCCACCATCTAGCCTG-3′(Forward), 5′-CAGCAGTGAGTCTGCCTTGAT-3′(Reverse),产物大小199 bp;Mouse FAS,5′-GGAGGTGGTGATAGCCGGTAT-3′(Forward),5′-TGGGTAATCCATAGAGCCCAG-3′(Reverse),产物大小140 bp。 Realtime PCR 反应条件为:95℃预变性10 min,94℃变性30 s,60℃退火30 s,72℃延伸30 s,循环40次。测得的阈循环(threshold cycle, Ct值),根据公式△Ct=[ Ct(目的基因)]-[ Ct(GAPDH)]和△△Ct=[△Ct(实验组)]-[△Ct(对照组)],计算出2-△△Ct,反应目的基因表达水平。
1.2.7统计学处理
2 结果
2.1LDLR-/-小鼠与 LDLR-/-;Slit2-Tg 小鼠的鉴定结果
将LDLR-/-小鼠和Slit2-Tg小鼠杂交。对其F2代进行LDLR基因和Slit2基因的鉴定, LDLR-/-小鼠基因条带为350 bp,LDLR+/+小鼠基因条带为167 bp; Slit2-Tg小鼠基因的条带为600 bp。图1A为LDLR基因的鉴定图,4号小鼠是LDLR-/-小鼠。图1B为Slit2基因的鉴定图,2~4号小鼠为Slit2-Tg小鼠。综上,1号小鼠为野生型小鼠,2和3号小鼠为LDLR+/-;Slit2-Tg小鼠,4号小鼠为LDLR-/-;Slit2-Tg小鼠。
2.2Slit2过表达对高脂诱导的小鼠血脂水平的影响
8周龄左右的雄性LDLR-/-小鼠(n=6)与 LDLR-/-;Slit2-Tg小鼠(n=6)进行高脂饲料喂养12周后,小鼠血清甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)浓度均比正常饮食情况下增高,而高密度脂蛋白(HDL-C)没有变化。其中LDLR-/-;Slit2-Tg小鼠血清中LDL-C浓度明显低于LDLR-/-小鼠(P<0.01)。

注:与LDLR-/-组相比,** P<0.01。图2 小鼠血清TC、TG、HDL-C、LDL-C 水平(mmol/L,n=6)Note:Compared with the LDLR-/- group,** P<0.01.Fig.2 The serum TC,TG,HDL-C,and LDL-C levels of the mice (mmol/L,n=6)
2.3Slit2过表达对小鼠肝脏组织的影响
HE染色结果显示,普通饲料喂养12周(对照组)的LDLR-/-和LDLR-/-;Slit2-Tg小鼠肝脏组织结构,肝小叶结构清晰,肝细胞索排列整齐,以中央静脉为中心呈放射状排列。肝细胞呈多边形,核大而圆,位于肝细胞中央。高脂饲料喂养12周(模型组)后,LDLR-/-小鼠肝脏组织结构不完整,肝细胞排列紊乱,有些肝细胞肿大变圆,内有脂肪滴,伴气球样变,炎性细胞浸润,部分出现肝细胞水肿,组织坏死。LDLR-/-;Slit2-Tg小鼠也出现肝细胞脂肪变性,但相较于LDLR-/-小鼠明显减轻,肝脏组织结构较完整。
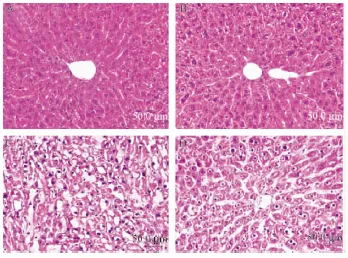
注:A:LDLR-/-小鼠(对照组);B:LDLR-/-;Slit2-Tg小鼠(对照组);C:LDLR-/-小鼠(模型组);D:LDLR-/-;Slit2-Tg小鼠(模型组)。图3 小鼠肝脏HE染色(标尺=50 μm)Note:A:LDLR-/- mice(Control);B:LDLR-/-;Slit2-Tg mice(Control);C:LDLR-/- mice(Model);D:LDLR-/-;Slit2-Tg mice(Model).Fig.3 HE staining of the liver(Bar=50 μm)
2.4Slit2过表达对小鼠脂代谢相关基因表达的影响
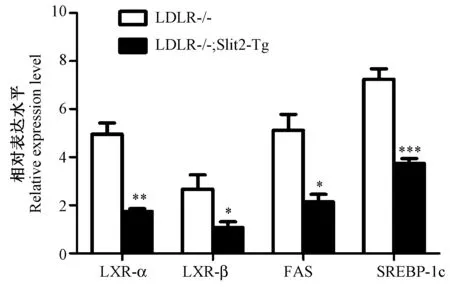
注:与LDLR-/-组相比,*为P≤0.05,**为P≤0.01,***为P≤0.001,(n=6)。LXR-α,肝脏X受体-α;LXR-β,肝脏X受体-β;FAS,脂肪酸合成酶;SREBP-1c,固醇调节元件结合蛋白-1c。图4 高脂喂养12周后小鼠肝脏LXR-α、LXR-β、FAS和SREBP-1c mRNA的表达(n=6) Note:Compared with the LDLR-/- group,*P≤0.05,** P<0.01,*** P≤0.001,(n=6).LXR-α,Liver X receptor-α; LXR-β, Liver X receptor-β; FAS, Fatty acid synthase;SREBP-1c,Sterol regulatory element binding protein-1c.Fig.4 The expression levels of LXR-α、LXR-β、FAS and SREBP-1c mRNA in the liver after 12 weeks of high-fat diet(n=6)
实时定量RT-PCR的方法检测模型组LDLR-/-小鼠与 LDLR-/-;Slit2-Tg小鼠肝脏中与脂代谢通路相关因子mRNA的表达。高脂喂养12周后,与LDLR-/-小鼠相比,LDLR-/-;Slit2-Tg小鼠的LXR-α,LXR-β,SREBP-1c和FAS的mRNA水平都有显著下调。结果显示,LDLR-/-;Slit2-Tg小鼠的LXR-β和FAS的表达明显下降(P<0.05),LXR-αmRNA的差异更显著(P<0.01),SREBP-1c在LDLR-/-小鼠与 LDLR-/-;Slit2-Tg小鼠肝脏中表达差异最明显(P<0.001)。
3 讨论
NAFLD的发生与遗传,环境,代谢密切相关,根据病因分原发性和继发性两大类,原发性NAFLD与肥胖、糖尿病及高脂血症等有关,继发性NAFLD则由某些特殊原因所致,如药物、毒物、减肥手术等[10]。随着高血脂症发病率的逐年上升, 大量研究证实高脂血症是诱发脂肪肝的主要因素[11-12]。NAFLD的发病机制至今尚未完全阐明,目前多认为其致病机制涉及胰岛素抵抗、氧化应激、细胞凋亡和脂肪因子等多重打击过程。目前较为公认的是1998年Day和James提出的二次打击学说,认为一次打击是多种原因导致的肝脂代谢紊乱,引起肝脂肪变性。二次打击则是由于肝脏脂肪变性,抗损伤能力下降,进而发展为脂肪性肝炎(NASH)、肝纤维化甚至肝癌。其中脂质代谢紊乱引起肝脂沉积是NAFLD发生的关键环节[13-15]。脂代谢信号转导途径错综复杂,近年来研究发现,LXR-α信号转导途径和SREBP-1c信号转导途径的紊乱在高脂血症和脂肪肝的形成中具有重要的作用[16]。
本实验采用LDLR-/-小鼠,通过高脂喂养建立了一种NAFLD模型,结果显示高脂喂养12周后,血清TG、TC、LDL-C浓度均比正常饮食情况下增高,表现出高血脂的特征,肝脏病理形态表现出明显的脂肪肝。同时利用LDLR-/-小鼠和Slit2蛋白过表达小鼠杂交建立了稳定遗传的LDLR-/-;Slit2-Tg小鼠,观察Slit2对血脂,肝脏病理改变及脂代谢相关基因的影响。
Slit2及其受体Robo1主要表达在中枢神经系统,现在研究发现Slit2/Robo1在非神经系统中也有表达,在很多肿瘤及血管性疾病中都有Slit2/Robo1的异常表达。研究发现Slit2在肝脏和肝癌细胞株的表达差异与肿瘤分期和分化程度相关,Slit2在晚期肝癌及低分化肝癌中表达明显上调,在肝癌组织中表达明显高于癌旁组织[17-18]。我们实验室前期研究也分别在临床和肝纤维化小鼠模型中证实Slit2在纤维化的肝脏组织表达明显高于正常肝组织,Slit2蛋白过表达可以促进小鼠肝纤维化发生[8],但是Slit2在NAFLD中的作用尚未见报道。本研究结果发现,高脂喂养12周后,与LDLR-/-小鼠相比,Slit2蛋白过表达的LDLR-/-小鼠血清LDL-C水平明显降低,肝脏脂肪变性明显减轻。LDLR是一种细胞膜表面的糖蛋白,存在于哺乳动物和人体几乎所有的细胞表面上,但以肝细胞上最为丰富,其主要功能是通过摄取胆固醇进入细胞内来调节血浆胆固醇水平。LDLR功能缺陷引起血脂尤其是LDL和VLDL的清除途径受阻,进而抑制了肝内脂类向肝外组织的转运,是高胆固醇血症和脂肪肝的主要原因之一[19]。我们结果说明Slit2蛋白主要通过降低血清LDL-C水平,减轻肝脏的脂肪变性。研究表明LXR-α激活可以促进脂肪合成相关基因如脂肪酸合成酶(FAS),乙酰辅酶A羧化酶(ACC)和硬脂酰辅酶A去饱和酶(SCD-1)的表达,促进脂肪酸的从头合成,进而导致肝脏脂肪变性和高胆固醇血症[20-21]。同时LXR-α可激活SREBP-1c,上调FAS的基因转录促进脂肪酸合成[22-23]。我们研究结果显示,Slit2蛋白过表达后脂代谢相关基因LXR-α和SREBP-1c基因表达均明显下降。研究初步表明Slit2过表达可能通过抑制LXR-α—SREBP-1c—FAS信号轴抑制脂肪酸的合成,降低肝脏脂质及血脂水平。
综上所述Slit2过表达可以减轻肝脏脂肪变性,降低血脂水平,其机制可能是抑制LXR-α—SREBP-1c—FAS信号轴,抑制脂肪酸的合成。因此本研究为预防或治疗脂肪肝提供新的线索,也为研究开发治疗脂肪肝药物提供了新的靶点。
[1]Angulo P. Nonalcoholic fatty liver disease[J].N Engl J Med, 2002,346(16): 1221-1231.
[2]Shen L, Fan JG, Shao Y,etal. Prevalence of nonalcoholic fatty liver among administrative officers in Shanghai: an epidemiological survey[J].World J Gastroenterol,2003,9(5):1106-1110.
[3]Vernon G, Baranova A, Younossi ZM. Systematic review: The epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults[J].Aliment Pharmacol Ther,2011,34(3):274-285.
[4]Caldwell S,Argo C. The natural history of non-alcoholic fatty liver disease [J].Dig Dis,2010,28(1):162-168.
[5]Li HS, Chen JH, Wu W,etal. Vertebrate slit, a secreted ligand for the transmembrane protein roundabout,is a repellent for olfactory bulb axons[J].Cell,1999,96(6):807-818.
[6]Chedotal A.Slits and their receptors[J].Adv Exp Med Biol,2007,621:65-80.
[7]Dickinson RE, Duncan WC. The SLIT-ROBO pathway: a regulator of cell function with implications for the reproductive system[J].Reproduction,2010, 139(4):697-704.
[8]Jianlan Chang, Tian Lan, Changzheng Li,etal. Activation of Slit2-Robo1 signaling promotes liver fibrosis[J].Journal of Hepatology,2015,63(6): 1413-1420.
[9]Han HX,Geng JG.Over-expression of Slit2 induces vessel formation and changes blood vessel permeability in mouse brain[J].Acta Pharmacol Sinica,2011,32(11):1327-1336.
[10]Inzucchi SE, Petersen KF, Shulman GI. Nonalcoholic fatty liver disease[J]. N Engl J Med,2002,347(10):768-769.
[11]Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults[J].Aliment Pharmacol Ther,2011,34(3):274-285.
[12]Sharabi M, Eldad A. Nonalcoholic fatty liver disease is associated with hyperlipidemia and obesity[J].Am J Med ,2000,109(2):171.
[13]Takahashi Y, Sugimoto K, Inui H,etal. Current pharmacological therapies for nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J].World J Gastroenterol,2015,21(13):3777-3785.
[14]Polyzos SA, Kountouras J, Zavos C.Nonalcoholic fatty liver disease: the pathogenetic roles of insulin resistance and adipocytokines[J].Curr Mol Med,2009,9(3):299-314.
[15]Day CP.Non-alcoholic fatty liver disease: a massive problem[J].Clin Med, 2011,11(2):176-178.
[16]Higuchi N, Kato M, Shundo Y,etal. Liver X receptor in cooperation with SREBP-1c is a major lipid synthesis regulator in nonalcoholic fatty liver disease[J].Hepatol Res,2008,38(11):1122-1129.
[17]Mehmet Ender Avci,Ozlen Konu,Tamer Yagci,etal. Quantification of SLIT-ROBO transcripts in hepatocellular carcinoma reveals two groups of genes with coordinate expression[J].BMC Cancer,2008,8(1):1-11.
[18]Wang B, Xiao Y, Ding BB,etal. Induction of tumor angiogenesis by Slit-Robo signaling and inhibition of cancer growth by blocking Robo activity[J].Cancer Cell ,2003,4(1):19-29.
[19]Barrett PH, Watts GF. Shifting the LDL-receptor paradigm in familial hypercholesterolemia: novel insights from recent kinetic studies of apolipoprotein B-100 metabolism[J].Atheroscler Suppl,2002,2(3):1-4.
[20]Chen G, Liang G, Ou J,etal. Central role for liver X receptor in insulin-mediated activation of Srebp-1c transcription and stimulation of fatty acid synthesis in liver[J].Proc Natl Acad Sci U S A,2004,101(31): 11245-11250.
[21]Schultz JR, Tu H, Luk A,etal. Role of LXRs in control of lipogenesis[J].Genes Dev,2000,14(22):2831-2838.
[22]Ferre P, Foufelle F.SREBP-1c transcription factor and lipid homeostasis: clinical perspective[J].Horm Res,2007,68(2):72-82.
[23]Repa JJ, Liang G, Ou J,etal. Regulation of mouse sterol regulatory element- binding protein-1c gene(SREBP-1c) by oxysterol receptors, LXRalpha and LXRbeta[J].Genes Dev,2000,14(22):2819-2830.
Effect of Slit2 on nonalcoholic fatty liver disease
ZENG Cui-ling,ZHENG Ling-yun,XING Li-ying,LI Xiang-li,WANG Li-jing
(Vascular Biology Research Institute,Guangdong Pharmaceutical University,Guangzhou 510006,China)
ObjectiveTo investigate the effect of Slit2 over-expression on nonalcoholic fatty liver disease (NAFLD) in mice. Methods Eight week male LDLR-/-mouse and LDLR-/-;Slit2-Tg mouse were fed a high-fat diet for 12 weeks to induce NAFLD(n=6 per group). After 12 weeks, they were taken for blood samples and dissected. The concentration of TG (triglycerides), TC(total cholesterol), LDL-C(low density lipoprotein cholesterol) and HDL-C(high density lipoprotein cholesterol)in the serum were examined respectively. Liver tissue samples were taken for HE staining to observe the morphological and pathological changes. The mRNA expression levels of hepatic genes related to lipid metabolism such as LXR-α,LXR-β FAS ,SREBP-1c was measured by real-time RT-PCR. Results The serum LDL-C levels of LDLR-/-;Slit2-Tg mouse were significantly lower than that in LDLR-/-mouse(P< 0.01).And the grade of lipid droplets and pathological injury of liver tissue decreased significantly in the LDLR-/-;Slit2-Tg mouse compared with LDLR-/-mouse. Furthermore, The mRNA expression levels of hepatic genes related to lipid metabolism decreased significantly in the LDLR-/-;Slit2-Tg mouse. Conclusions The overexpression of Slit2 can reduce the pathological injury of liver tissue in mouse with NAFLD.
Slit2; NAFLD; Lipid metabolism
国家自然科学基金资助项目(31271455;31200861)。
曾翠玲(1991-),女,硕士生,主要从事心血管疾病研究。Email:zengcuiling0929@163.com。
王丽京,女,博士,教授,研究方向:肿瘤分子生物学。 Email:wanglijing62@163.com。
研究报告
R-332
A
1671-7856(2016) 05-0019-06
10.3969.j.issn.1671-7856. 2016.005.003
2016-02-25
