褐藻酸酶的制备及对海带细胞解离的应用研究
2016-08-30田萍萍崔翠菊刘延岭李晓捷梁广津彭捷李言王利芹山东东方海洋科技股份有限公司国家海藻与海参工程技术研究中心山东省海藻遗传育种与栽培技术重点实验室山东烟台264003
田萍萍,崔翠菊,刘延岭,李晓捷,梁广津,彭捷,李言,王利芹(山东东方海洋科技股份有限公司,国家海藻与海参工程技术研究中心,山东省海藻遗传育种与栽培技术重点实验室,山东 烟台 264003)
褐藻酸酶的制备及对海带细胞解离的应用研究
田萍萍,崔翠菊,刘延岭,李晓捷,梁广津,彭捷,李言,王利芹
(山东东方海洋科技股份有限公司,国家海藻与海参工程技术研究中心,山东省海藻遗传育种与栽培技术重点实验室,山东烟台264003)
摘要:褐藻中富含褐藻酸,应用酶解法制备褐藻单细胞和原生质体时,高活性的褐藻酸酶是所用工具酶中的主要组分。文中介绍了用硫酸铵二级盐析和透析袋脱盐从鲍鱼的消化腺中提取褐藻酸酶的方法,测定酶活力及蛋白含量,检测该褐藻酸酶对海带细胞的解离效果。结果显示,该褐藻酸酶比活力为12 U/mg,酶活力单位为34 U/mL,得率为1.4%。用含此褐藻酸酶的酶解液解离海带细胞,酶解3~6 h内可得到游离单细胞及原生质体的数量在3×105~6×105个/g。该褐藻酸酶解离海带细胞效果显著,且本方法简单、快捷且经济。
关键词:褐藻酸酶;硫酸铵二级盐析;酶活力;海带;原生质体

近几年来,褐藻单细胞和原生质体培养成为褐藻生物技术的新型研究领域,同时也为褐藻育种技术提供了新的途径。游离的单细胞和原生质体通常可以采取机械磨法、愈伤组织和酶解法自藻体获得,但机械法效率低下且细胞损伤大,愈伤组织的获得较难,而酶解法反应条件温和,能使体细胞受到的伤害降到最低程度,故而它是目前最有效的一种获得细胞和原生质体的方法。褐藻的细胞间质及细胞壁中富含褐藻酸(褐藻胶),应用酶解法制备褐藻单细胞和原生质体时,高活性的褐藻酸酶是所用工具酶中的主要部分。
褐藻酸酶又称为褐藻胶裂解酶或褐藻胶酶。目前用于褐藻细胞解离和解壁的褐藻酸酶,都是从海产食藻动物如鲍鱼[1]、海螺[2]、海胆[3]等的消化腺中提取的复合酶。也有作者利用褐藻病烂处的细菌产生的胞外酶[4-5],用于褐藻细胞和原生质体的分离,从褐藻病烂处分离褐藻酸降解菌,需要不断分离鉴定并检验效果,实验繁琐耗时长,不利于一般实验室的应用。而市售的裂解酶多为进口商品,价格昂贵,也不利于实验的推广。本文依据皱纹盘鲍以褐藻如海带为食的特性,详细介绍了从皱纹盘鲍消化腺中提取褐藻酸酶的方法以及褐藻酸酶的活力和蛋白含量的测定方法,并检测了该酶对海带细胞的解离效果。
1 材料和方法
1.1材料
皱纹盘鲍购于烟台大学水产品市场,挑选摄食盛期新鲜健康的皱纹盘鲍,拨开腹足即可见到褐绿色的大型腺体。带回实验室后,用蒸馏水将盘鲍充分洗涤后于-20℃中速冻。
实验用海带采自威海烟墩角海区,剪取其生长部,用灭菌海水及灭菌脱脂棉反复擦拭,置于玻璃培养皿中,于超净工作台中用1.5%KI浸泡两次,每次15 min,备用。
1.2褐藻酸酶的制备
1.2.1匀浆及抽提用手术刀切掉腹足及外套膜后,将露出的褐绿色的腺体整个剥离。在冰盘上剥离消化腺后,置于灭菌培养皿中迅速称重记录。用镊子将消化腺置于玻璃匀浆器底部,加入8~10倍体积4℃预冷的磷酸缓冲液(0.1 mol/L,pH值7.2)进行匀浆,整个匀浆过程必须保持在冰浴环境中,匀浆时间10~20 min,至消化腺全部水融。在低温环境下将组织悬液移入50 mL离心管中,置于4℃冰箱内静置抽提10~13 h或过夜。
1.2.2硫酸铵二级盐析将抽提液配平,用高速冷冻离心机离心(20 000×g,4℃,30 min),留取上清液Ⅰ到烧杯中,在低温环境下将有上清液Ⅰ的烧杯放到磁力搅拌器上,在缓慢搅拌的情况下,逐次加入固体硫酸铵到30%的饱和度。硫酸铵溶解后继续缓慢搅拌约30 min,离心(20 000×g,4℃,30 min),留取上清液Ⅱ到烧杯中,在低温环境下将有上清液Ⅱ的烧杯放到磁力搅拌器上,在缓慢搅拌的情况下,逐次加入固体硫酸铵到90%的饱和度。待硫酸铵全部溶解后继续缓慢搅拌约2~3 h后可过夜静置,离心(20 000×g,4℃,30 min~1 h),留取沉淀,用10~20 mL磷酸缓冲液溶解即得到粗提酶液。
1.2.3透析脱盐
1.2.3.1透析袋预处理本研究透析袋购自北京索莱宝,截留分子量为12 000~14 000 Da。剪取15 cm的透析袋,在2%(m/V)碳酸氢钠和1 mmol/LEDTA (pH为8.0)中煮沸10 min,用蒸馏水漂洗2~3次;再置1 mmol/L EDTA(pH值为8.0)中煮沸10 min,待透析袋冷却,存放于4℃,应确保透析袋始终浸没在液体中。使用前用蒸馏水将透析袋里外加以清洗,从此步起用透析袋时一定要戴手套操作。
1.2.3.2透析脱盐透析袋一端扎紧,加入待透析的溶液及一段玻璃棒(两头烧圆),另一端多回折几次,用透析袋夹夹紧,让透析袋竖立于含透析液及转子的大烧杯中,冰浴环境下磁力搅拌。一天换3~4次透析液,透析2~3 d。透析效果的检测可用1% BaCl2,取一滴加入透析液中,若无白色沉淀生成,证明透析已完成。
1.2.4冻干及保存透析结束后,将复合酶液转入烧杯中,预留2 mL测酶活力和蛋白含量。将复合酶液倒入玻璃平皿中,预先在-20℃速冻,再转入-80℃过夜冷冻后,用五环真空冷冻机制成冻干粉,于-80℃保存备用。
1.3酶学性质测定
1.3.1酶活力的测定
采用3,5-二硝基水杨酸法(DNS法)[6]测定褐藻酸酶的活力。3,5-二硝基水杨酸法是利用褐藻酸酶水解褐藻酸钠,产生葡萄糖醛酸,能将3,5-二硝基水杨酸中的硝基还原成橙黄色的氨基化合物,再利用比色法测定其还原物生成量来表示酶的活力大小。其定义为每分钟催化褐藻酸水解生成1 μg葡萄糖醛酸的酶量为一个活力单位。
1.3.1.1标准曲线的制作精确称取干燥至恒重的葡萄糖100 mg,用重蒸水溶解后定容至100 mL,此溶液的浓度就为1 000 μg/mL。
将1 000 μg/mL的葡萄糖溶液按照表1所示配制成各种不同浓度的葡萄糖溶液。
表1 不同浓度葡萄糖溶液的配制
向1—6管中分别加入3,5-二硝基水杨酸显色液3 mL,在沸水浴中显色15 min,冷却后,再分别加入重蒸水21 mL,充分摇匀,以1号管作为空白对照,在550 nm处比色,读取其余各管光密度值。以光密度值为纵坐标,以葡萄糖微克数为横坐标,绘制标准曲线,计算回归方程。
1.3.1.2样品测定样品测定设空白对照管和测定管,按照表2所示进行操作。
1.3.1.3褐藻酸酶活力计算在上述实验条件下,每分钟催化褐藻酸水解生成1 μg葡萄糖醛酸的酶量定义为一个活力单位。
褐藻酸酶活力单位=n×OD550/30×1
式中,n为稀释倍数,30为反应中糖化所用时间,1为反应中所用的酶液体积。
1.3.2考马斯亮蓝法(Bradford法)测定褐藻酸酶蛋白质的含量[7]
本法依据在酸性溶液中考马斯亮蓝G250与蛋白质分子中的碱性氨基酸(精氨酸)和芳香族氨基酸会结合形成蓝色复合物,在一定范围内其颜色深浅与蛋白质浓度呈正比,以蛋白质对照品溶液作标准曲线,采用比色法测定供试品中蛋白质的含量。
1.3.2.1标准曲线的制作精密量取对照品溶液0.0、0.01、0.02、0.04、0.06、0.08、0.1 mL分别置具塞试管中,各加水至0.1 mL,再分别加入酸性染色液5.0 mL,立即混匀,以0号管作为空白,在595 nm的波长处测定吸光度。以对照品溶液浓度与其相对应的吸光度绘制标准曲线,并计算回归方程。
1.3.2.2样品测定另精密量取供试品溶液0.1 mL,加入酸性染色液5.0 mL,立即混匀。以0号管作为空白,在595 nm的波长处测定吸光度,从回归方程计算样品溶液中的蛋白质浓度,并乘以稀释倍数,即得。
1.4海带细胞解离实验
酶解方法依据Matsumura[8]的方法稍作修改,将事先灭菌好的海带生长部小块,用剪刀剪成1~2 mm2的碎块,取0.3 g置于事先配好的1 mL酶溶液中(0.4 mol/L甘露醇,2%褐藻酸酶,1%纤维素酶,1%果胶酶),在20℃摇床上120 r/min酶解3~6 h。然后用400目筛绢过滤去除未酶解组织块和细胞团,离心(2 000 r/min,10 min)收集游离的单细胞及原生质体,用单细胞或原生质体培养液稀释后,镜检并计数。

表2 褐藻酸酶活力测定加样方法
2 结果
2.1褐藻酸酶制备及酶活力测定
由表3得知,用硫酸铵二次盐析及透析法脱盐冻干得到酶粉,其得率在1.4%,酶活力单位在34 U/ mL,比活力在12 U/mg。第二批比第一批的活力及得率均高,区别是第二批制备复合酶时硫酸铵第二次盐析后在4℃过夜静置,溶液中出现絮状沉淀,离心10 000 g,45 min。结果表明第二次盐析后静置一定时间(5~12 h)且适当延长离心时间对提高酶活有效。

表3 褐藻酸酶的活力测定及得率
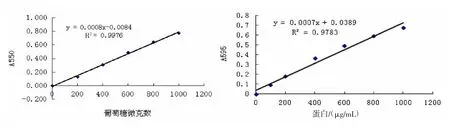
图1 葡萄糖和蛋白质含量测定的标准曲线及其回归方程
2.2褐藻酸酶学性质测定的标准曲线及回归方程
考马斯亮蓝与待测样品混合2 min后检测其吸光值,并在5~20 min内测定光吸收,因为这段时间的颜色最稳定;蛋白-染料复合物会有少量吸附于比色杯壁上,不可使用石英比色皿,因不易洗去,可用塑料或玻璃比色皿,使用后立即用少量95%的乙醇漂洗,以洗去染色。标准曲线会有轻微非线性,对测定结果的影响不大。
2.3褐藻酸酶对海带细胞的解离效果
由图2可知,在酶解3~6 h的时间段内均可获得质量很好,数量较多的单细胞及原生质体。用血球计数板计算每克组织得到的游离单细胞及原生质体的数量在3×105~6×105个/g,可以满足单细胞或原生质体继续培养的数量级要求。

图2 经酶解后游离的海带单细胞(400×)
3 结论
利用硫酸铵二级盐析和透析袋脱盐等纯化方法,从鲍鱼的消化腺中得到的褐藻酸酶的比活力为12 U/mg,酶活力单位为34 U/mL,得率为1.4%。制备过程中收集了30%~90%饱和度硫酸铵的沉淀物,所得到的酶几乎是含有鲍鱼消化腺中所有的水解酶,虽得率不高,但用于海带单细胞及原生质体的分离效果很好,且本方法简单、快捷且经济,一般实验室均可以完成。
4 讨论
值得注意的是,加入硫酸铵时,先少量加入,等完全溶解后再加入新的,避免烧杯底部出现未溶解的盐,局部高浓度的盐溶液易导致酶失活并且搅拌时力度要轻。待硫酸铵全部溶解后继续轻轻搅拌30 min后可静置一段时间,30%饱和度时静置2~3 h,30%~90%饱和度时静置5~6 h或过夜,这样更利于酶蛋白的析出。制备有活力的酶时,均要在冰浴环境下操作,可很大程度的避免酶失活。
透析过程中,透析时间超过2~3 d后,继续透析的话,透析时间越长,酶活降低越多,透析时采用低温环境中磁力搅拌和增大透析液的体积可以加快透析速度,减少酶活损失。
目前从鲍鱼、海螺或海胆中提取酶的报道中,关于酶制备方法的描述较简单,很多实验的细节没有体现。本文详细的描述了从皱纹盘鲍消化腺中提取褐藻酸酶的方法以及实验过程的注意事项,同时给出了褐藻酸酶的活力和蛋白含量的测定方法,并检测了该酶对海带细胞的解离效果,这对于在生产一线的技术人员更具有现实的指导意义。
参照本实验方法制备的褐藻酸酶对海带细胞的解离效果比之前报道的用昂贵的商品酶解离效果甚至要好一些。商品酶的使用对酶解条件和酶解液的离子环境要求很高,而本实验制备的褐藻酸酶的使用条件则更简单,不用再对实验条件进行反复摸索,节省了大量的时间。
实验制备的褐藻酸酶对新鲜幼嫩的海带细胞的解离效果很好,而对较老的材料则要适当提高褐藻酸酶的浓度和酶解时间,较老的材料中胶状杂质稍多一些,这可能与海带生长期间褐藻胶的含量变化有关。
参考文献:
[1]Yamaguchi K,Araki T,Aoki T,et al.Algal cell wall-degrading enzymes from viscera of marine animals[J].Nippon Suisan Gakkaishi,1929(55):105-110.
[2]Liu W.,Y.Tang,X.Liu,et al.Studies on the preparation and on the properties of sea snail enzymes[J].Hydrobiologia,1984(116/117):319-320.
[3]Saga N,Sakai Y.Isolation of protoplasts from Laminaria and Porphyra[J].Bull Jap Soc Sci Fish,1984,50(6):1085.
[4]Araki T.Morishita T.Fusion of protoplasts from wild type Porphyra yezoensis and green type P.tenera thalli(Rhodophyta)[J].Nippon Suisan Gakkaishi,1990,56(7):1161.
[5]Fujita Y,Migita S.Fusion of protoplasts from thalli of two different color types in Porphyra yezoensis U.and development of fusion products[J].Jpn.J.Phycol.,1987(35):201-208.
[6]Bradford,M.M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Anal.Biochem,1976(717):1448-1454.
[7]Nakada,H.T.,Sweany,P.C.Alginic acid degradation by eliminases from abalone hepatopancreas[J].J.Biol.Chem,1967 (242):845-851.
[8]Matsumura W.Efficient isolation and culture of viable protoplasts from Laminaria longissima Miyabe(Phaeophyceae)[J]. Bulletin of the Faculty of Fisheries,Hokkaido University,1998,49(3):85-90.

资助项目:国家科技支撑计划项目(2012BAD55G01);国家高技术研究发展计划(863计划)项目(2012AA10A406);烟台市科技发展计划项目(2013LGS002)
中图分类号:Q176
文献标志码:A
文章编号:1004-2091(2016)07-0010-05
doi:10.3969/j.issn.1004-2091.2016.07.003
收稿日期:(2015-12-14)
作者简介:田萍萍(1983-),女,硕士,工程师,主要从事海藻遗传育种工作.E-mail:pptian2010@163.com
Alginase preparation and application for dissociation of kelp cells
Tian Pingping,Cui Cuiju,Liu Yanling,Li Xiaojie,Liang Guangjin,Peng Jie,Li Yan,Wang Liqin
(Shandong Oriental Ocean Sci-tech Co.Ltd,National Alage and Sea cucumber Project Technology Research Centre,Algae Genetic Breeding and Cultivation Technology Key Laboratory of Shandong Province,Yantai 264003,China)
Abstract:Brown algae is rich in algin,to obtain single cell and protoplast from brown algae by enzyme hydrolysis,high active alginase is the main component of the enzyme used.The method of extracting alginase from digestive gland of abalone by secondary salting out with ammonium sulfate and desalination with dialysis bag was introduced in detail.The enzyme activity and protein content were determined.The effect of disintegration seaweed cells was tested.The results showed that specific activity of alginase is 12 U/mg,the unit of enzyme is 34 U/mL and the yield is about 1.4%.To dissociate kelp cells with the enzymes containing alginase prepared,3× 104~6×105free cell and protoplasts per gram of kelp tissue digested within 3 to 6 hours.The alginase obtained showed remarkable effect for digest kelp cells and this preparation method is simple,quick and economic.
Key words:alginase;secondary salting out with ammonium sulfate;enzyme activity;kelp;protoplast
