淋巴细胞功能相关抗原-1调节Treg细胞对炎症性肠病的疗效观察*
2016-08-30费先艳张新于成功
费先艳张 新于成功,2▲
南京大学医学院附属鼓楼医院消化科1(210008) 南京医科大学鼓楼临床学院2
淋巴细胞功能相关抗原-1调节Treg细胞对炎症性肠病的疗效观察*
费先艳1#张新1于成功1,2▲
南京大学医学院附属鼓楼医院消化科1(210008)南京医科大学鼓楼临床学院2
背景:Treg细胞对炎症性肠病(IBD)具有免疫保护作用,淋巴细胞功能相关抗原-1(LFA-1)参与了IBD时Treg 细胞的分化和迁移。目的:探讨LFA-1调节Treg细胞对IBD疗效的影响。方法:将LFA-1基因缺失小鼠和相同遗传背景野生型小鼠各20只分别随机分为炎症组和治疗组。小鼠饮用2.5% DSS溶液诱导结肠炎模型,治疗组小鼠通过尾静脉回输体外诱导的Treg细胞。观察小鼠一般情况和结肠组织学表现,流式细胞术检测外周血、脾脏、肠系膜淋巴结中Treg细胞比例,ELISA法检测血清TGF-β1、IL-10、IL-17A、IFN-γ水平,实时PCR检测结肠组织TGF-β1、IL-10 mRNA表达。结果:LFA-1缺失治疗组结肠组织学评分与野生型治疗组无明显差异。LFA-1缺失治疗组肠系膜淋巴结Treg细胞比例显著高于相应炎症组(P<0.05);LFA-1缺失治疗组外周血、脾脏、肠系膜淋巴结Treg细胞比例显著低于野生型治疗组(P<0.05)。与相应炎症组相比,野生型和LFA-1缺失治疗组血清TGF-β1、IL-10以及结肠组织TGF-β1 mRNA表达显著升高(P<0.05),IL-17A、IFN-γ以及IL-10 mRNA表达显著降低(P<0.05)。野生型治疗组血清TGF-β1、IL-10以及TGF-β1、IL-10 mRNA表达显著高于LFA-1缺失治疗组(P<0.05),IL-17A、IFN-γ显著降低(P<0.05)。结论:LFA-1参与了Treg细胞功能的调控,能促进Treg细胞分泌抗炎因子TGF-β1、IL-10等。Treg细胞治疗LFA-1缺失结肠炎小鼠的疗效低于野生型小鼠,可能与Treg细胞功能和细胞因子的分泌受到抑制相关。
淋巴细胞功能相关抗原1;T淋巴细胞,调节性;炎症性肠病;细胞因子类
Correspondence to:YU Chenggong,Email:chenggong_yu@nju.edu.cn.
Background:Treg cells play an immunoprotective role in inflammatory bowel disease (IBD).Lymphocyte function-associated antigen-1 (LFA-1) is involved in the differentiation and migration of Treg cells in IBD.Aims:To investigate the efficacy of LFA-1 on IBD by regulating Treg cells.Methods:Twenty LFA-1 gene knockout (LFA-1-/-) mice and 20 wild type mice with same genetic background were randomly divided into colitis group and treatment group,respectively.Colitis model was induced by drinking 2.5% DSS solution.Mice in treatment group were injected with Treg cells induced in vitro through the tail vein.General condition and colon histology were examined.Percentages of Treg cells in peripheral blood,spleen and mesenteric lymph node were detected by flow cytometry.Serum levels of TGF-β1,IL-10,IL-17A and IFN-γ were measured by ELISA.mRNA expressions of TGF-β1 and IL-10 in colon tissue were detected by real time PCR.Results:No significant difference in colon histological score was found between LFA-1-/-treatment group and wild type treatment group.Percentage of Treg cells in mesenteric lymph node in LFA-1-/-treatment group was significantly higher than that in LFA-1-/-colitis group (P<0.05).Percentages of Treg cells in peripheral blood,spleen and mesenteric lymph node in LFA-1-/-treatment group were significantly lower than those in wild type treatment group (P<0.05).Compared with corresponding colitis group,serum levels of TGF-β1,IL-10 and colon tissue TGF-β1 mRNA expression in wild type treatment group and LFA-1-/-treatment group were significantly increased (P<0.05),levels of IL-17A,IFN-γ and expression of IL-10 mRNA were significantly decreased (P<0.05).Serum levels of TGF-β1,IL-10 and expressions of TGF-β1,IL-10 mRNA in wild type treatment group were significantly increased when compared with LFA-1-/-treatment group (P<0.05),levels of IL-17A and IFN-γ were significantly decreased (P<0.05).Conclusions:LFA-1 is involved in the regulation of Treg cells function,and can induce the secretion of anti-inflammatory cytokines TGF-β1 and IL-10.The efficacy of Treg cells in LFA-1-/-colitis mice is inferior to that in wild-type colitis mice,which may be related to the inhibiting of LFA-1 function and secretion of cytokines.
炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD),主要表现为慢性非特异性肠道炎症,其病因和发病机制不明。目前认为环境、微生物、免疫、遗传等因素参与了IBD的发病过程。异常的免疫应答能引起肠道对微生物免疫耐受的失调,进而导致肠道组织损伤、炎症的发生发展[1]。CD4+CD25+Foxp3+调节性T细胞(Treg细胞)在维持肠道免疫耐受和控制肠道炎症中起有重要作用,动物模型和临床研究均已证实Treg细胞的缺失或功能异常与IBD病因学相关[2]。研究发现,外源性输注Treg细胞能通过抑制免疫应答而控制IBD病情进展[3]。淋巴细胞功能相关抗原-1(lymphocyte function-associated antigen-1,LFA-1)为淋巴细胞活化的重要协同刺激受体,可影响淋巴细胞激活、增殖、分化[4-5]。近年研究表明,LFA-1参与了Treg细胞的分化与功能调节,其表达是Treg细胞发挥抑制功能的必要条件[6-8]。本研究的前期研究[9]发现,LFA-1参与了IBD时Treg细胞的分化和迁移。本研究采用葡聚糖硫酸钠(DSS)诱导结肠炎小鼠模型[10-11],观察回输体外诱导生成的Treg细胞对LFA-1基因缺失结肠炎的疗效,旨在明确LFA-1对Treg细胞功能的影响。
材料与方法
一、实验动物和主要试剂
SPF级LFA-1基因缺失C57BL/6J小鼠和相同遗传背景野生型C57BL/6J小鼠(美国杰克逊实验室)各20只,雌雄各半,8~10周龄,体质量18~23 g,饲养于南京鼓楼医院动物实验中心。
DSS(MP Biomedicals,LL.C),重组小鼠细胞因子IL-2、重组人细胞因子TGF-β1(RD),CD3、CD28单克隆抗体、Foxp3破膜固定套盒、FITC标记抗鼠CD4抗体、APC标记抗鼠CD25抗体、PE标记抗鼠CD62L、Foxp3抗体(eBioscience,Inc.),CD4+CD62L+naïve T磁珠分选试剂盒、CD4+CD25+Regulatory T磁珠分选试剂盒(Miltenyi Biotech),小鼠TGF-β1、IL-10、IL-17A、IFN-γ ELISA试剂盒(上海韵涵生物科技有限公司),TRizol裂解液、逆转录和荧光定量PCR试剂盒(TAKARA BIO INC.)。
二、研究方法
1.磁珠分选CD4+CD62L+naïve T细胞和纯度检测:无菌取2~3只小鼠脾脏并获取单个核细胞悬液,取1×108个细胞用于分选和纯度检测。
2.naïve T细胞体外诱导Treg细胞:分选前一天用无菌PBS包被96孔板,包被液中分别加入CD28单抗1 μg/mL和CD3单抗0.5 μg/mL,封板,4 ℃过夜备用。分选得到的naïve T细胞加入AIM-V培养基将密度调整至1×106/mL,将细胞悬液以每孔200 μL加入96孔板,37 ℃ 5% CO2细胞培养箱培养4~5 d。取部分细胞用于检测Foxp3诱导比例,剩余细胞计数后以CD4+CD25+Treg细胞磁珠分选后用于治疗组小鼠的回输。
3.流式细胞术检测Foxp3诱导比例:取体外培养的细胞0.3×106~1×106个至不同流式管,同时单标管均取一管未染色细胞作为同型对照,具体检测步骤按说明书操作。
4.磁珠分选CD4+CD25+Treg细胞和纯度检测:将培养后的细胞用Treg试剂盒进行分选,按流式抗体标记说明书行Treg细胞的纯度检测。
5.动物分组、模型制备和标本获取:将LFA-1基因缺失小鼠和野生型小鼠分别随机分为炎症组和治疗组,每组10只。四组小鼠均饮用2.5% DSS溶液5 d诱导结肠炎模型,第6天开始治疗组小鼠通过尾静脉注射0.5×106个Treg细胞后正常饮水,炎症组小鼠通过尾静脉注射等体积PBS溶液后正常饮水。实验过程中观察小鼠精神、活动、饮食、排便情况,隔日记录体质量,第8天眼眶取血,记录末次体质量后处死小鼠。
学术性数据库在“研究性教学”中的意义——新时代语境下本科生“学术性学习”研究系列之一 ………………… 简圣宇(2/62)
6.组织学评分:取回盲部至肛门口段全结肠,参照Dutra等[12]的标准行组织学评分。黏膜正常,无炎症,0分;黏膜稍不规则,极少量白细胞浸润,1分;黏膜不规则,少量白细胞浸润,2分;黏膜紊乱,大量白细胞浸润,血管密度高,结肠壁增厚,3分; 黏膜紊乱,白细胞透壁浸润,杯状细胞减少,血管密度高,结肠壁增厚,4分。
7.外周血、脾脏、肠系膜淋巴结中Treg细胞的检测:具体检测方法按试剂盒说明书进行。
8.实时PCR法检测结肠组织TGF-β1、IL-10 mRNA表达:抽提结肠组织总RNA,逆转录成cDNA,行实时PCR。TGF-β1、IL-10和内参GAPDH引物由Sangon公司合成。TGF-β1:F 5’-ATT CCT GGC GTT ACC TTG G-3’,R 5’-AGC CCT GTA TTC CGT CTC CT-3’;IL-10:F 5’-GCC TTA TCG GAA ATG ATC CA-3’,R 5’-AGG GTC TTC AGC TTC TCA CC-3’;GAPDH:F 5’-CAT GGC CTT CCG TGT TCC TA-3’,R 5’-TGT CAT CAT ACT TGG CAG GTT TCT-3’。具体步骤按荧光定量试剂盒说明书操作。以2-ΔΔCt法计算目的基因mRNA相对表达量。
9.ELISA法检测血清TGF-β1、IL-10、IL-17A、IFN-γ水平:具体步骤参照试剂盒说明书进行。
结 果
一、体外Treg细胞的诱导和检测
CD4+CD62L+naïve T细胞纯度>95%(图1A)。分选出的naïve T细胞在IL-2和TGF-β1作用下诱导为iTreg细胞,其特异性转录因子Foxp3诱导的比例约70%(图1B),Treg细胞纯度>99%(图1C)。
二、一般情况以及结肠大体和组织学表现
造模第3天,四组小鼠开始出现精神萎靡、饮食减少、体质量下降,第4天时四组均有部分小鼠出现肉眼血便。改为正常饮水后,炎症组小鼠精神饮食稍有改善,但体质量仍呈下降趋势;治疗组小鼠精神饮食较炎症组改善明显,体质量下降不明显且最后呈上升趋势。
野生型炎症组结肠组织学评分显著高于相应治疗组(P=0.031 3),而LFA-1缺失炎症组和治疗组相比差异无统计学意义(P=0.063 3)。两组治疗组结肠组织学评分差异无统计学意义(P=0.148 9)(表1、图2)。野生型和LFA-1缺失炎症组小鼠体质量和终末结肠长度较相应治疗组明显降低(P=0.000 1,P=0.000 3);两组治疗组体质量下降差异无统计学意义(P=0.739 6),终末结肠长度差异有统计学意义(P=0.024 7)(表1)。
三、外周血、脾脏、肠系膜淋巴结中Treg细胞比例
LFA-1缺失治疗组外周血、脾脏、肠系膜淋巴结Treg细胞比例显著低于野生型治疗组(P=0.000 5,P=0.000 1,P=0.000 2);野生型治疗组外周血、脾脏、肠系膜淋巴结Treg细胞比例显著高于相应炎症组(P=0.000 1,P=0.000 1,P=0.000 2);LFA-1缺失治疗组外周血、脾脏Treg细胞比例与相应炎症组差异无统计学意义(P=0.180 5,P=0.175 0),但肠系膜淋巴结Treg细胞比例显著高于相应炎症组(P=0.000 5)(表2)。
四、血清TGF-β1、IL-10、IL-17A、IFN-γ水平
LFA-1缺失治疗组和野生型治疗组血清TGF-β1、IL-10水平显著高于相应炎症组(P<0.05);IL-17A、IFN-γ水平显著低于相应炎症组(P<0.05)。LFA-1缺失治疗组血清TGF-β1、IL-10水平显著低于野生型治疗组(P<0.05),IL-17A、IFN-γ水平显著高于野生型治疗组(P<0.05)(图3)。
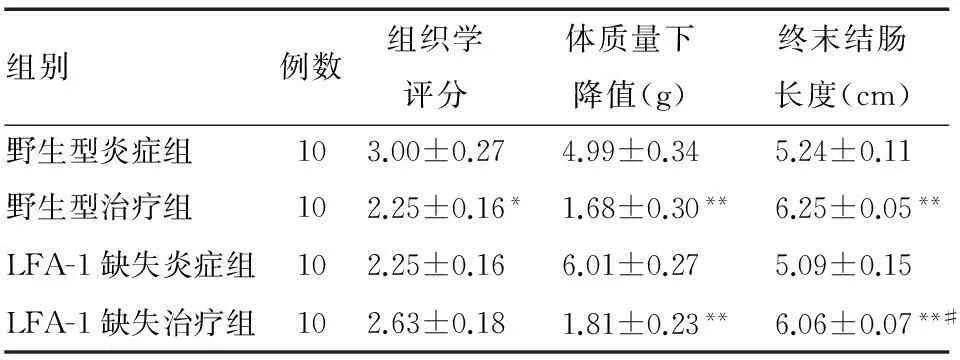
组别例数组织学评分体质量下降值(g)终末结肠长度(cm)野生型炎症组103.00±0.274.99±0.345.24±0.11野生型治疗组102.25±0.16*1.68±0.30**6.25±0.05**LFA-1缺失炎症组102.25±0.166.01±0.275.09±0.15LFA-1缺失治疗组102.63±0.181.81±0.23**6.06±0.07**#
与相应炎症组比较,*P<0.05,**P<0.01;#与野生型治疗组比较,P<0.05
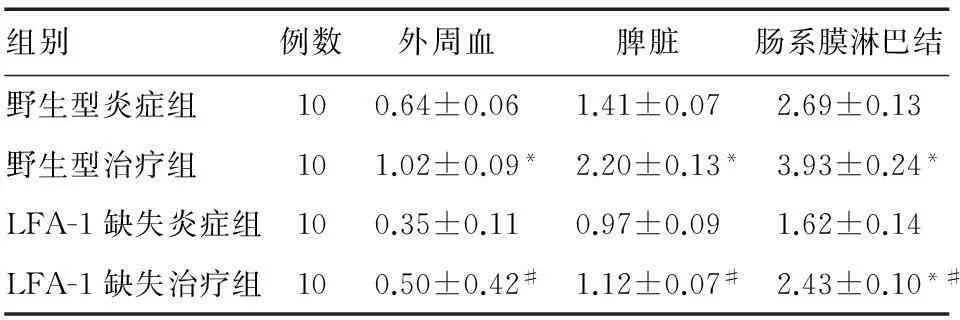
组别例数外周血脾脏肠系膜淋巴结野生型炎症组100.64±0.061.41±0.072.69±0.13野生型治疗组101.02±0.09*2.20±0.13*3.93±0.24*LFA-1缺失炎症组100.35±0.110.97±0.091.62±0.14LFA-1缺失治疗组100.50±0.42#1.12±0.07#2.43±0.10*#
*与相应炎症组比较,P<0.01;#与野生型治疗组比较,P<0.01
五、结肠组织TGF-β1、IL-10 mRNA表达
LFA-1缺失治疗组和野生型治疗组结肠组织TGF-β1 mRNA表达显著高于相应炎症组(P<0.05);IL-10 mRNA表达显著低于相应炎症组(P<0.05)。LFA-1缺失治疗组TGF-β1、IL-10 mRNA表达显著低于野生型治疗组(P<0.05)(图4)。
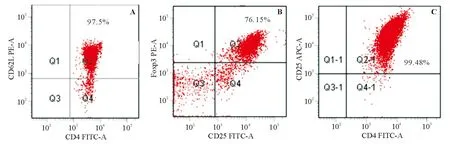
A:CD4+ CD62L+ naïve T细胞纯度;B:Foxp3比例;C:Treg细胞纯度

A:野生型炎症组;B:野生型治疗组;C:LFA-1缺失炎症组;D:LFA-1缺失治疗组
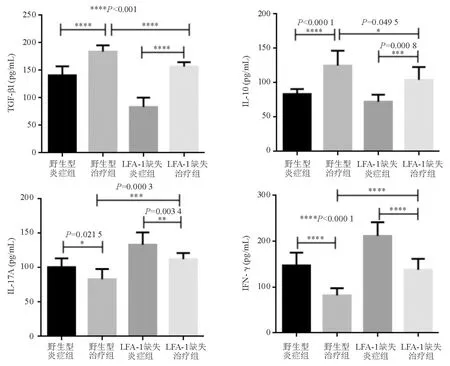
图3 各组小鼠血清TGF-β1、IL-10、IL-17A、IFN-γ水平比较
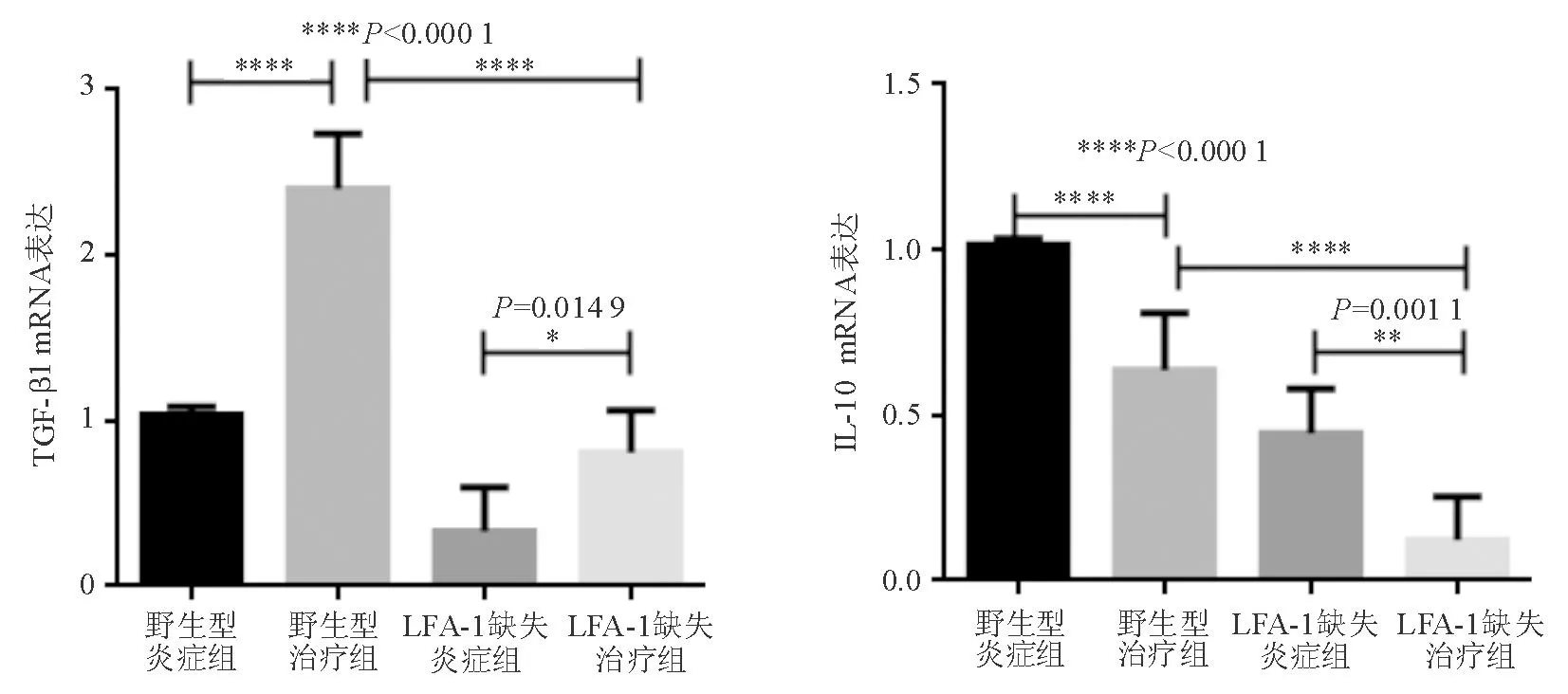
图4 各组小鼠结肠组织TGF-β1、IL-10 mRNA表达比较
讨 论
近年IBD的发病率呈上升趋势,目前临床治疗仅能维持缓解和防止复发,并不能完全治愈,甚至还造成一定的不良反应。近年有研究提出基因和细胞疗法在IBD治疗中更有优势,不良反应较少见[13],其中Treg细胞已成为目前研究的热点。许多药物的治疗旨在恢复Treg细胞数目和改善其功能。如研究发现英夫利西单抗能调控IBD血液和肠黏膜组织Foxp3的表达[14],而Foxp3是Treg细胞的特异性转录因子,为Treg细胞分化和发挥功能所必需[15-16],提示该药物可能通过促进Treg细胞分化从而发挥治疗作用。由此可见,调控Treg细胞分化和功能,能影响IBD的疗效。
LFA-1是β2家族成员,与配体细胞间黏附分子-1(ICAM-1)的相互作用在淋巴细胞和免疫系统中起有重要作用,主要参与淋巴细胞增殖、活化、迁移和归巢等。研究发现抑制LFA-1与ICAM-1的结合可治疗自身免疫病,能影响T细胞活化、增殖和迁移,从而抑制免疫应答[17]。此外,LFA-1还可影响Treg细胞的分化和功能发挥。研究[7]证实敲除LFA-1基因可导致外周Treg细胞数量和功能的降低。
目前关于敲除LFA-1对IBD中Treg细胞的影响未见报道。本实验中LFA-1缺失治疗组小鼠体质量下降和结肠组织学评分与野生型治疗组无明显差异,可能与回输Treg细胞后观察天数较短有关。但LFA-1缺失治疗组终末结肠长度较野生型治疗组明显缩短,外周血、脾脏、肠系膜淋巴结Treg细胞比例均显著低于野生型治疗组。提示LFA-1通过影响Treg细胞的分化和迁移,进而影响了IBD的疗效。与Wohler等[7]的研究结果一致。但LFA-1缺失治疗组外周血、脾脏Treg细胞比例与相应炎症组无明显差异,而肠系膜淋巴结Treg细胞比例显著升高;提示Treg细胞在迁移至肠道淋巴结组织的过程中可能存在其他黏附分子的参与。
Treg细胞能通过多种机制抑制免疫应答。Treg细胞治疗IBD的机制主要为两种:一是通过与靶细胞接触,二是通过分泌TGF-β1、IL-10等抗炎细胞因子[18-19]。本研究两组治疗组血清TGF-β1和IL-10水平均显著高于相应炎症组,但LFA-1缺失治疗组血清TGF-β1和IL-10水平显著低于野生型治疗组。说明LFA-1能影响Treg细胞分泌抗炎因子TGF-β1、IL-10,从而影响IBD的疗效。Wohler等[7]亦发现Treg细胞治疗LFA-1缺失结肠炎的疗效低于野生型。但LFA-1影响Treg细胞功能调控的机制需进一步探究,可能为与靶细胞直接接触起作用,或调控免疫抑制细胞因子的分泌。本研究还发现,两组治疗组血清IL-17A和IFN-γ水平均显著低于相应炎症组,且LFA-1缺失治疗组血清IL-17A和IFN-γ水平高于野生型治疗组,说明Treg细胞发挥免疫效应控制IBD的病理进程受LFA-1的影响。为进一步说明LFA-1影响Treg细胞治疗IBD的疗效,本研究对肠道组织中TGF-β1、IL-10 mRNA表达进行检测。结果发现两组治疗组TGF-β1 mRNA表达显著高于相应炎症组,IL-10 mRNA表达显著降低;且LFA-1缺失治疗组TGF-β1和IL-10 mRNA表达显著低于野生型治疗组。结合小鼠肠系膜淋巴结Treg细胞比例结果,进一步说明LFA-1参与了Treg细胞治疗IBD时的分化、迁移和功能调控。其中IL-10是Treg细胞发挥免疫效应的抗炎因子,但治疗组结肠组织中IL-10 mRNA表达低于相应炎症组,可能与本实验回输的Treg细胞为体外诱导有关。Karlsson等[20]发现体外诱导的Treg细胞表面表达的肠道归巢分子CCR9和α4β7下降明显。提示体外诱导的Treg细胞治疗IBD时的迁移肠道组织受到影响。
虽然既往研究证实抗LFA-1可用于治疗一些自身免疫病,但不能忽视其对Treg细胞分化和功能发挥的负向调控作用。本课题组的前期研究[9]和脑脊髓炎的动物模型[21]均证实LFA-1基因缺失能减少体内Treg细胞的数目。本实验证实LFA-1参与了Treg细胞功能的调控,LFA-1基因缺失能减少Treg细胞分泌细胞因子。LFA-1基因缺失小鼠回输体外诱导的Treg细胞治疗结肠炎的疗效低于野生型小鼠,可能与Treg细胞的功能发挥和细胞因子的分泌受到抑制相关。说明增加Treg细胞表面LFA-1表达可能为Treg细胞用于临床治疗提供新的思路,但相关结论仍需进一步研究证实。
1Kaser A,Zeissig S,Blumberg RS.Inflammatory bowel disease[J].Annu Rev Immunol,2010,28:573-621.
2Izcue A,Coombes JL,Powrie F.Regulatory lymphocytes and intestinal inflammation[J].Annu Rev Immunol,2009,27:313-338.
3Mottet C,Uhlig HH,Powrie F.Cutting edge:cure of colitis by CD4+CD25+ regulatory T cells[J].J Immunol,2003,170 (8):3939-3943.
4Varga G,Nippe N,Balkow S,et al.LFA-1 contributes to signal Ⅰ of T-cell activation and to the production of T(h)1 cytokines[J].J Invest Dermatol,2010,130 (4):1005-1012.
5Smith A,Stanley P,Jones K,et al.The role of the integrin LFA-1 in T-lymphocyte migration[J].Immunol Rev,2007,218:135-146.
6Marski M,Kandula S,Turner JR,et al.CD18 is required for optimal development and function of CD4+CD25+ T regulatory cells[J].J Immunol,2005,175 (12):7889-7897.
7Wohler J,Bullard D,Schoeb T,et al.LFA-1 is critical for regulatory T cell homeostasis and function[J].Mol Immunol,2009,46 (11-12):2424-2428.
8Li L,Kim Js,Boussiotis VA.Rap1A regulates generation of T regulatory cells via LFA-1-dependent and LFA-1-independent mechanisms[J].Cell Immunol,2010,266 (1):7-13.
9姚仁玲,邹晓平,于成功.淋巴细胞功能相关抗原-1调节Treg细胞对炎症性肠病的影响[J].胃肠病学,2013,18 (6):346-351.
10Wirtz S,Neufert C,Weigmann B,et al.Chemically induced mouse models of intestinal inflammation[J].Nat Protoc,2007,2 (3):541-546.
11Dieleman LA,Ridwan BU,Tennyson GS,et al.Dextran sulfate sodium-induced colitis occurs in severe combined immunodeficient mice[J].Gastroenterology,1994,107 (6):1643-1652.
12Dutra RC,Cola M,Leite DF,et al.Inhibitor of PI3Kγ ameliorates TNBS-induced colitis in mice by affecting the functional activity of CD4+CD25+FoxP3+ regulatory T cells[J].Br J Pharmacol,2011,163 (2):358-374.
13van der Marel S,Majowicz A,van Deventer S,et al.Gene and cell therapy based treatment strategies for inflammatory bowel diseases[J].World J Gastrointest Pathophysiol,2011,2 (6):114-122.
14Li Z,Arijs I,De Hertogh G,et al.Reciprocal changes of Foxp3 expression in blood and intestinal mucosa in IBD patients responding to infliximab[J].Inflamm Bowel Dis,2010,16 (8):1299-1310.
15Beissert S,Schwarz A,Schwarz T.Regulatory T cells[J].J Invest Dermatol,2006,126 (1):15-24.
16Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003,299 (5609):1057-1061.
17Kavanaugh AF,Davis LS,Jain RI,et al.A phase Ⅰ/Ⅱ open label study of the safety and efficacy of an anti-ICAM-1 (intercellular adhesion molecule-1; CD54) monoclonal antibody in early rheumatoid arthritis[J].J Rheumatol,1996,23 (8):1338-1344.
18Boden EK,Snapper SB.Regulatory T cells in inflammatory bowel disease[J].Curr Opin Gastroenterol,2008,24 (6):733-741.
19Mayne CG,Williams CB.Induced and natural regulatory T cells in the development of inflammatory bowel disease[J].Inflamm Bowel Dis,2013,19 (8):1772-1788.
20Karlsson F,Martinez NE,Gray L,et al.Therapeutic evaluation of ex vivo-generated versus natural regulatory T-cells in a mouse model of chronic gut inflammation[J].Inflamm Bowel Dis,2013,19 (11):2282-2294.
21Gültner S,Kuhlmann T,Hesse A,et al.Reduced Treg frequency in LFA-1-deficient mice allows enhanced T effector differentiation and pathology in EAE[J].Eur J Immunol,2010,40 (12):3403-3412.
(2015-11-03收稿;2015-12-11修回)
Efficacy of Lymphocyte Function-associated Antigen-1 on Inflammatory Bowel Disease by Regulating Treg Cells
FEI Xianyan1,ZHANG Xin1,YU Chenggong1,2.
1Department of Gastroenterology,the Affiliated Drum Tower Hospital of Nanjing University Medical School,Nanjing (210008);2Drum Tower School of Clinical Medicine,Nanjing Medical University,Nanjing
Lymphocyte Function-Associated Antigen-1;T-Lymphocytes,Regulatory;Inflammatory Bowel Disease;Cytokines
DOI:10.3969/j.issn.1008-7125.2016.07.003
*本课题为国家自然科学基金面上项目(81170359)
#Email:xianyan0228@163.com
▲本文通信作者,Email:chenggong_yu@nju.edu.cn.
