微量热法研究黄芪多糖对大肠杆菌的抑制功能及机理
2016-08-29廖晓宇代春美
任 历, 廖晓宇, 刘 鹏, 代春美
(1. 辽宁医学院 基础医学部, 辽宁 锦州 121001;2. 武汉理工大学 化学化工与生命科学学院, 湖北 武汉 430070)
微量热法研究黄芪多糖对大肠杆菌的抑制功能及机理
任历1, 廖晓宇1, 刘鹏2, 代春美1
(1. 辽宁医学院 基础医学部, 辽宁 锦州121001;2. 武汉理工大学 化学化工与生命科学学院, 湖北 武汉430070)
通过微量热法研究了pH、温度、离子强度和黄芪多糖对大肠杆菌生长的影响,探讨了黄芪多糖对大肠杆菌的抑制作用和机理。研究发现:pH降低到5或升高到9,或升高或降低温度,大肠杆菌的生长代谢逐渐变慢,表现为停滞期增加,进入对数期的时间增加,最大放热功率降低;适量NaCl(0.1mol/L)能够刺激生长速率常数急剧上升;低剂量的黄芪多糖能够刺激大肠杆菌的生长,但高剂量的黄芪多糖能够抑制大肠杆菌,甚至能够完全抑制。黄芪多糖的不断加入,导致测量DPH的荧光偏振度逐渐提高,表明细胞膜通透性在逐渐增加,细胞膜的流动性却在不断降低,说明细胞膜逐步遭到了破坏。黄芪多糖存在下形成的抑菌圈为30mm左右,表明具有较强的抑菌功能。
黄芪多糖; 大肠杆菌; 微量热法; 细胞膜
作为一种天然产物,黄芪具有提高免疫功能、延缓细胞衰老等功效[1]。在临床应用中,黄芪还能够减轻肾炎蛋白尿,增强心肌收缩的力量,以及调节血糖含量[2-3]。黄芪多糖是黄芪发挥药理作用的主要成分。黄芪多糖是一种由多种单糖组成的生物大分子,由己糖醛酸、葡萄糖、果糖、鼠李糖、阿拉伯糖、半乳糖醛酸和葡萄糖醛酸等组成,具有抑制病毒、抑制肿瘤、延缓衰老、防止辐射、抗应激、防止氧化等作用[4-6]。黄芪多糖对多种致病菌均有抑制作用,如大肠杆菌、金黄色葡萄球菌、志贺氏痢疾杆菌、炭疽杆菌、溶链球菌肺炎双球菌、沙门氏菌等。从中医的角度来说,黄芪多糖主要通过调动机体免疫防御功能而发挥扶正祛邪抑菌,杀菌作用。但是从现代药理学及分子生物学角度并未有完美的解释。
微量热法由于其灵敏度高,常被用于生物体系代谢过程的热量。武汉大学刘鹏等[7-8]人率先在国内用微量热法对细菌生长产热曲线进行研究。
本文通过微量热法研究黄芪多糖对大肠杆菌的抑制功能及机理。根据大肠杆菌在黄芪多糖作用下不同的新陈代谢的放热曲线,反映出大肠杆菌的生长情况,以及黄芪多糖在不同的条件下效能的变化。离子强度、pH值和温度对大肠杆菌生长的影响也通过微量热发进行了详细的研究。另外,结合大肠杆菌细胞膜的变化以及抑菌圈的大小探讨了黄芪多糖抑制大肠杆菌生长的机理。
1 实验
1.1主要药品与试剂
黄芪多糖APS购置于陕西森弗生物技术有限公司。大肠杆菌(AB91112)购于武汉大学微生物保存中心。培养基:将5g的NaCl、5g的蛋白胨、5g的牛肉膏溶于1 000mL蒸馏水中,调节溶液pH值至7.2;在121 ℃、1.034×105Pa灭菌30min。
1,6-二甲苯-1,3,5-己三烯(DPH)购于Sigma。先将DPH溶于氯仿,然后将该溶液溶于pH值为7.2的磷酸缓冲液(PBS)中,使DPH浓度为0.004mmol/L,剧烈震荡15min。
1.2微量热仪
本研究中所使用仪器为瑞典ThermometricAB公司生产的8通道TAMAir等温热导式量热仪器。样品池和参比池周围布满了热流传感器,样品和它的环境之间的温差在该传感器中形成一个正比于热流速度的电势信号。样品池和参比池进行孪生式对接,这样可以消除因外界温度波动产生的背景噪声。TAMAir结构示意图见图1。

图1 TAM air的结构示意图
1.3测试方法
实验时系统控温在37 ℃。当系统获得了较为稳定的基线之后,在样品池的瓶中加入接种了大肠杆菌的培养基,再加入一定浓度的黄芪多糖溶液(0、5×10-6、10×10-6、20×10-6、30×10-6、40×10-6、100×10-6mol/L);之后放入TAMAir微量量热仪中,计算机输出并绘出大肠杆菌生长代谢的热功率曲线。
用二次蒸馏水配制浓度为0.1mol/L的HCl溶液和1.0mol/L的NaCl溶液。用配置好的HCl溶液调节pH值,在pH为5.5和8.5时重复上述实验。用配置好的NaCl溶液调节离子强度,分别加入不同量使NaCl的浓度为0.1、0.2、0.3mol/L,在不同的离子强度下重复上述实验。
1.4细胞膜通透性的变化
荧光偏振仪的型号为Shimadzu,RF-5301。大肠杆菌细胞膜流动性的改变可以使用DPH作为探针,经由荧光偏振技术测得。将DPH溶于pH值为7.2的磷酸缓冲液(PBS)中,使DPH浓度为0.004mmol/L,剧烈震荡15min,使其充分混合;用一定浓度的黄芪多糖溶液(0、5×10-6、10×10-6、20×10-6、40×10-6、40×10-6、100×10-6mol/L)处理培养好的大肠杆菌细胞;然后加入等量的DPH溶液,在37 ℃反应30min;用PBS洗涤几次,充分去除溶液中游离的DPH,最后将细胞悬浮于PBS溶液中,测量细胞膜的偏振度。实验采用的激发和发射波长分别为362nm和432nm。
1.5抑菌圈测试
取2个相同的培养皿,分别标记为A和B。在培养基中加入一定量的琼脂(每100mL加1g琼脂),经过高温灭菌,未冷却前倒入培养皿中,待冷却后培养基凝固;将少量的大肠杆菌菌液分别加入到培养基上,并将其平铺均匀。A组为对照组,两组中在培养基表面取一个点,加入黄芪多糖溶液(100×10-6mol/L);最后将A和B两组均放在37 ℃恒温培养箱中培养20h,观察培养基表面大肠杆菌的生长状况。
2 结果与讨论
2.1pH、温度和离子强度对大肠杆菌生长的影响
2.1.1pH对大肠杆菌生长的影响
图2是37 ℃下大肠杆菌生长代谢曲线,可以区分出生长的4个阶段:停滞期、对数生长期、稳定期和衰亡期。利用下式对生长代谢曲线进行处理:
lnPt=lnP0+kt
(1)
式中,Pt为放热功率,P0为初始功率,t为时间。
在对数生长期中取Pt和t数据进行线性拟合,即可求出k值,从而得到细菌生长的速率常数[8-10]。大肠杆菌在不同pH值下生长的动力学方程见表1,表1中R为相关系数。

图2 37 ℃下大肠杆菌不同pH值生长代谢放热曲线
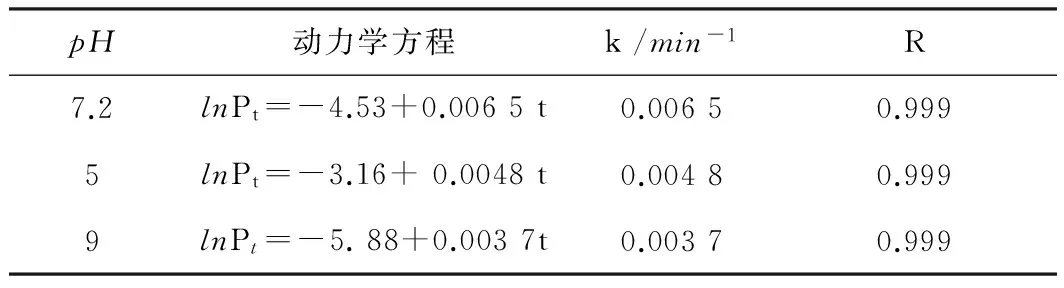
pH动力学方程k/min-1R7.2lnPt=-4.53+0.0065t0.00650.9995lnPt=-3.16+0.0048t0.00480.9999lnPt=-5.88+0.0037t0.00370.999
pH为7.2是对照组样品,其表现出完整的生长4个阶段,计算出生长速率常数为0.006 5min-1。随着pH的降低到5,生长代谢逐渐变慢,表现为停滞期增加,进入对数期的时间增加,最大放热功率降低,计算出其生长速率常数为0.00 48,pH降低,生长速率常数逐渐减小。随着pH的升高到9,生长代谢逐渐变慢,表现为停滞期增加,进入对数期的时间增加,最大放热功率降低到0.003 7。上述结果反映出了大肠杆菌与生长环境中pH值的关联性。由图2分析可知,大肠杆菌最适宜的生长条件为pH=7.2。一般来讲,pH对细菌等微生物的生命活动有很大的影响,主要通过以下几个方面实现:一是当pH值发生变化时,蛋白质、核酸等生物大分子所带电荷会发生变化,从而影响其结构、生物活性和生理功能;二是引起细胞膜的电荷变化,导致微生物细胞与外界交换物质的能力受到影响,从而吸收营养物质能力改变。一般来讲,不同微生物对pH值条件的要求各不相同,某一种微生物只能在一定的pH范围内生长,而且这个pH范围常限于一个较窄的范围。微生物对环境的适应能力可以从对pH条件的要求不同反映出来。
2.1.2温度对大肠杆菌生长的影响
大肠杆菌在不同温度下生长代谢放热曲线见图3,动力学方程等见表2。

图3 大肠杆菌在不同温度生长代谢放热曲线

温度/℃动力学方程k/min-1R37lnPt=-4.53+0.0065t0.00650.99932℃lnPt=-4.02+0.0035t0.00350.99940℃lnPt=-2.67+0.0022t0.00340.999
由图3可知,将温度降到32 ℃或升到40 ℃时,生长代谢逐渐变慢,表现为停滞期增加,进入对数期的时间增加,最大放热功率降低,计算出其生长速率常数分别为0.003 5min-1和0.003 4min-1,而37 ℃时的生长速率常数为0.006 5min-1。说明大肠杆菌最适合的生长温度为37 ℃。在合理的温度范围内温度的上升会加快细胞中的生物化学反应速率;但是酶、蛋白质和核酸等生物大分子参与的生化反应都有最适宜的温度范围,过高或过低的温度使这些物质参与的生化反应会降低甚至停止,从而引起微生物生长的抑制,甚至死亡。所以每一种细菌都有一个最佳的平衡点和最适合生长的温度。
2.1.3离子强度对大肠杆菌生长的影响
37 ℃下大肠杆菌在不同离子强度(NaCl浓度)下的生长代谢放热曲线见图4,动力学方程等见表3。
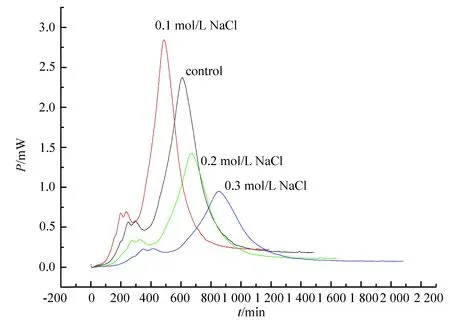
图4 37℃下大肠杆菌在不同离子强度(NaCl浓度)下生长代谢曲线
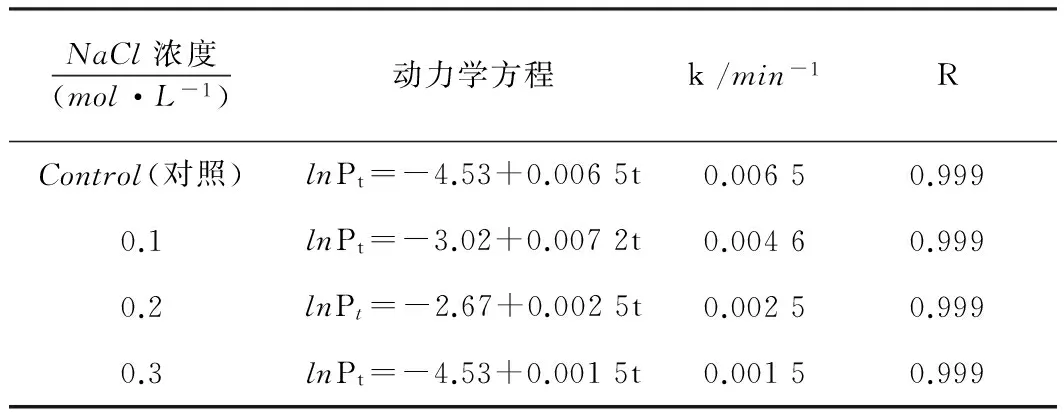
NaCl浓度(mol·L-1)动力学方程k/min-1RControl(对照)lnPt=-4.53+0.0065t0.00650.9990.1lnPt=-3.02+0.0072t0.00460.9990.2lnPt=-2.67+0.0025t0.00250.9990.3lnPt=-4.53+0.0015t0.00150.999
由图4可知,培养基加一点NaCl(0.1mol/L),生长速率常数就急剧上升,生长代谢逐渐加快,表现为停滞期缩短,进入对数期的时间缩短,最大放热功率增加;进一步增加NaCl浓度,生长速率常数反而减小。NaCl浓度为0.1mol/L时,生长速率常数为0.0072min-1,NaCl浓度为0.2mol/L和0.3mol/L时的生长速率常数分别为0.002 5和0.001 5。离子强度反映溶液中离子的电性强弱的程度,而电性的强弱影响细胞膜的膜电位、渗透压和通透性。低浓度NaCl能维持膜电位和渗透压,适当保持细胞膜的通透性,高浓度破坏原有的平衡,结果是抑制细菌的生长。
2.2黄芪多糖对大肠杆菌生长的影响
如图5和表4所示,当培养基加微量黄芪多糖,大肠杆菌生长受到了刺激,速率常数就上升;进一步增加黄芪多糖浓度,生长速率常数反而减小,黄芪多糖浓度为100×10-6mol/L时细菌无法生长。有机物是大肠杆菌的碳源,也是其能源,大肠杆菌将有机物作为细胞合成的碳源,所以低剂量的黄芪多糖能够刺激大肠杆菌的生长,但高剂量的黄芪多糖能够抑制大肠杆菌,甚至能够完全抑制,这是因为黄芪多糖的生理生化功能引起的。
多糖是由多个单糖分子缩合、失水而成,是一类分子结构复杂且庞大的糖类物质。黄芪多糖特殊结构能够插入到大肠杆菌的细胞膜中,改变细胞膜的结构,进而抑制了大肠杆菌的生长。
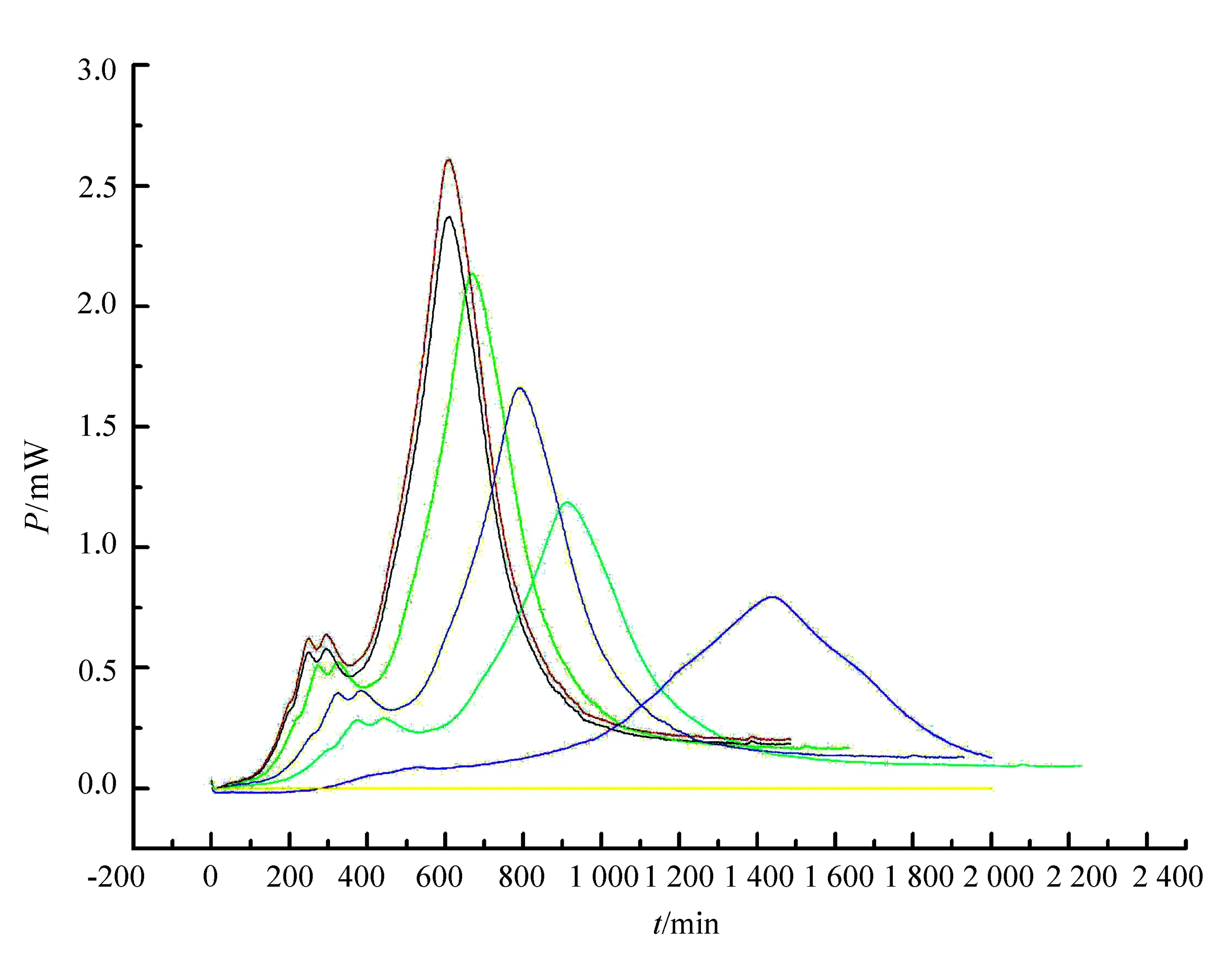
图5 37 ℃下大肠杆菌在不同黄芪多糖含量下的生长代谢曲线
黄芪多糖含量(mol·L-1)动力学方程k/min-1RControllnPt=-4.53+0.0065t0.00650.9995×10-6lnPt=-2.38+0.0071t0.00460.99910×10-6lnPt=-1.53+0.0058t0.00250.99920×10-6lnPt=-3.23+0.0045t0.00150.99940×10-6lnPt=-3.29+0.0035t0.00650.99940×10-6lnPt=-4.66+0.0012t0.00460.999100×10-6—0
2.3处理后细胞膜流动性降低
细胞膜流动性是细胞膜的一项重要物理性能,很多生物功能如能量转换、营养物质的吸收以及生物信号的传递,都与细胞膜流动性紧密联系。因此,保持细胞膜流动性相对稳定,对于细菌正常代谢以及对抗各种环境不利因素有着重要的作用。
我们将细胞与DPH指示剂温浴一段时间后,DPH会插入到细胞膜脂的疏水区域。因此通过测量DPH的偏振度可以间接测量出细胞膜的平均流动程度。荧光偏振度值与细胞膜流动性成反比,偏振度越大,说明细胞膜脂的流动性越小。细胞在光催化作用下发生的自由基损伤导致了膜的物化改变,膜流动性下降[11]。在本实验中,自由基和紫外光都可以攻击细胞表面的有机官能团,导致脂质氧化,磷脂分子排列更紧密,脂肪链流动性降低,进而导致整个细胞膜的流动性降低。随着黄芪多糖的不断加入,导致测量DPH的荧光偏振度值逐渐提高,表明细胞膜的通透性在逐渐增加,细胞膜的流动性却在不断降低,说明细胞膜逐步遭到了破坏[12-14]。黄芪多糖处理后大肠杆菌的荧光偏振值见图6。
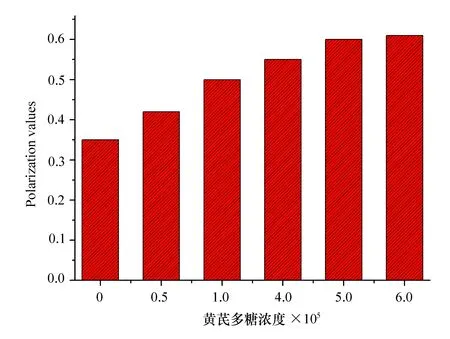
图6 黄芪多糖处理后大肠杆菌的荧光偏振值
2.4抑菌圈
在已接种大肠杆菌的琼脂培养基上加入少量黄芪多糖,使之接触培养基和大肠杆菌,经培养一定时间后,因黄芪多糖的渗透扩散作用,黄芪多糖周围因抑制了大肠杆菌的生长而产生了抑菌圈。从图7可看出,对照组A周围未形成抑菌圈,黄芪多糖处理组中的抑菌圈是大肠杆菌无法生长的区域。因此可以说明黄芪多糖确实可以抑制大肠杆菌的生长,其抑菌圈为30mm左右,表明具有较强的抑菌性能。

图7 大肠杆菌在黄芪多糖存在下抑菌圈的形成
3 结论
(1) 本文通过微量热法研究了pH、温度、离子强度和黄芪多糖对大肠杆菌生长的影响,探讨了黄芪多糖对大肠杆菌的抑制作用和机理。研究发现,pH降低到5或升高到9,生长代谢逐渐变慢,表现为停滞期增加,进入对数期的时间增加,最大放热功率降低,反映出大肠杆菌与生长环境中pH值的关联性,大肠杆菌最适宜的生长条件为pH=7.2。大肠杆菌最适合的生长温度为37 ℃。适量NaCl(0.1mol/L)能够刺激生长速率常数就急剧上升。离子强度表现了溶液中离子的电性强弱的程度,而电性的强弱影响了细胞膜的膜电位、渗透压和通透性。低浓度的NaCl能维持膜电位和渗透压,适当保持细胞膜的通透性,高浓度破坏原有的平衡,结果是抑制细菌的生长。
(2) 低剂量的黄芪多糖能够刺激大肠杆菌的生长,但高剂量的黄芪多糖能够抑制大肠杆菌,甚至能够完全抑制。这是因为黄芪多糖生理生化功能引起的。黄芪多糖特殊结构能够插入到大肠杆菌的细胞膜中,改变细胞膜的结构,进而抑制了大肠杆菌的生长。
(3) 黄芪多糖的不断加入,导致测量DPH的荧光偏振度值逐渐提高,表明细胞膜的通透性在逐渐增加,细胞膜的流动性却在不断降低,说明细胞膜逐步遭到了破坏。
(4) 黄芪多糖存在下形成的抑菌圈为30mm左右,表明具有较强的抑菌性能。
References)
[1] 钟灵,王振富,文德鉴.黄芪多糖抗衰老作用的实验研究[J].中国应用生理学杂志,2013,29(4):350-352.
[2]ParkerJL,ShawJG.Aeromonassppclinicalmicrobiologyanddisease[J].JInfect,2011:109-18.
[3]TenaD,González-PraetoriusA,GimenoC,etal.ExtraintestinalinfectionduetoAeromonasspp.:reviewof38cases[J].EnfermInfeccMicrobiolClin,2007,25(4):235-241.
[4]MukhopadhyayC,ChawlaK,SharmaY,etal.Emergingextra-intestinalinfectionswithAeromonashydrophilaincoastalregionofsouthernKarnataka[J].JPostgradMed, 2008,54(3):199-202.
[5]ZhangY,ShenJ,ZhuS,etal.Effectsofastragalus(ASI,SK)onexperimentalliverinjury[J].ActaPharmSin,1992,27(6):401-406.
[6]VerottaL,El-SebakhyN.CycloartaneandoleananesaponinsfromAstragalussp[J].StudNatProdChem,2001,25:179-234.

[8] 刘鹏,刘义,陈酉贵,等.等温微量热法在生命科学研究中的应用[J].化学通报,2002(10):682-688.
[9]InêsSF,AnaB,BertrandB,etal.Improvementoftheantibacterialactivityofdaptomycin-loadedpolymericmicroparticlesbyEudragitRL100:Anassessmentbyisothermalmicrocalorimetry[J].InternationalJournalofPharmaceutics,2015,485:171-182.
[10]GenevièveB,JeanLB,etal.Microcalorimetry:ApowerfulandoriginaltoolfortrackingthetoxicityofaxenobioticonTetrahymenapyriformis[J].EcotoxicologyandEnvironmentalSafety,2013,98: 88-94.
[11]UlrikaFT,ChristinaO,AndrejT.ActivityofantifungalcombinationsagainstAspergillusspeciesevaluatedbyisothermalmicrocalorimetry[J].DiagnosticMicrobiologyandInfectiousDisease,2013,77: 31-36.
[12]CzogallaA,GrzybekM,JonesW,etal.ValidityandApplicabilityofMembraneModelSystemsforStudyingInteractionsofPeripheralMembraneProteinswithLipids[J].BiochimicaetBiophysicaActa(BBA) -MolecularandCellBiologyofLipids,2014,1841(8):1049-1059.
[14]SkoraováL,HofM,etal.TheEffectofDetergentsonTrimericG-proteinActivityinIsolatedPlasmaMembranesfromRatBrainCortex:CorrelationwithStudiesofDPHandLaurdanFluorescence[J].BiochimicaetBiophysicaActa(BBA) -Biomembranes,2009,1788(2):324-332.
StudyoninhibitionandmechanismofastragaluspolysaccharideonEscherichia colibyusingmicrocalorimetry
RenLi1,LiaoXiaoyu1,LiuPeng2,DaiChunmei1
(1.DepartmentofBasicMedicine,LiaoningMedicalUniversity,Jinzhou121001,China;2.SchoolofChemistry,ChemicalEngineeringandLifeScience,WuhanUniversityofTechnology,Wuhan430070,China)
TheeffectsofpH,temperature,ionicstrengthandAstragalusPolysaccharides(APS)onthegrowthofEscherichia coli (E. coli)werestudiedbymeansofmicrocalorimetrymethod.TheresultsshowthatwhenpHislowerthan5orhigher9,metabolismofE. coligrowthslowsdowngradually.Thesamephenomenoncanbeobservedunderdifferenttemperatureconditions.TheadditionofNaClcanstimulatethegrowthrateconstant.ThelowdoseofAPScanstimulatethegrowthofE. coli,butthehighdoseofAPScaninhibitE. coli,whichcanevenbecompletelyinhibited.InthepresenceofAPS,thepermeabilityofthecellmembranegraduallyincreased,evencellmembranewasdamaged.TheinhibitionzoneformedinthepresenceofAPSisabout30mm,whichindicatesthatithasstrongantibacterialfunction.
astragaluspolysaccharides; Escherichia coli;microcalorimetrymethod;cellmembrane
DOI:10.16791/j.cnki.sjg.2016.05.017
2015- 10- 20修改日期:2015- 12- 10
国家自然科学基金项目(51579159)资助;辽宁省教育厅课题(L2014332,L32013334)资助
任历(1979—),女,辽宁沈阳,在读博士研究生,讲师,研究方向为中药质量评价、中药有效成分临床应用及相关机制研究.
E-mail:renli9705@163.com
R285.5
A
1002-4956(2016)5- 0058- 05
