急性肿瘤患者右丙亚胺单药与联合华蟾素注射液治疗对阿霉素所致相关性心脏毒性的影响
2016-08-27张国文
张国文
急性肿瘤患者右丙亚胺单药与联合华蟾素注射液治疗对阿霉素所致相关性心脏毒性的影响
张国文
目的探讨恶性肿瘤患者右丙亚胺单药与联合华蟾素注射液治疗对阿霉素所致相关性心脏毒性的影响,并对比其疗效。方法选取恶性肿瘤患者166例为研究对象,随机分为单药组(右丙亚胺单药,61例)、联合用药组(联合应用右丙亚胺与华蟾素注射液,75例)与对照组(不予用药处理,30例)。3组患者均采用含蒽环类药物阿霉素的化疗方案。对照组化疗前不予用药处理;单药组化疗前30 min给予注射用右丙亚胺,按与阿霉素剂量比20∶1确定右丙亚胺剂量;联合用药组在化疗前同时给予右丙亚胺与华蟾素注射液15 ml,右丙亚胺用法用量同单药组。结果经4个化疗周期,(1)心脏毒性发生率方面:对照组53.3%,显著高于单药组(29.51%)、联合用药组(8.0%),P<0.05;单药组显著高于联合用药组,P<0.05。(2)心电图方面:3组病例在化疗开始前心电图均无异常改变。化疗过程中右丙亚胺单药组心电图异常者9例(14.75%)、联合用药组7例(9.33%),均显著低于对照组22例(73.3%);联合用药组的心电图异常比例显著低于单药组,P<0.05。(3)CK、CK-MB、TnI方面:单药组与对照组化疗后较本组化疗前显著上升(P<0.05);联合用药组化疗后CK、TnI较本组化疗前显著上升(P<0.05),CK-MB与化疗前比较差异不显著,P>0.05。化疗前3组差异不显著(P>0.05)。化疗后单药组、联合用药组显著低于对照组,P<0.05;联合用药组显著低于单药组,P<0.05。(4)超声心动图参数LVIDD、LVISD、A/E、LVEF、FS方面:单药组与对照组化疗前、后均有显著差异(P<0.05),但联合用药组化疗后较本组治疗前无显著差异(P>0.05)。化疗前3患者各超声心动图参数均无显著差异(P>0.05),化疗后3组间两两比较均有明显差异(P<0.05)。 结论右丙亚胺与华蟾素注射液对阿霉素所致心脏毒性具有一定的保护作用,联合用药可明显降低心脏毒性的发生率以及毒性程度,维持正常的心电图、心肌酶以及心功能变化,从而增强恶性肿瘤患者对化疗药物毒副作用的耐受能力、提高肿瘤患者的治疗效果。
阿霉素;华蟾素注射液;右丙亚胺;肿瘤;心脏毒性
DOI:10.3969/j.issn.1001-5930.2016.07.050
(ThePracticalJournalofCancer,2016,31:1202~1206)
阿霉素(adriamycin,ADM)是一种高效、广谱的蒽环类抗肿瘤药物,被广泛用于多种恶性肿瘤如白血病、淋巴瘤、乳腺癌、肺癌等的化学治疗中[1],心脏毒性作用为ADM在发挥抗肿瘤作用同时带来的毒副作用,主要表现为剂量累积性的、进展性的各种心肌病与充血性心力衰竭等,发生机制与自由基氧化损害、心肌细胞浆内钙超载、细胞凋亡、线粒体损伤等多种机制有关[2]。右丙亚胺是公认的可以有效拮抗阿霉素等蒽环类致心脏毒性作用的药物,保护心脏同时不干扰蒽环类药物抗肿瘤的疗效,在预防阿霉素等相关性心脏毒性方面有较大的应用价值,但存在所需剂量大,引起骨髓抑制、肾脏损害等局限性[3]。华蟾素是一种提取自传统药材中华大蟾蜍皮中的中药制剂,临床常用于抗肿瘤。少数研究表明[4]华蟾素中含有的强心苷成分可减少心肌中阿霉素的蓄积,从而减轻阿霉素的心脏毒性作用。为了寻求能够更有效针对阿霉素所致心脏毒性的药物防治方案,我们分别采用右丙亚胺单药与联合华蟾素注射液治疗恶性肿瘤患者阿霉素相关性心脏毒性作用并对比其疗效。现将研究过程报告如下。
1 资料与方法
1.1临床资料
选取我院肿瘤科2013年6月至2014年6月收治的166例恶性肿瘤患者为研究对象,恶性肿瘤诊断均有明确病理学或细胞学诊断依据,包括乳腺癌42例,肺癌48例,胃癌32例,急性白血病24例,淋巴瘤20例。所有患者均需进行含阿霉素的化疗方案。将所有研究对象随机分为单药组(右丙亚胺单药,61例)、联合用药组(联合应用右丙亚胺与华蟾素注射液,75例)与对照组(不予用药处理30例)。联合用药组75例,男性40例,女性35例;年龄31~69岁,平均(48.3±5.4)岁;肿瘤类型:乳腺癌19例,肺癌22例,胃癌14例,急性白血病11例,淋巴瘤9例;ADM累积剂量达250~350 mg/m213例,351~450 mg/m257例,451~550 mg/m25例。单药组61例,男性33例,女性28例;年龄30~66岁,平均(47.6±4.9)岁;肿瘤类型:乳腺癌13例,肺癌18例,胃癌13例,急性白血病9例,淋巴瘤8例;ADM累积剂量达250~350 mg/m211例,351~450 mg/m246例,451~550 mg/m24例。对照组男性18例,女性12例;年龄31~68岁,平均(47.3±4.9)岁;肿瘤类型:乳腺癌10例,肺癌8例,胃癌5例,急性白血病4例,淋巴瘤3例;ADM累积剂量达25~350 mg/m28例,351~450 mg/m220例,451~550 mg/m22例。3组病例在性别、年龄、肿瘤类型、ADM用量等资料方面差异无统计学意义(P>0.05)。
1.2选择标准
符合恶性肿瘤的病理学或组织学诊断;年龄<70岁,病情稳定,预计生存时间3月以上;首次使用蒽环类药物化疗,距上次化疗周期1月以上;血常规、肝肾功能、心肌酶、心电图检查无异常,既往无器质性心脏疾病史;排除心、肺、肝、肾等严重功能不全者;告知治疗方案,签署知情同意书。
1.3治疗方法
3组病例均采用含蒽环类药物阿霉素的化疗方案,相同肿瘤类型者化疗方案相同(乳腺癌CEF方案,肺癌CAP方案,胃癌FAMTX方案,急性白血病DAT方案,淋巴瘤CHOP方案),3周为1个化疗周期,化疗4个周期。①对照组化疗前不予用药处理。②单药组在每次化疗前30 min先给予注射用右丙亚胺,按与阿霉素剂量比20∶1确定右丙亚胺剂量,采用专用的溶媒乳酸钠溶液配置,再用0.9%氯化钠溶液进一步稀释至200 ml,于30 min内快速静脉输注后即给予阿霉素。③联合用药组在化疗前同时给予右丙亚胺与华蟾素注射液,右丙亚胺用法用量同单药组,华蟾素剂量15 ml,于5%葡萄糖溶液500 ml稀释后缓慢滴注,每天1次,7 d为1个疗程,每个化疗周期用药1个疗程。化疗期间注意给予止吐、升白细胞等对症支持治疗。
1.4观察指标
①2组病例在每次化疗前均行常规12导联心电图检查,并于阿霉素化疗后1 d、3 d、7 d复查心电图,观察心率与心律的变化、ST-T段改变、期前收缩、房室或束支传导阻滞、QRS低电压等异常心电图改变,记录3组病例化疗过程中发生心电图异常的例数;②检测3组病例在化疗4周期前后的心肌酶,包括肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、肌钙蛋白(TnI)的变化情况;③化疗前后行超声心动图检查,采用飞利浦IE33心脏彩超检测仪,频率7.5 HZ,检测左室射血分数(LVEF)、左室舒张末期内径(LVIDD)、左心室收缩末期内径(LVISD)、舒张早期与晚期左心室充盈速度比值(A/E)、短轴缩短率(FS),各指标参数取连续3个心动周期的平均值。
1.5心脏毒性评价标准
参照WHO制定的抗肿瘤药物急性及亚急性毒性分度标准[5]将心脏毒性分度为0级:正常;Ⅰ级:无胸闷胸痛、心悸等症状,有窦性心动过速等异常心脏征象;Ⅱ级:有相关症状与心功能不全表现,偶发早搏但无需治疗者;Ⅲ级:有明显症状与心功能不全表现,频发早搏,经治疗后缓解;Ⅵ级:有严重症状与心功能不全表现,室性心律不齐或心力衰竭等,经治疗无缓解。
1.6统计学方法
2 结果
2.13组病例化疗后的心脏毒性情况
经4个化疗周期后,3组病例的心脏毒性发生率分别为对照组53.3%(16/30),单药组29.5%(18/61)、联合用药组8.0%(6/75)。单药组、联合用药组与对照组比较,差异有统计学意义(χ2=3.670、6.584,P<0.05);单药组与联合用药组比较,差异有统计学意义(χ2=5.126,P<0.05)。见表1。
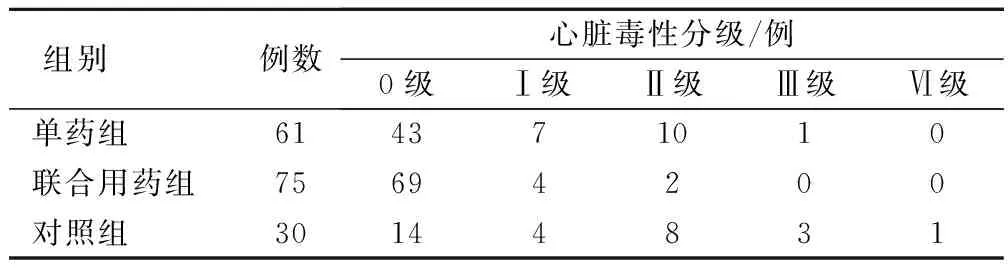
表1 3组患者化疗后的心脏毒性分级
2.23组患者的心电图变化
3组患者在化疗开始前心电图均无异常改变。化疗过程中右丙亚胺单药组心电图异常者9例(14.75%)、联合用药组7例(9.33%)、对照组22例(73.3%)。单药组、联合用药组的心电图异常发生率显著低于对照组(χ2=8.193、10.316,P均<0.05);联合用药组的心电图异常发生率显著低于单药组(χ2=4.284,P<0.05)。见表2。

表2 3组患者化疗后的心电图变化情况/例
2.33组患者化疗前后的心肌酶变化情况
3组患者在化疗后的心肌酶较化疗前均有所上升,单药组与对照组的化疗后CK、CK-MB、TnI较化疗前显著上升(P<0.05),联合用药组化疗后的CK、TnI较化疗前显著上升(P<0.05),CK-MB与化疗前比较差异不显著(P>0.05)。3组患者间相比较,化疗前3组的CK、CK-MB、TnI差异不显著(P>0.05),化疗后单药组、联合用药组显著低于对照组(P<0.05),联合用药组显著低于单药组(P<0.05)。见表3。
表3 3组患者化疗前后的心肌酶变化比较±s)
2.43组患者化疗前后的超声心动图参数比较
单药组与对照组化疗前后的LVIDD、LVISD、A/E、LVEF、FS的差异均有统计学意义(P<0.05),联合用药组化疗后的LVIDD、LVISD、A/E、LVEF、FS较治疗前无显著差异(P>0.05)。化疗前3组患者各超声心动图参数均无显著差异(P>0.05);化疗后3组间两两比较,差异均有统计学意义(P<0.05)。见表4。
表4 3组化疗前后超声心动图参数比较±s)
3 讨论
以阿霉素(ADM)为代表的蒽环类药物是临床上常见的抗肿瘤药物,因其抗瘤谱广、作用强、效果明显,蒽环类药物为基础联合其他化疗药物可作为一线化学治疗的标准方案[6],在多种实体肿瘤以及恶性血液病的治疗过程中发挥了不可或缺的作用。蒽环类药物在应用时会造成脱发、胃肠道反应、骨髓抑制以及心脏毒性等一系列不良反应,其中心脏毒性作用最为严重,首次使用蒽环类药物即可出现进展的不可逆性的心脏受损[7]。阿霉素导致心脏毒性作用的机制主要为自由基氧化学说,即药物在代谢过程中产生自由基与超氧化物,引起线粒体与内质网脂质发生过氧化,对心肌细胞造成强烈损伤;另外ADM通过激活肌浆网与线粒体的Ca2+向胞质内释放、影响膜渗透性诱导胞外Ca2+内流等途径,提高胞内的Ca2+浓度,导致心肌细胞钙超载而影响心肌纤维的兴奋偶联作用;还有ADM触发心肌凋亡以及线粒体损伤等其他机制[8-9]。即使近年来已有推荐的低剂量化疗方案,但相关报道[10]应用蒽环类药物在最大累积量下限时即可发生相当比例的心脏毒性反应,阿霉素累积量在50 mg/m2时即可发生左室功能障碍,这与个体对药物的易感性存在差异有关。心脏毒性作用从轻度的心律不齐到严重的甚至致死的心肌病、心肌梗死、心力衰竭,出现心电图异常、血清心肌酶升高、心功能不全等表现,且心脏损害随化疗时间或药物累积剂量呈不可逆转的进行性加重,因此,恶性肿瘤患者在化疗过程中做好对阿霉素等蒽环类药物所致心脏毒性作用的防治措施尤为重要。
针对ADM心脏毒性作用的发生机制,临床在应用ADM同时会联合应用其他防护药物,包括抗氧化剂维生素E,自由基清除剂如辅酶Q10、还原型谷胱甘肽、右丙亚胺,以及钙离子拮抗剂、细胞凋亡抑制剂等[11],其中,右丙亚胺是目前唯一上市的有效防护阿霉素心脏毒性作用的药物,有较明显的心脏保护作用。右丙亚胺发挥心脏保护作用的机制在于一方面右丙亚胺在细胞内的水解产物ADR-925对各种金属离子具有较强的络合作用,可以络合蒽环铁螯合物中的Fe3+,从而降低蒽环类药物代谢产生的自由基水平与脂质过氧化产物浓度,另一方面右丙亚胺可通过调节拓扑异构Ⅱ、抑制心肌细胞凋亡过程来避免心肌的病理损伤[12]。在本研究中,对比应用右丙亚胺组与未给予用药处理的空白对照组,右丙亚胺组的心脏毒性发生比例、心电图异常发生比例,以及心肌酶的升高程度、超声心动图相关参数的改变均显著低于对照组(P<0.05),这说明右丙亚胺对阿霉素致心脏毒性作用方面发挥了一定疗效,具有较为明显的保护心脏毒性作用。陈锐等[13]利用超心动图来评价右丙亚胺对心脏毒性的防治作用,发现右丙亚胺组的LVEF、E/A、Tei变化与柔红霉素化疗前相比较差异无统计学意义(P>0.05),表明右丙亚胺对蒽环类化疗药物的心脏损害有一定保护作用,提高了肿瘤患者对化疗药物毒副作用的耐受性,有利于下一化疗周期的过渡。
近年来中药预防蒽环类药物所致心脏毒性有了一定进展,部分研究已达到分子水平,多种中药注射液应运而生。华蟾素注射液为传统中药材中华大蟾蜍皮及腺体分泌物加工制作后的中药制剂,功效清热解毒、软坚散结、消癥化瘀、杀虫止痛等。现代药理学表明[14]华蟾素具有调节免疫从而增强机体抗肿瘤能力、诱导肿瘤细胞凋亡与分化、抑制肿瘤细胞增值周期等作用,临床常用于辅助其他手段治疗多种肿瘤性疾病。华蟾素的生物活性成分中含有甾类强心苷,相关动物实验表明[15]强心苷可减少家兔心肌细胞中阿霉素的蓄积从而保护心脏受损,因此有研究推测华蟾素能够拮抗阿霉素的心脏毒性作用。刘宏杰等[16]将华蟾素与阿霉素同时给药于SD大鼠,发现应用华蟾素明显升高了血清超氧化物歧化酶(SOD)活性,降低了脂质过氧化物MDA与乳酸脱氢酶(LDH)水平,且心脏组织形态与阿霉素应用前无明显变化,因此认为华蟾素有与右丙亚胺相似的保护心脏毒性、改善心脏病理损害的作用,其发挥作用的机理在于增加机体抗氧化酶如SOD的活性来清除蒽环类药物所产生的自由基、减少脂质过氧化物含量,从而避免自由基对心肌细胞的损害。我们在研究中发现将右丙亚胺与华蟾素注射液联合应用于恶性肿瘤患者的含阿霉素化疗过程中,心脏保护作用较单用右丙亚胺者有更好的效果,主要表现在联合用药组的心脏毒性发生比例(8.0%)显著低于单药组(29.51%)(P<0.05),且联合用药组发生心脏毒性的6例患者中心脏毒性分级4例Ⅰ级,2例Ⅱ级,心脏毒性程度较单药组(Ⅰ级7例,Ⅱ级10例,Ⅲ级1例)更低;联合用药组的心电图异常比例(9.33%)显著低于单药组(14.75%),联合用药组心肌酶CK、CK-MB、TnI与心动超声参数LVIDD、LVISD、A/E、LVEF、FS在化疗前后的变化程度均显著小于单药组(P<0.05)。联合用药表现出较单用右丙亚胺更好的疗效,这与华蟾素注射液与右丙亚胺在机制上均为抗自由基氧化作用来阻止心肌细胞的损伤、因此在心脏保护上具有协同增效作用有关。另有研究表明[17]华蟾素注射液因其显著的抗肿瘤、调节免疫功能更有助于恶性肿瘤患者对抗肿瘤,既能避免阿霉素化疗药物所致的心脏毒性、提高患者耐受力,又能增强化疗药物抗肿瘤的疗效。
综上,右丙亚胺与华蟾素注射液对阿霉素所致心脏毒性均有一定的保护作用,联合用药可明显降低心脏毒性的发生率以及毒性程度,维持正常的心电图、心肌酶以及心功能变化,从而增强恶性肿瘤患者对化疗药物毒副作用的耐受能力、提高肿瘤患者的治疗效果。
[1]罗仁峰,刘敏,张苏川.黄芪注射液/华蟾素注射液联合右丙亚胺对阿霉素相关性心脏毒性的保护作用〔J〕.中国医院药学杂志,2015,33(7):629-632.
[2]吴晖,欧阳取长,李晶,等.右丙亚胺对表柔比星诱导大鼠心肌损伤干预机制研究〔J〕.中华肿瘤防治杂志,2013,37(19):1473-1477.
[3]韩鸿彬,陈嘉勇.华蟾素抗肿瘤作用及其机制的研究进展〔J〕.中国肿瘤生物治疗杂志,2005,41(2):160-162.
[4]杨秀丽.生脉注射液预防多柔比星相关性心脏毒性反应的临床观察〔J〕.中国医药指南,2008,51(15):203-205.
[5]刘宏杰,王文海,周荣耀,等.华蟾素拮抗阿霉素心脏毒性及其作用机制〔J〕.上海中医药杂志,2008,40(11):75-77.
[6]王瑞芹,解英,赵素珍.生脉注射液防治阿霉素相关性心脏毒性的临床观察〔J〕.中西医结合心脑血管病杂志,2006,22(12):1092-1093.
[7]车菲菲,刘瑜,徐才刚.右丙亚胺对阿霉素引起的心脏毒性防治效果及其机制研究〔J〕.四川大学学报(医学版),2010,30(1):24-28.
[8]何晓华,何并文,唐步坚.阿霉素心脏毒性的药物防护〔J〕.中国癌症防治杂志,2010,25(1):60-63.
[9]王焱,李红,朱传升.不同类型免疫抑制剂治疗原发免疫性血小板减少症疗效比较〔J〕.山东医药,2015,36(11):41-43.
[10]贾英杰,李小江,孙一予,等.蒽环类药物心脏毒性及其中药防治〔J〕.时珍国医国药,2010,23(8):2110-2111.
[11]陈莉莉,张晗,姜小庆,等.中药有效成分拮抗化疗药物心脏毒性的分子机制研究进展〔J〕.辽宁中医杂志,2013,18(11):2387-2391.
[12]江英强,宋高平,郑连喜,等.红花注射液防治阿霉素相关性心脏毒性的临床研究〔J〕.现代中西医结合杂志,2010,29(25):3146-3147.
[13]陈锐,邱少东,陈菲,等.超声心动图评价右丙亚胺对柔红霉素化疗所致心脏毒性的防治作用〔J〕.实用医学杂志,2012,30(24):4156-4158.
[14]张丙亮,吴华.华蟾素抗肿瘤作用及其机制的研究进展〔J〕.中外医学研究,2012,40(14):152-154.
[15]贾远源.A药对阿霉素所致大鼠和家兔心肌损伤的保护作用〔D〕.沈阳医科大学,2009.
[16]刘宏杰,束家和,钟薏,等.华蟾素注射液减轻表柔比星心脏毒性的临床研究〔J〕.中西医结合心脑血管病杂志,2014,37(6):761-762.
[17]马军,秦叔逵,沈志祥.蒽环类药物心脏毒性防治指南(2013年版)〔J〕.临床肿瘤学杂志,2013,32(10):925-934.
(编辑:甘艳)
·经验交流·
Influences of Dexrazoxane Monotherapy Combined with Huachansu Injection on Adriamycin Induced Cardiotoxicity in Malignant Tumor Patients
ZHANGGuowen.
SouthernYunnanHongheCentralHospital,Honghe,661000
ObjectiveTo study the effect of dexrazoxane single medicine and Huachansu injection on adriamycin induced cardiotoxicity in malignant tumor patients,and compare the efficacy.Methods166 patients with malignant tumor were randomly divided into single drug group(dexrazoxane single medicine,31 cases),combination group(dexrazoxane and Huachansu injection,75 cases) and the control group(no drug treatment,30 cases),the 3 groups all received chemotherapy regimens with anthracycline-based drugs adriamycin.The control group was not treated with medication treatment before chemotherapy.Single drug group 30 min before chemotherapy was given dexrazoxane injection,dexrazoxane dose compared with adriamycin dose was 20∶1,combination group before chemotherapy was give dexrazoxane and Huachansu injection 15 ml,dexrazoxane dose usage was the same as single drug group.ResultsAfter 4 cycles of chemotherapy,(1) cardiac toxicity ratio was 53.3% in the control group,which was significantly higher than that of single drug group(29.51%)and combination group(8.0%),P<0.05,cardiac toxicity ratio of single drug group was significantly higher than that of combination group,P<0.05.(2)electrocardiogram of the 3 groups had no abnormal changes before the chemotherapy,during chemotherapy process dexrazoxane single medicine group had 9 abnormal cases(14.75%) of electrocardiogram,combination group had 7 cases(9.33%),which was significantly lower than that of the control group,22 cases(73.3%).Electrocardiogram abnormal ratio of combination group was significantly lower than that of single medicine group,P<0.05.(3)CK,CK-MB,TnI of single medicine group and the control group after chemotherapy significantly increased(P<0.05);CK,CK-MB,TnI of combination group after chemotherapy significantly increased(P<0.05),CK-M
B had no significant difference compared with before treatment,P>0.05,the 3 groups before chemotherapy had no significant difference(P>0.05),after chemotherapy,single,medicine group and the combination group was significantly lower than the control group,P<0.05,the combination group was significantly lower than that of single drug group,P<0.05).(4) echocardiography parameters LVIDD,LVISD,A/E,LVEF,FS of single medicine group and the control group before and after chemotherapy had significant difference,P<0.05,the combination group after chemotherapy before treatment had no significant difference(P>0.05).The 3 groups before chemotherapy in echocardiography parameters had no significant difference(P>0.05),after chemotherapy the 3 groups were significantly different(P<0.05).ConclusionDexrazoxane and Huachansu injection for cardiac toxicity caused by adriamycin has certain protective effect,the combination group can obviously reduce the incidence of cardiac toxicity and toxic level,maintain normal electrocardiogram,myocardial enzymes and the change of cardiac function,increase tolerance of patients with malignant tumor to side effects of chemotherapy drug,improve the efficacy of the treatment of patients with tumor.
Adriamycin;Huachansu injection;Dexrazoxane;Tumor;Cardiac toxicity
661000 云南红河州滇南中心医院(个旧市人民医院)
R730.53
A
1001-5930(2016)07-1202-05
2015-09-01
2016-03-21)
