胃癌患者术前行新辅助化疗结合肠内营养支持的临床疗效观察
2016-08-27涂铭李林
涂 铭 李 林
胃癌患者术前行新辅助化疗结合肠内营养支持的临床疗效观察
涂铭李林
目的观察胃癌患者术前行新辅助化疗结合肠内营养支持的临床疗效。方法选取84例进展期胃癌患者为研究对象。随机分为观察组42例和对照组42例。研究组给予术前新辅助化疗结合肠内营养支持治疗,对照组仅给予术前新辅助化疗治疗。观察2组患者营养指标和免疫指标的差异及并发症的发生情况。结果治疗后观察组患者体重、白细胞数、血红蛋白、总蛋白、前清蛋白、转铁蛋白明显高于对照组,差异有统计学意义(P<0.05);观察组患者CD4水平、CD8水平和CD4/CD8明显高于对照组,差异有统计学意义,P<0.05。观察组患者治疗后胃痛、食欲不振、恶心、进食哽咽、腹胀、黑便化疗相关并发症发生率均明显低于对照组,差异有统计学意义(P<0.05)。 结论胃癌患者术前行新辅助化疗结合肠内营养支持可以明显改善患者化疗后的营养状况和免疫水平,增强患者对手术的耐受力,有利于提高患者的生活质量。
胃癌;新辅助化疗;肠内营养
DOI:10.3969/j.issn.1001-5930.2016.07.044
(ThePracticalJournalofCancer,2016,31:1184~1186)
胃癌是发病率较高的恶性肿瘤之一,大多数患者就诊时已是进展期,常合并有低蛋白血症等营养不良状况。术前新辅助化疗是胃癌治疗的1种新方法,自应用于临床以来收到了良好的临床疗效,可以明显提高胃癌患者一期切除率及术后总生存率。但是化疗会加重患者的营养不良状况,降低患者的手术耐受能力和术后生活质量。近年来,胃癌患者术前行新辅助化疗结合肠内营养支持在临床得到广泛应用,此项治疗措施可明显改善患者营养状况,提高手术的疗效。本研究分析了42例行术前新辅助化疗结合肠内营养支持的胃癌患者的临床疗效,现报告如下。
1 资料与方法
1.1研究对象
选取本院消化科2013年1月至2014年12月收治的84例进展期胃癌患者为研究对象。随机分为观察组42例和对照组42例。观察组给予术前新辅助化疗结合肠内营养支持治疗,对照组仅给予术前新辅助化疗治疗。观察组男性28例,女性14例;年龄39~68岁,平均(51.4±5.6)岁;病变位于胃底部15例,胃体11例,胃窦16例;中分化腺癌18例,低分化腺癌16例,黏液腺癌8例;TNM分期,Ⅱ期20例,Ⅲ期22例。对照组男性30例,女性12例;年龄42~71岁,平均(54.2±4.8)岁;病变位于胃底部17例,胃体11例,胃窦14例;中分化腺癌20例,低分化腺癌13例,黏液腺癌9例;TNM分期,Ⅱ期24例,Ⅲ期18例。2组患者一般情况差异无统计学意义,P>0.05,具有可比性。
1.2研究方法
对照组采用FOLFX4方案,即第1天,奥沙利铂100 mg/m2静脉滴注2 h,亚叶酸钙300 mg/m2静脉滴注2 h,氟尿嘧啶400 mg/m2静脉滴注;氟尿嘧啶2 500 mg/m2连续静脉滴注44 h,14 d重复1次,共连续化疗3个疗程。观察组在对照组治疗方案的基础上口服高脂肪、低糖类、含ω-3脂肪酸的营养制剂500 ml/d,每疗程连续口服7 d。
每1疗程化疗结束后测量患者体重、白细胞、血红蛋白、总蛋白、清蛋白、前清蛋白、转铁蛋白等营养指标。检测CD4、CD8免疫评价指标。对比2组患者在营养指标和免疫评价指标的差异。观察2组患者治疗过程中和治疗后并发症的发生情况。
1.3统计学方法
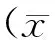
2 结果
2.12组患者营养指标的变化对比
2组患者化疗前各营养指标差异无统计学意义(P>0.05)。第1疗程结束时,观察组患者总蛋白与前清蛋白明显高于对照组,差异有统计学意义(P<0.05);第2、3疗程结束时,观察组患者体重、白细胞数、血红蛋白、总蛋白、前清蛋白,转铁蛋白均明显高于对照组,差异有统计学意义(P<0.05)(表1)。
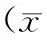
表1 2组患者营养指标的变化对比±s)
注:*为与对照组相比,P<0.05。
2.22组患者免疫指标变化对比
化疗前,2组患者的CD4,CD8和CD4/CD8免疫指标之间无统计学差异(P>0.05)。第1、2疗程结束时,观察组患者CD4水平和CD4/CD8明显高于对照组,差异有统计学意义(P<0.05);第3疗程结束时,观察组患者CD4水平、CD8水平和CD4/CD8明显高于对照组,差异有统计学意义(P<0.05),见表2。
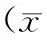
表2 2组患者免疫指标变化对比±s)
注:*为与对照组相比,P<0.05。
2.32组患者治疗过程中及治疗后并发症对比
观察组患者治疗后胃痛、食欲不振、恶心、进食哽咽、腹胀、黑便化疗相关并发症发生率均明显低于对照组,差异有统计学意义,P<0.05(表3)。
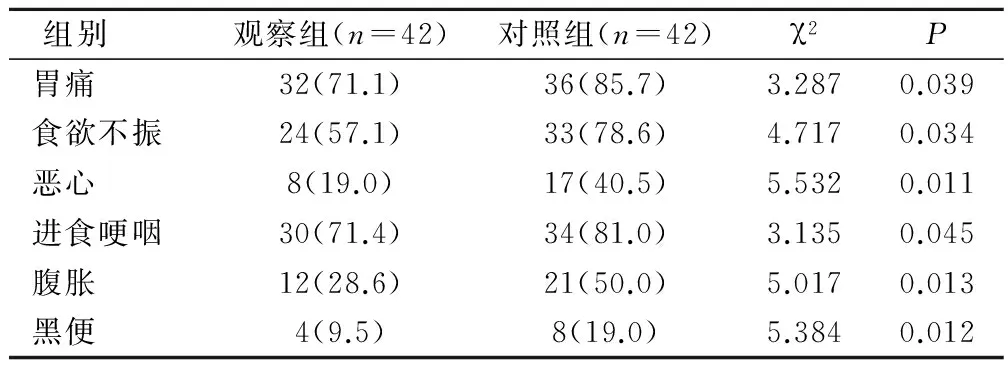
表3 2组患者并发症对比(例,%)
3 讨论
胃癌是消化系统常见肿瘤,进展期胃癌患者确诊时一般合并低蛋白血症等营养不良状况,在治疗的同时给予营养支持已是共识。Wilke等首先将新辅助化疗的治疗方式引入胃癌患者的治疗,迄今为止,新辅助化疗已成为胃癌治疗的主要方式之一[1]。但是,胃癌的新辅助化疗进入到临床的道路相当曲折,MAGIC试验和RTOG9904试验等的重要研究成果才使得这项治疗技术在临床中立足[2-3]。还勇为[4]将FOLFOX新辅助化疗方案应用于治疗进展期胃癌患者,结果发现新辅助化疗组患者治疗总的有效率明显高于单纯手术治疗组。周华亮[5]同样将奥沙利铂、亚叶酸钙联合5-FU(FOLFOX6)的新辅助化疗方案应用于进展期胃癌患者的治疗,结果显示术前采用新辅助化疗的患者肿瘤的根治率明显高于常规手术治疗的患者,其近期有效率也明显高于常规手术组患者。新辅助化疗可以延长患者的生存期,但是化疗药物会造成不同程度的不良反应,主要为骨髓抑制和胃肠道反应,常表现为外周血细胞的减少,恶心,呕吐,食欲不振,腹胀,进食哽咽等,更加重了营养不良的状况[6]。资料显示接受FOLFOX6新辅助化疗方案治疗的胃癌患者70%~80%会出现营养不良,且此方案会造成免疫功能的损伤[7],降低了患者对于手术的耐受能力,从而增加了手术风险和术后并发症的发生,不利于患者术后生活质量的提高。
肠内营养制剂可以刺激腹腔脏器血液循环,改善黏膜血流,有效地改善患者的胃肠道功能[8]。联合新辅助化疗可以改善化疗药物引起的营养不良状况,提高免疫力,减少手术应激反应及并发症的发生,利于患者术后生活质量的提高。黄晋熙等[9]研究显示胃癌患者术前行新辅助化疗结合肠内营养能使肿瘤的增殖活性下降,从而使更多的肿瘤细胞被化疗药物杀死,提高化疗有效率。目前,胃癌患者术前行新辅助化疗结合肠内营养疗法已广泛应用于临床,且取得了良好的效果。张占东等[10]通过对比分析mFOLFOX6化疗方案联合肠内营养制剂疗法治疗和单纯采用mFOLFOX6治疗后患者的各项免疫指标和营养指标,发现胃癌患者术前采用新辅助化疗结合肠内营养制剂支持治疗有利于增强患者免疫水平,改善营养状况和提高化疗耐受性,缓解患者病情,利于患者术后生活质量的提高。本研究的结果与大多数报道一致。42例术前行新辅助化疗结合肠内营养支持的患者化疗后体重、白细胞数、血红蛋白、总蛋白、前清蛋白、转铁蛋白明显高于仅行新辅助化疗的患者,可见联合肠内营养支持能显著改善患者治疗中的营养状况,而且患者CD4水平、CD8水平和CD4/CD8免疫学指标也明显高于仅行新辅助化疗的患者。本研究中2组患者出现的不良反应主要为胃痛、食欲不振、恶心、进食哽咽、腹胀、黑便,联合肠内营养支持组患者的不良反应发生率明显低于仅行新辅助化疗的患者。本研究中患者骨髓抑制不太明显,虽然2组患者化疗后白细胞和血红蛋白值均有所下降,但是还基本在正常范围,未对机体产生严重的不良影响。徐燃[11],黄晋熙等[9]的报道中血红蛋白的值也是在化疗后出现显著下降,但下降的程度并未对机体产生严重的影响。
综上所述,胃癌患者术前行新辅助化疗结合肠内营养支持治疗可以纠正患者的低蛋白血症,明显改善营养不良状态,增强患者的免疫力,提高患者对手术的耐受能力,有利于患者术后病情的缓解及生活质量的提高。
[1]Wilke H,Preusser P,Fink U,et al.Preoperative chemotherapy in locally advanced and nonresectable gastric cancer:a phase Ⅱ study with etoposide,doxorubicin,and cisplation〔J〕.J Clin Oncol,1989,7(9):1318-1326.
[2]Cunningham D,Allum WH,Stenning SP,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer〔J〕.N Engl J Med,2006,355(1):11-20.
[3]Ajani JA,Winter K,Okawara GS,et al.Phase Ⅱ trial of preoperative chemoradiation in patients with localized gastric adenocarcinoma(RTOG9904):quality of combined modality therapy and pathologic response〔J〕.J Clin Oncol,2006,24(24):3953-3958.
[4]还勇为.FOLFOX方案新辅助化疗在治疗进展期胃癌中的疗效观察〔J〕.实用癌症杂志,2013,26(6):678-680.
[5]周华亮.奥沙利铂、亚叶酸钙联合5-FU的新辅助化疗方案在进展期胃癌治疗中的疗效及安全性〔J〕.实用癌症杂志,2015,30(5):744-746.
[6]Fujitani K,Ajani JA,Grane CH,et al.Impact of induction cemotherapy and preoperative chemoradiotherapy on operative morbidity and mortality in patients with locoregional adenocarcinoma of the stomach or gastroesophageal junction〔J〕.Ann Surg Oncol,2007,14(7):2010-2017.
[7]Kim AR,Cho J,Hsu YJ,et al.Changes of quality of life in gastric cancer patients after curative resection:a longitudinal cohort study in Korea〔J〕.Ann Surg,2012,256(6):1008-1013.
[8]郭治.远端胃大部切除术后长期生存胃癌患者的生活质量〔J〕.中国医科大学学报,2011,40(6):568-570.
[9]黄晋熙,杨铁军,王程虎,等.术前新辅助化疗结合肠内营养对胃癌患者肿瘤细胞增殖活性的影响〔J〕.中国现代医学杂志,2015,25(3):28-30.
[10]张占东,杨铁军,孔烨,等.新辅助化疗结合肠内营养制剂支持对胃癌患者术前的影响研究〔J〕.中国医学前沿杂志(电子版),2014,6(10):23-25.
[11]徐燃,李燕,王卫星,等.新辅助化疗结合部分肠内营养对胃癌患者营养状况及免疫功能的影响〔J〕.交通医学,2009,23(5):538-539.
(编辑:甘艳)
Clinical Efficacy of Preoperative Neoadjuvant Chemotherapy Combined with Enteral Nutrition Support for Gastric Cancer
TUMing,LILin.
The92HospitalofNanping,Nanping,353000
ObjectiveTo observe the clinical effects of neoadjuvant chemotherapy combined with enteral nutrition support for gastric cancer.Methods84 cases of advanced gastric cancer were randomly divided into the study group(42 cases) and the control group(42 cases).The study group was given preoperative neoadjuvant chemotherapy combined with enteral nutrition therapy,the control group received preoperative neoadjuvant chemotherapy treatment.The differences in nutritional,immune parameters and the occurrence of complications between the 2 groups were observed.ResultsAfter treatment,weight,white blood cell count,hemoglobin,total protein,prealbumin and transferrin of the observation group were significantly higher those of the control group,the difference was statistically significant(P<0.05).The levels of CD4,CD8 and CD4/CD8 in the observation group were significantly higher than those of the control group,the difference was statistically significant,P<0.05. Chemotherapy related complications such as stomach pain,loss of appetite,nausea,eating choked,abdominal distension,and melena of the observation group were significantly lower than those of the control group,the difference was statistically significant(P<0.05).ConclusionNeoadjuvant chemotherapy combined with enteral nutrition support can significantly improve the nutritional status and immune level of patients with gastric cancer after chemotherapy.It can enhance the patient's tolerance to the operation and improve the quality of life of patients.
Gastric cancer;Neoadjuvant chemotherapy;Enteral nutrition
353000 福建省南平市第九二医院
李林
R735.2
A
1001-5930(2016)07-1184-03
2015-09-07
2016-02-14)
