马铃薯HD-Zip I家族ATHB12基因的克隆及功能鉴定
2016-08-27武亮亮杨江伟宁司怀军
武亮亮 姚 磊 马 瑞 朱 熙 杨江伟 张 宁司怀军
甘肃省作物遗传改良与种质创新重点实验室, 甘肃省干旱生境作物学省部共建国家重点实验室培育基地 / 甘肃农业大学生命科学技术学院, 甘肃兰州 730070
马铃薯HD-Zip I家族ATHB12基因的克隆及功能鉴定
武亮亮 姚 磊 马 瑞 朱 熙 杨江伟 张 宁*司怀军
甘肃省作物遗传改良与种质创新重点实验室, 甘肃省干旱生境作物学省部共建国家重点实验室培育基地 / 甘肃农业大学生命科学技术学院, 甘肃兰州 730070
HD-Zip I是一类植物特异转录因子, 在植物应对外界逆境胁迫过程中有重要的调控作用。本研究从马铃薯栽培品种甘农薯2号中克隆了HD-Zip I转录因子ATHB12基因, 其开放阅读框为759 bp, 编码252个氨基酸残基。该基因位于马铃薯第1染色体, 其启动子区含有ABRE、LTRECOREATCOR15和WBOXATNPR1等多种响应非生物胁迫(ABA、低温、脱水和高盐)的顺式作用元件。ATHB12基因在马铃薯根、茎和叶中均有表达, 其根中表达量最高。qRT-PCR分析证实该基因的表达受聚乙二醇(PEG)、NaCl和 ABA诱导, 受低温抑制。构建了由组成型表达启动子CaMV 35S驱动的ATHB12基因的过表达载体, 通过农杆菌介导法转化马铃薯获得了转基因植株。干旱处理后, 转基因植株叶片中丙二醛含量显著低于非转基因植株(P < 0.05), 而脯氨酸含量显著高于非转基因植株(P < 0.05); 转基因植株根鲜重和干重均高于非转基因植株; 说明马铃薯ATHB12基因可能参与了逆境胁迫的响应。
马铃薯; HD-Zip; ATHB12基因; 根; 丙二醛; 脯氨酸
同源异型域亮氨酸拉链蛋白(homeodomain-leucine zipper, HD-Zip)是植物特异转录因子, 由DNA同源结构域(HD)和附加的Leu zipper (LZ)元件组成, 前者与DNA特异结合, 后者介导蛋白二聚体的形成[1]。依据 HD-ZIP转录因子结构和功能差异, 可将其分为HD-Zip I、HD-Zip II、HD-Zip III和HD-Zip IV四类[1]。HD-Zip转录因子已分别从拟南芥(Arabidopsis thaliana L.)[2]、烟草(Nicotiana tabacum L.)[3]、苜蓿(Medicago truncatula L.)[4]和小立碗藓(Physomitrella patens H.)[5]中被克隆出来, 并对其响应非生物胁迫的功能进行了研究。HD-Zip转录因子亚家族I和II表达受干旱、高盐和冷害等非生物胁迫因子的诱导, 这两类基因参与激素信号途径, 通过与合成激素途径相关基因和下游功能基因互作来调控植物形态结构或生理状态从而提高植物耐逆性[1]。HD-Zip I类转录因子调节植物干旱胁迫应答方面有ABA依赖型和ABA非依赖型[1]。缺水胁迫和外源ABA诱导拟南芥HD-Zip I类转录因子基因 ATHB6、ATHB7和 ATHB12表达, 表明ATHB6、ATHB7, ATHB12受水分胁迫方面起着正向调节作用[6-7]。还魂草(Craterostigma plantagineum)中,HD-Zip I类转录因子基因的4个成员CpHB4、CpHB5、CpHB6、CpHB7表达均受到脱水胁迫所调节, 但CpHB4、CpHB5的表达量在ABA胁迫下没有变化; 而CpHB6、CpHB7表达量同时受脱水胁迫和ABA所调节[8]。来自于向日葵Hahb4基因在拟南芥中过量表达能显著增强耐旱性, 植株长势表现出了节间缩短, 叶片变窄等适应干旱的性状[9]。玉米中, 超表达Zmhdz10基因提高了对盐和干旱胁迫的抗性, 对于ABA敏感性增强, 叶片中丙二醛(MDA)含量降低, 脯氨酸(Pro)含量增高[10]。这些成员均含有1个HD和1个LZ结构域, 属于HD-Zip I型HD-Zip转录因子亚家族。
马铃薯(Solanum tuberosum L.)是重要的粮菜兼用作物。Xu等[11]根据马铃薯基因组测序结果用生物信息学方法预测了马铃薯ATHB12-like基因(GenBank登录号为XM_006339695)序列, 但关于马铃薯HD-Zip I类转录因子的功能的研究还未见报道。本研究根据ATHB12-like基因的cDNA序列设计引物, 克隆了ATHB12基因, 对其进行了生物信息学分析和不同胁迫条件下的表达分析, 并通过转基因技术在马铃薯中过表达后对其功能进行了鉴定, 取得的结果对于进一步研究马铃薯HD-Zip I转录因子的功能奠定了基础。
1 材料与方法
1.1 植物材料、菌株、载体和试剂
将马铃薯栽培品种甘农薯2号的无菌苗剪成带有腋芽的茎段, 转接到含50 mL MS+3%蔗糖液体培养基的150 mL三角瓶中, 每瓶接5株。在光照800 μmol s-1m-2、光照时间16 h d-1、温度(23±1)℃下培养3周形成壮苗。参照张宁等[12]的方法诱导试管薯。大肠杆菌(Escherichia coli) DH5α感受态购自北京全式金生物技术有限公司; 质粒载体pMD18-T购自大连宝生物工程公司; 表达载体pBI121、根癌农杆菌(Agrobacterium tumefaciens)菌株LBA4404由甘肃省作物遗传改良与种质创新重点实验室保存。Taq PCR Mastermix、限制性核酸内切酶、T4 DNA连接酶、SuperReal PreMix Plus (SYBR Green)荧光染料、RNA提取试剂盒(RNAprep Pure Plant Kit)、高纯质粒小提试剂盒和琼脂糖凝胶回收试剂盒等均购于TIANGEN公司; 反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit)购自Thermo Fermentas;由生工生物工程(上海)股份有限公司合成引物, 其余试剂均为国产分析纯。
1.2 总RNA提取、反转录及目的基因的克隆
参照RNAprep Pure Plant Kit说明书提取生长3周后整株幼苗的RNA, 参照RevertAid First Strand cDNA Synthesis Kit说明书合成cDNA第1链。根据马铃 薯 ATHB-12-like基 因 (GenBank登 录 号 为XM_006339695)序列, 利用Primer Premier 5.0设计包含全长开放阅读框序列的基因特异正向引物ATHB12-F (5'-GCTCTAGA GAACATTCCAGTTCCA ATCC-3')和反向引物ATHB12-R (5'-CGGGATCCTC AAATGTACAAGAGTCGCG-3') (其中画线部分分别为Xba I和Bam H I酶切位点, 斜体部分为保护碱基),预期扩增片段为911 bp。PCR体系含: Taq PCR Mastermix 12.5 µL、10 µmol L-1ATHB12-F和ATHB12-R各1 µL、500 ng µL-1cDNA模板1 µL,ddH2O补足至25 µL。PCR条件为: 94℃预变性4 min;94℃变性30 s, 59℃退火45 s, 72℃延伸1 min, 循环35次; 72℃继续延伸10 min。PCR产物经电泳回收后连接到载体pMD18-T, 转化DH5α感受态细胞, 经菌落PCR鉴定, 选取阳性克隆送上海生工生物工程有限公司测序, 将其命名为ATHB12基因。
1.3 ATHB12基因的生物信息学分析
用 ProtParam (http://web.expasy.org/protparam/)分析ATHB12基因编码氨基酸的理化性质, 用PGSC (http://www.potatogenome.net/index.php/Main_Page)确定基因在染色体组中的位置信息, 用在线网站PLACE (http://www.dna.affrc.go.jp/PLACE/)预测并分析基因的顺式作用元件; 在 NCBI (http://www.ncbi.nlm.nih.gov/)进行 Blast同源性比对, 并选择同源性较高的8种植物, 运用DNAMAN软件进行氨基酸多序列比对分析; 采用在线工具 GSDS (http:// gsds.cbi.pku.edu.cn/)确定ATHB12基因的内含子和外显子。
1.4 胁迫处理
选取液体培养3周且生长基本一致的马铃薯试管苗, 倒掉三角瓶中的液体培养基, 分别加入含20% PEG-6000、0.1 mmol L-1ABA和200 mmol L-1NaCl的3%MS液体培养基, 并分别设置对照, 置800 μmol s-1m-2, 16 h d-1光照, 温度(23±1)℃下胁迫处理; 置800 μmol s-1m-2, 16 h d-1光照的4℃培养箱低温处理。在处理后0、4、8、12和24 h后采集整株幼苗, 用液氮速冻后于-80℃超低温冰箱保存备用。
1.5 以 qRT-PCR分析基因的组织表达和胁迫诱导下的表达特性
取3%MS液体培养基培养3周的马铃薯试管苗的根、茎和叶, 以及胁迫处理的马铃薯材料提取RNA, RNA提取及cDNA合成方法见1.2。用实时荧光定量PCR(qRT-PCR)分析基因的表达特性。用软件primer premier 5.0设计ATHB12基因的qRT-PCR引物ATHB12-qF (5'-TCGGGTTAGATGACGATGCAG -3')和 ATHB12-qR (5'-ATCGTCGTTTAGACTGCCC C-3')。用马铃薯延伸因子(ef1a) (GenBank登录号为XM_006347752)基因作内参基因, 引物序列为 ef1a-F (5'-TCACTGGGTACCAAGCCTCA-3')和ef1a-R (5'-CCAGCACCTTCACCGGATAC-3')。参照TIANGEN公司SuperReal PreMix Plus (SYBR Green)试剂盒说明书进行实时定量PCR。PCR体系含 cDNA模板2 µL、2×SuperReal PreMix Plus 10 µL、50×ROX Reference Dye 0.4 µL、10 µmol L-1引物各0.6 µL, 加ddH2O至终体积20 µL。反应在Mxpro Mx3005p仪器上进行, PCR程序为95℃预变性30 s; 95℃ 15 s,60℃ 33 s, 72℃ 1 min, 共40个循环, 最后72℃延伸10 min。用2-ΔΔCt法进行相对定量分析[13]。试验3次生物学重复, 所有样品均进行 3次技术重复取平均值, 并以生物学重复计算其标准偏差。用 Origin 8.0软件作图, 用 SPSS17软件进行方差分析, 用Duncan’s法进行显著性分析(P < 0.05)。
1.6 基因过表达载体的构建
分别用Xba I和Bam H I双酶切ATHB12基因的克隆载体质粒和表达载体pBI121, 将酶切后纯化的克隆载体小片段(ATHB12基因)和表达载体大片段混合,用T4 DNA连接酶16℃过夜连接, 转化大肠杆菌感受态DH5α, 经酶切鉴定后将重组质粒命名为pBI121-ATHB12。采用冻融法将重组质粒导入农杆菌LBA4404制备工程菌液用于遗传转化[14]。
1.7 马铃薯的遗传转化及检测
参照张宁等[12]的操作方法, 以马铃薯栽培品种甘农薯2号的试管薯作为遗传转化受体。按照Edwards等[15]的方法从转化马铃薯植株中提取基因组总DNA, 以未转化的植株作阴性对照, 重组质粒pBI121-ATHB12作阳性对照。以总DNA为模板, 用pBI121表达载体上的选择标记基因nptII设计引物进行PCR扩增, 引物序列为nptII-F (5'-GCTATGACTG GGCACAACAG-3')和nptII-R (5'-ATACCGTAAAGC ACGAGGAA-3')。PCR扩增程序为 94℃ 3 min; 94 ℃ 30 s, 57℃ 40 s, 72℃ 1 min, 35个循环; 72℃延伸10 min, 预期的扩增片段为676 bp。用qRT-PCR分析转基因植株与对照植株整株幼苗中ATHB12基因的相对表达量, 方法同1.5。
1.8 转基因植株丙二醛和脯氨酸含量的测定及表型观察
将转基因马铃薯无菌试管苗分别剪取带有顶芽的长1 cm外植体, 转接到含有45 mL 3%MS固体培养基的100 mL试管中, 每管接种1个顶芽, 置于800 μmol s-1m-2, 16 h d-1光照下培养3周, 测定试管苗的株高(根原基以上部分长度)、根鲜重及干重(鲜重即从培养基中取出所有根后蒸馏水洗净, 滤纸吸干水分后的重量; 干重是将鲜样在80℃烘箱干燥至恒重的重量)。每个转基因植株与对照共设5个重复。按照1.4中描述的方法PEG-6000胁迫处理5 d后取植株所有叶片, 参照陈建勋和王晓峰[16]的方法测定丙二醛(MDA)和脯氨酸(Pro)含量。在数据处理时候运用相对值, 即统计分析每个材料PEG处理后的值与未处理的值之比。混合每瓶5株植株所有叶片为一个处理, 每个处理与对照共设5个重复。试验重复3次,取平均值。用Origin8.0软件整理数据和作图, 用SPSS.17.0软件统计分析。
2 结果与分析
2.1 ATHB12基因cDNA克隆及生物信息学分析
以马铃薯总RNA反转录获得的cDNA为模板,用ATHB12基因的引物ATHB12-F和ATHB12-R扩增得到长度约900 bp的PCR扩增片段(图1), 将PCR产物切胶回收后连接至载体pMD18-T, 转化大肠杆菌DH5α, 提取质粒测序表明其序列与马铃薯ATHB-12-like (GenBank登录号为XM_006339695)同源性达到100%。
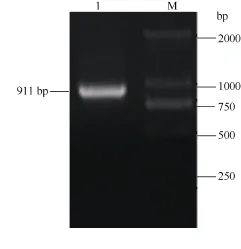
图1 马铃薯ATHB12基因PCR扩增Fig. 1 PCR of ATHB12 gene in potato
生物信息学分析显示该基因包含一个759 bp的开放读码框, 编码252个氨基酸残基, 等电点为5.64,分子量约28.71 kD, 位于马铃薯第1染色体。氨基酸序列多重对比发现不同物种间ATHB12基因编码蛋白在HD区域存在很高的保守型, LZ基序差异较大(图2)。基因结构分析发现ATHB12基因包含1个内含子和2个外显子。对ATHB12起始密码子上游1500 bp的启动子区序列分析发现除含有TATA-box和CAAT-box等基本转录元件外, 还存在多种激素响应元件, 包括ABA响应元件ABRE、MYB1AT和MYCCONSENSUSAT; 赤霉素应答元件、水杨酸应答元件GL1CONSENSUS等; 同时, ATHB12启动子区域还包含了许多胁迫应答相关的顺式作用元件,如脱水响应元件MYB1AT和MYB2AT, 低温应答元件LTRECOREATCOR15; 黄酮类化合物和花青素合成相关元件EBOXBNNAPA和MYBCORE (表1)。
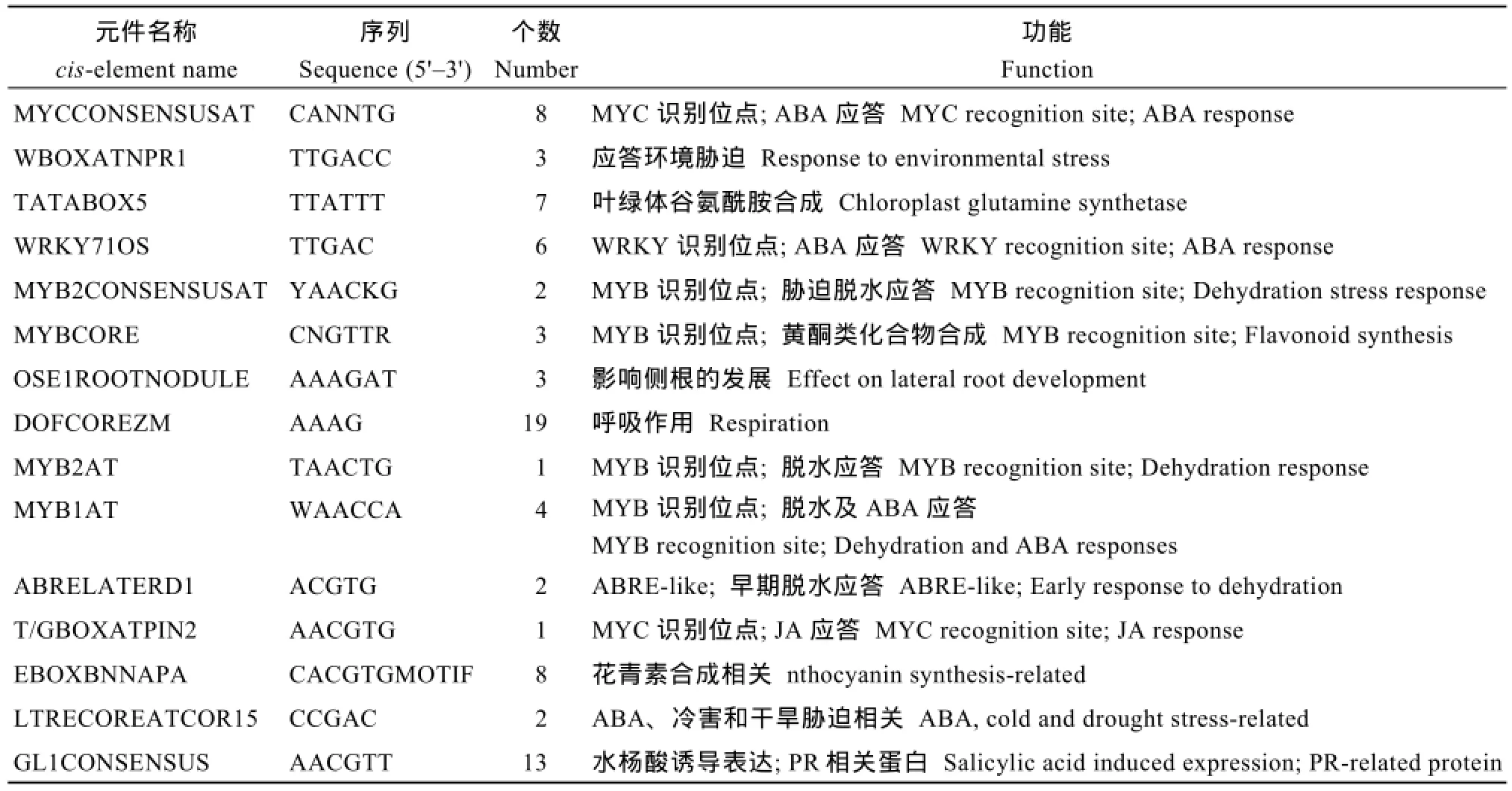
表1 ATHB12启动子区顺式作用元件预测分析Table 1 Putative cis-acting regulatory elements in the ATHB12 promoter
2.2 ATHB12基因在马铃薯不同组织中的表达分析
通过qRT-PCR检测到ATHB12在马铃薯试管苗不同部位(根、茎、叶)中均有表达, 其相对表达量为根>叶>茎, 在根中表达较高, 是茎中表达量的3.5倍(图3)。
2.3 ATHB12基因胁迫诱导下的表达特性分析
利用qRT-PCR方法分析了PEG、NaCl、ABA、低温等非生物胁迫条件下马铃薯整株幼苗中ATHB12的表达模式。结果表明该基因的表达明显受PEG、NaCl和ABA诱导, 而受低温抑制(图4)。在PEG胁迫8 h, ATHB12基因表达快速上调至最高水平, 然后逐渐下降, 至12 h表达水平略高于4 h, 24 h又迅速上升(图4); ATHB12基因在受到NaCl胁迫时表现出上升趋势, 12 h表达量达到最高值, 24 h表达量有所下降(图4); 在ABA处理下, ATHB12基因的表达量在 4 h快速上升至最高水平, 随着处理时间的延长, 表达水平逐步下降, 至24 h接近未处理时的表达水平(图 4)。ATHB12在低温胁迫下, 表现出相反的表达模式, 即呈下调趋势。在低温胁迫4 h后明显被抑制, 之后逐渐上升(图 4)。这些结果表明ATHB12基因参与了马铃薯对PEG、NaCl、ABA和低温的应答反应。

图2 马铃薯ATHB12氨基酸序列与其他物种同源氨基酸序列多重比对结果Fig. 2 Alignment of the potato ATHB12 amino acid sequence and its homologous amino acid sequences from other species下画线: HD结构域; 虚线: LZ基序。Underline: HD domain; Dot line: LZ motif.
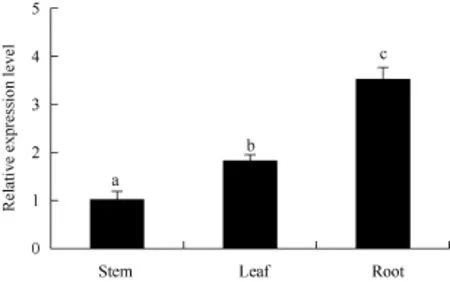
图3 马铃薯ATHB12基因在不同器官中的qRT-PCR表达检测Fig. 3 qRT-PCR assay of ATHB12 gene in different organs of potato
2.4 转基因马铃薯植株的获得及鉴定
马铃薯试管薯薄片在芽分化培养基上经过 2周的培养, 转化薯片直接长出绿色小芽(图5-A)。剪接至生根选择培养基经过 2周培养, 未转化植株不生根, 而转化植株能够正常生根(图5-B)。分别提取未转化植株和转化马铃薯植株的总 DNA, 用 nptII基因作为筛选标记进行PCR检测, 获得PCR呈阳性的植株8株(图6)。对鉴定为阳性的转基因马铃薯进行qRT-PCR分析表明, ATHB12基因已在转基因植株中得到了不同程度的超量表达(L5的表达量有所下降)(图 7)。选取其中 2个表达量较高的转基因株系(L1和L7)进行后续的表型观察和生理指标测定。
2.5 丙二醛和脯氨酸含量的测定
未处理前, MDA含量在L1、L7和CK中无显著差异; PEG处理5 d后CK叶片中MDA含量是处理前的2.43倍(图8和表2)。MDA含量相对值在CK中大于L1、L7, 但无显著差异(表2)。未处理前, Pro含量在L1、L7叶片中高于CK; PEG处理5 d后, Pro含量在CK和L1、L7叶片中都上升(图8)。Pro含量相对值在CK中显著小于L1、L7 (表2)。
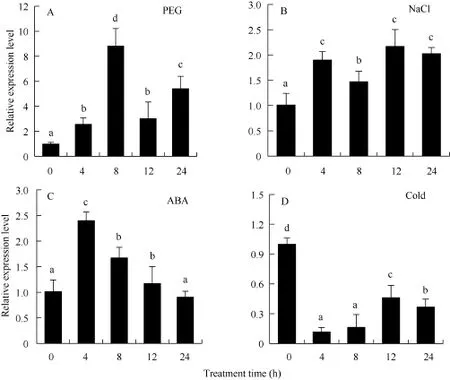
图4 马铃薯ATHB12基因在不同胁迫条件下的qRT-PCR表达检测Fig. 4 qRT-PCR assay of ATHB12 gene of potato under different stress treatments

图5 马铃薯的转化Fig. 5 Potato transformation
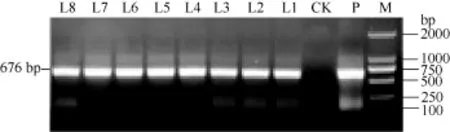
图6 转化马铃薯的PCR检测Fig. 6 PCR identification of ATHB12 transgenic potato plants
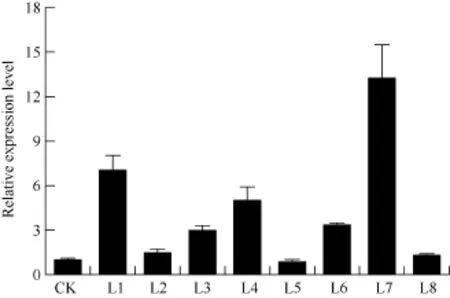
图7 以qRT-PCR分析转基因植株中ATHB12基因的表达水平Fig. 7 Expression level of ATHB12 gene in the transgenic plants assayed by qRT-PCR
2.6 转ATHB12基因试管苗生物学性状的差异
为了验证ATHB12在转基因植株中的作用, 观察了试管苗在根系方面差异, 结果发现与非转基因的对照相比, 转基因植株的根系增多, 而株高无明显变化(图9和表3); 转基因株系L1和L7的根鲜重和干重均高于非转基因的对照(表3)。
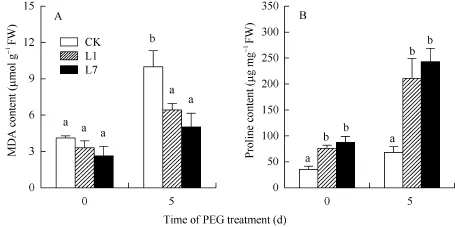
图8 转基因植株的丙二醛和脯氨酸含量Fig. 8 MDA and proline content in the transgenic potato plants
A: 丙二醛含量, B: 脯氨酸含量; CK: 非转基因植株; L1, L7: 转基因植株。数据为5次生物学重复的平均值±标准偏差, 柱上不同字母表示差异显著(P<0.05)。

表2 转基因植株的丙二醛和脯氨酸含量相对值Table 2 Relative value of MDA and proline content in the transgenic potato plants
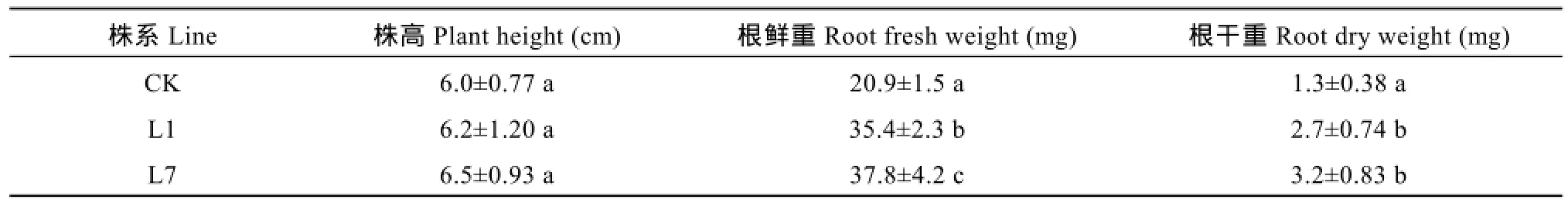
表3 转基因植株试管苗株高和根重Table 3 Plant height and root weight of the transgenic test-tube plant
3 讨论
Ollson等[7]的研究结果表明HD-Zip I家族基因参与了植物非生物胁迫响应和耐受性。已有的研究结果表明, HD-Zip I家族的一些成员主要通过调节糖类代谢信号通路基因[17]、叶片性状[18]、茎和节间长度[19]、减少内源ABA含量[20]、增强维生素C的含量[21]等改变外在形态结构或增加内源渗透调节物质来提高植物的抗氧化能力以应对一系列逆境胁迫。
本研究利用马铃薯基因组测序后预测的ATHB-12-like基因开放阅读框序列设计引物, 从马铃薯品种甘农薯2号中克隆了ATHB12基因。该基因与拟南芥ATHB5、ATHB7、ATHB12均具有很高的序列相似性, 同属HD-Zip I亚家族。拟南芥ATHB5、ATHB7、ATHB12已被证明参与了ABA相关的非生物胁迫调节过程[7]。玉米、黄瓜中一些HD-Zip I家族基因的启动子区域含有ABRE、DRE、LTRE等元件, 研究表明此类基因参与植物响应胁迫调节[10,22]。花青素、类黄酮化合物的积累是植物应答逆境胁迫的一个重要特性,具有调节植物的耐旱性等功能[23]。基因的诱导表达与其启动子区的顺式作用元件密切相关, ATHB12启动子分析暗示其参与了胁迫响应和次生代谢物调节。
基因的组织表达特异性直接反映该基因在相应部位的生物学功能, 相关研究证实了植物中HD-Zip I基因具有组织表达特异性[24]。Capella等[19]的报道表明AtHB1基因在拟南芥根部和下胚轴的表达量高于茎、叶等器官, 具有促进下胚轴延伸的功能。Liu等[22]发现黄瓜叶片和花器官中CsHDZI10基因的表达量高于其他组织。本研究初步发现ATHB12在根部表达量较高, 暗示该基因主要参与根系生长发育调节。同一个转录因子在受多种胁迫诱导表达的同时, 往往另外一种胁迫抑制其表达[25-26]。ZmNF-YA14转录因子的表达受到盐胁迫诱导, PEG和ABA抑制其表达[27]。Hou等[28]研究发现盐胁迫诱导MYB类转录因子CsMYB55表达, 甘露醇抑制其表达。本研究结果表明ATHB12的表达受干旱、高盐和ABA等胁迫的诱导, 受低温抑制, 这与前人研究其他转录因子的结果类似, 表明植物应答非生物胁迫的信号途径非常复杂。生物信息学分析结合逆境表达试验结果, 表明ATHB12基因参与了马铃薯对PEG、NaCl、ABA和低温的响应。

图9 转基因植株试管苗表型差异Fig. 9 Phenotype difference between the transgenic test-tube plants and the control
Ariel等[4]研究发现苜蓿中MtHB1基因过表达使得侧根减少, 根系变长。水稻中Oshox4基因过表达使地上部分变矮[29]。这与我们的研究结果不一致,可能是物种间的差异所致。非生物胁迫会使植物合成渗透调节物质, 其含量的变化可以作为评价植物耐性的指标, Pro是最普遍的渗透调节物质之一。植物在正常条件下Pro含量很低, 逆境条件下, 植物体内游离Pro便会大量积累, 积累量与植物的抗逆性呈正相关[30]。本研究中, 转基因马铃薯叶片中Pro的相对含量高于非转基因植株, 推测ATHB12基因超表达提高马铃薯对PEG胁迫的抗性, 可能是通过促进叶片内Pro的积累而减少渗透胁迫对细胞结构的损害,保护细胞膜的完整性, 维持植物细胞正常的代谢活动。非生物胁迫下, 植物体内会产生大量超氧自由基(ROS), 造成植物细胞膜的过氧伤, MDA是膜脂过氧化的产物之一, 是衡量氧化胁迫的标志物, 用来评估氧化胁迫对膜的损伤程度[30]。本研究中转基因株系叶片中MDA含量相对值低于非转基因植株, 说明超表达ATHB12基因可减少膜脂过氧化程度, 减轻对膜系统的损伤, 提高马铃薯对PEG胁迫的抗性。综合结果分析说明马铃薯ATHB12基因可能参与了胁迫应答, 但相关的分子机制有待进一步研究。
4 结论
ATHB12基因启动子区含有胁迫应答相关的调控元件, 该基因的表达受PEG、NaCl和ABA诱导,受低温的抑制。ATHB12基因在马铃薯根、茎、叶中均有表达, 其中根中表达量最高。ATHB12基因调控马铃薯根系的发育和MDA与Pro的含量, 推测该基因可能参与调控植物对非生物胁迫因子的应答。
References
[1] Ariel F D, Manavella P A, Dezar C A, Chan R L. The true story of the HD-Zip family. Trends Plant Sci, 2007, 12: 419-426
[2] De Smet I, Lau S, Ehrismann J S, Axiotis I, Kolb M, Kientz M,Weijers D, Jurgens G. Transcriptional repression of BODENLOS by HD-ZIP transcription factor HB5 in Arabidopsis thaliana. J Exp Bot, 2013, 64: 3009-3019
[3] Re D A, Dezar C A, Chan R L, Baldwin I T, Bonaventure G. Nicotiana attenuata NaHD20 plays a role in leaf ABA accumulation during water stress, benzylacetone emission from flowers,and the timing of bolting and flower transitions. J Exp Bot, 2011,62 :155-166
[4] Ariel F, Diet A, Verdenaud M, Gruber V, Frugier F, Chan R,Crespi M. Environmental regulation of lateral root emergence in Medicago truncatula requires the HD-Zip I transcription factor HB1. Plant Cell, 2010, 22: 2171-2183
[5] Sakakibara K, Nishiyama T, Kato M, Hasebe M. Isolation of homeodomain-leucine zipper genes from the moss Physcomitrella patens and the evolution of homeodomain-leucine zipper genes in land plants. Mol Biol Evol, 2001,18: 491-502
[6] Soderman E, Hjellstrom M, Fahleson J, Engstrom P. The HD-Zip gene ATHB6 in Arabidopsis is expressed in developing leaves,roots and carpels and up-regulated by water deficit conditions. Plant Mol Biol, 1999, 40: 1073-1083
[7] Olsson A S, Engstrom P, Soderman E. The homeobox genes ATHB12 and ATHB7 encode potential regulators of growth in response to water deficit in Arabidopsis. Plant Mol Biol, 2004, 55:663-677
[8] Deng X, Phillips J, Meijer A H, Salamini F, Bartels D. Characterization of five novel dehydration-responsive homeodomain leucine zipper genes from the resurrection plant Craterostigma plantagineum. Plant Mol Biol, 2002, 49: 601-610
[9] Dezar C A, Gago G M, Gonzalez D H, Chan R L. Hahb-4, a sunflower homeobox-leucine zipper gene, is a developmental regulator and confers drought tolerance to Arabidopsis thaliana plants. Transgenic Res, 2005, 14: 429-440
[10] Zhao Y, Ma Q, Jin X, Peng X, Liu J, Deng L, Yan H, Sheng L,Jiang H, Cheng B. A novel maize homeodomain-leucine zipper (HD-Zip) I gene, Zmhdz10, positively regulates drought and salt tolerance in both rice and Arabidopsis. Plant Cell Physiol, 2014,55: 1142-1156
[11] Potato Genome Sequencing Consortium, Xu X, Pan S, Cheng S,Zhang B, Mu D, Ni P, Zhang G, Yang S, Li R, Wang J, Orjeda G,Guzman F, Torres M, Lozano R, Ponce O, Martinez D, De la Cruz G, Chakrabarti S K, Patil V U, Skryabin K G, Kuznetsov B B, Ravin N V, Kolganova T V, Beletsky A V, Mardanov A V, Di Genova A, Bolser D M, Martin D M, Li G, Yang Y, Kuang H, Hu Q, Xiong X, Bishop G J, Sagredo B, Mejía N, Zagorski W,Gromadka R, Gawor J, Szczesny P, Huang S, Zhang Z, Liang C,He J, Li Y, He Y, Xu J, Zhang Y, Xie B, Du Y, Qu D, Bonierbale M, Ghislain M, Herrera Mdel R, Giuliano G, Pietrella M, Perrotta G, Facella P, O'Brien K, Feingold S E, Barreiro L E, Massa G A,Diambra L, Whitty B R, Vaillancourt B, Lin H, Massa A N,Geoffroy M, Lundback S, DellaPenna D, Buell C R, Sharma S K,Marshall D F, Waugh R, Bryan G J, Destefanis M, Nagy I,Milbourne D, Thomson S J, Fiers M, Jacobs J M, Nielsen K L,Sønderkær M, Iovene M, Torres G A, Jiang J, Veilleux R E,Bachem C W, de Boer J, Borm T, Kloosterman B, van Eck H,Datema E, Hekkert B L, Goverse A, van Ham R C, Visser R G.. Genome sequence and analysis of the tuber crop potato. Nature,2011, 475: 189-195
[12] 张宁, 司怀军, 王蒂. 拟南芥rd29A基因启动子克隆及其在马铃薯抗胁迫转基因中的应用. 作物学报, 2005, 31: 159-164 Zhang N, Si H J, Wang D. Cloning of rd29A gene promoter from Arabidopsis thaliana and its application in stress-resistance transgenic potato. Acta Agron Sin, 2005, 31: 159-164 (in Chinese with English abstract)
[13] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T)) method. Methods, 2001, 25: 402-408
[14] 司怀军, 谢从华, 柳俊. 农杆菌介导的马铃薯试管薯遗传转化体系的优化及反义Class Ipatatin基因的导入. 作物学报, 2003,29: 801-805
Si H J, Xie C H, Liu J. An efficient protocol for Agrobacterium-mediated transformation with microtuber and the introduction of an antisense class I patatin gene into potato. Acta Agron Sin, 2003, 29: 801-805 (in Chinese with English abstract)
[15] Edwards K, Johnstone C, Thompson C. A simple and rapid method for the preparation of plant genomic DNA for PCR analysis. Nucl Acids Res, 1991, 19: 1349-1352
[16] 陈建勋, 王晓峰. 植物生理学实验指导. 广州: 华南理工大学出版社, 2002. pp 119-124
Chen J X, Wang X F. Experiment Manual for Plant Physiology. Guangzhou: South China University of Technology Press, 2002. pp 119-124 (in chinese)
[17] Prigge M J, Otsuga D, Alonso J M, Ecker J R, Drews G N, Clark S E. Class III homeodomain-leucine zipper gene family members have overlapping, antagonistic, and distinct roles in Arabidopsis development. Plant Cell, 2005, 17: 61-76
[18] Wang Y, Henriksson E, Soderman E, Henriksson K N, Sundberg E, Engstrom P. The Arabidopsis homeobox gene, ATHB16, regulates leaf development and the sensitivity to photoperiod in Arabidopsis. Dev Biol, 2003, 264: 228-239
[19] Capella M, Ribone P A, Arce A L, Chan R L. Arabidopsis thaliana HomeoBox 1 (AtHB1), a Homedomain-Leucine Zipper I (HD-Zip I) transcription factor, is regulated by PHYTOCHROMEINTERACTING FACTOR 1 to promote hypocotyl elongation. New Phytol, 2015, 207: 669-682
[20] Zhang S, Haider I, Kohlen W, Jiang L, Bouwmeester H, Meijer A H, Schluepmann H, Liu C M, Ouwerkerk P B. Function of the HD-Zip I gene Oshox22 in ABA-mediated drought and salt tolerances in rice. Plant Mol Biol, 2012, 80: 571-585
[21] Hu T, Ye J, Tao P, Li H, Zhang J, Zhang Y, Ye Z. Tomato HD-Zip I transcription factor, SlHZ24, modulates ascorbate accumulation through positively regulating the D-mannose/L-galactose pathway. Plant J, 2016, 85: 16-29
[22] Liu W, Fu R, Li Q, Li J, Wang L, Ren Z. Genome-wide identification and expression profile of homeodomain-leucine zipper Class I gene family in Cucumis sativus. Gene, 2013, 531:279-287
[23] 梁毅, 刘小义, 张洪伟, 谭武平. 洋葱花青素合成相关基因(AcPAL1)的克隆和表达分析. 农业生物技术学报, 2014, 22:47-54
Liang Y, Liu X Y, Zhang H W, Tan W P. Cloning and expression analysis of an anthocyanin bio-synthesis-related gene (AcPAL1)in onion (Allium cepa L.). J Agric Biotechnol, 2014, 22: 47-54 (in Chinese with English abstract)
[24] 亢键, 姜永华, 王豪杰, 杨艳青, 任小林. 苹果果实 HD-Zip I转录因子亚家族基因鉴定及表达分析. 西北农业学报, 2014,23: 160-165
Kang J, Jiang Y H, Wang H J, Yang Y Q, Ren X L. Identification and expression analysis of HD-ZIP Itranscription factor genes in apple fruit. Acta Bot Boreali-Occident Sin, 2014, 23: 160-165 (in Chinese with English abstract)
[25] Tao Z, Kou Y, Liu H, Li X, Xiao J, Wang S. OsWRKY45 alleles play different roles in abscisic acid signalling and salt stress tolerance but similar roles in drought and cold tolerance in rice. J Exp Bot, 2011, 62: 4863-4874
[26] Song Y, Wang L, Xiong L. Comprehensive expression profiling analysis of OsIAA gene family in developmental processes and in response to phytohormone and stress treatments. Planta, 2009,229: 577-591
[27] Luan M, Xu M, Lu Y, Zhang L, Fan Y, Wang L. Expression of zma-miR169 miRNAs and their target ZmNF-YA genes in response to abiotic stress in maize leaves. Gene, 2015, 555:178-185
[28] Hou X J, Li S B, Liu S R, Hu C G, Zhang J Z. Genome-wide classification and evolutionary and expression analyses of citrus MYB transcription factor families in sweet orange. PloS One,2014, 9: e95489
[29] Dai M, Hu Y, Ma Q, Zhao Y, Zhou D X. Functional analysis of rice HOMEOBOX4 (Oshox4) gene reveals a negative function in gibberellin responses. Plant Mol Biol, 2008, 66: 289-301
[30] 惠非琼, 彭兵, 楼兵干, 林福呈, 聂长春, 刘剑. 印度梨形孢通过促进渗透调节物质的合成和诱导抗逆相关基因的表达提高烟草耐盐性. 农业生物技术学报, 2014, 22: 168-176
Hui F Q, Peng B, Lou B G, Lin F C, Nie C C, Liu J. Piriformospora indica improves salt tolerance in Nicotiana tobacum by promoting the synthesis of osmolyte and inducing the expression of stress resistance genes. J Agric Biotechnol, 2014, 22: 168-176 (in Chinese with English abstract)
Cloning and Functional Identification of the ATHB12 Gene of HD-Zip IFamily in Potato (Solanum tuberosum L.)
WU Liang-Liang, YAO Lei, MA Rui, ZHU Xi, YANG Jiang-Wei, ZHANG Ning*, and SI Huai-Jun
Gansu Key Laboratory of Crop Genetic and Germplasm Enhancement, Gansu Provincial Key Laboratory of Aridland Crop Science / College of Life Science and Technology, Gansu Agricultural University, Lanzhou 730070, China
HD-Zip I is a class of plant-specific transcription factors, which has an important role in response to adversity stress in plant. A ATHB12 gene of HD-Zip I transcription factors was cloned from potato cultivar Gannongshu 2, which contains a 759 bp open reading frame (ORF) encoding a protein of 252 amino acid residues. ATHB12 gene is located on potato chromosome 1, and its promoter region sequence contains cis-acting elements including ABRE, LTRECOREATCOR15, WBOXATNPR1 responsive to abiotic stresses (ABA, temperature, dehydration, and salt stress). ATHB12 gene expressed in root, stem and leaf of potato, with the highest expression in the root. qRT-PCR analysis confirmed that the gene was induced by PEG, NaCl, and ABA, but repressed by cold treatment. The overexpressed-vector of ATHB12 gene driven by the constitutive promoter CaMV 35S was constructed,and the transgenic plants were obtained using Agrobacterium-mediated transformation system. The malondialdehyde (MDA)content in the transgenic plant leaves was significantly lower (P < 0.05), whereas the proline content was significantly higher (P<0.05) than those of non-transgenic control under drought stress. The fresh and dry weight of the transgenic plant root was higher than that of non-transgenic plants. These results showed that ATHB12 gene may be involved in response to stress.
Potato; HD-Zip; ATHB12 gene; Root; Malondialdehyde; Proline
10.3724/SP.J.1006.2016.01112
本研究由国家自然科学基金项目(31460370), 高等学校博士学科点专项科研基金项目(20126202110007), 国家国际科技合作专项(0102014DFG31570)和甘肃省干旱生境作物学省部共建国家重点实验室培育基地开放基金项目(GSCS-2012-02)资助。
This study was supported by the National Natural Science Foundation of China (31460370), Specialized Research Fund for the Doctoral Program of Higher Education of China (20126202110007), International Science & Technology Cooperation Program of China (0102014DFG31570), and Gansu Key Laboratory of Aridland Crop Science of Gansu Agricultural University (GSCS-2012-02).
*
(Corresponding author): 张宁, E-mail: ningzh@gsau.edu.cn, Tel: 0931-7631875
联系方式: E-mail: 1335973527@qq.com, Tel: 18709492533
Received(
): 2016-01-19; Accepted(接受日期): 2016-05-09; Published online(网络出版日期): 2016-06-02.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160602.0830.004.html
