心源性缺血性卒中患者的早期体外循环心脏手术的安全性分析
2016-08-26王文杰姚建民
王文杰,姚建民
· 论著 ·
心源性缺血性卒中患者的早期体外循环心脏手术的安全性分析
王文杰1,姚建民1
目的 探讨心源性缺血性卒中患者在早期行体外循环下心脏手术的安全性。方法 入组2000 年7月~2015年8月在北京军区总医院就诊的无昏迷心源性缺血性卒中患者26例,且1个月内因恶性心律失常、药物不可纠正的心力衰竭、难以控制的感染以及反复栓塞等早期手术指征接受体外循环下瓣膜置换术、室壁瘤切除术或黏液瘤切除术等,记录原发性心脏病种、手术方式、手术效果及随访结果。结果共入组26例受试者,其中男性19例(73.1%),年龄32~67(48.6±11.3)岁,风湿性心脏病14例、感染性心内膜炎7例、冠心病合并左心室壁瘤3例、左房粘液瘤2例。二尖瓣置换术14例,主动脉瓣置换术6例,二尖瓣和主动脉瓣双瓣置换术1例,冠状动脉搭桥术及左室室壁瘤切除术3例,左房粘液瘤切除术2例。手术治愈26例,无1例手术死亡,术后延迟苏醒3例,延迟拔管4例,二次开胸止血1例。随访3~60 (28.0±5.6)月,1例术后2个月因瓣膜置换术后抗凝不当死于脑出血,无再次发生脑卒中病例。结论对于发生恶性心律失常、药物不可纠正的心力衰竭、难以控制的感染以及反复栓塞的心源性缺血性卒中患者1个月内接受体外循环心脏手术是安全的。
缺血性卒中;心源性卒中;体外循环;安全性
缺血性卒中是心脏疾病的严重并发症,不仅复发率高,而且比非心源性引起的卒中有更高的致残率和死亡率。心脏手术不仅治疗心脏本身的问题,而且还可预防缺血性卒中的复发。然而,体外循环及全身肝素化可能加重神经系统的损伤,出现缺血性卒中-出血转化或发生脑水肿而导致卒中加重[1]。因此,对于早期心源性缺血性卒中患者在体外循环下心脏手术的可行性仍存在较大的争议,传统认为应在卒中3个月后进行手术,但对于左心附壁血栓、感染性心内膜炎、左室室壁瘤和心脏粘液瘤等引起的缺血性卒中患者,常由于反复栓塞、恶性心律失常及血流动力学不稳定等原因,须尽早手术,等待会增加死亡率和致残率[2]。因此,本研究回顾性分析2000年7月~2015年8月26例心源性缺血性卒中患者早期(1个月内)体外循环下心脏手术的临床资料,对其安全性进行探讨,并总结围术期处理,以提高该类患者的临床诊疗。
1 资料与方法
1.1 研究对象 本研究共入组2000年7月~2015年8月在北京军区总医院就诊的无昏迷心源性缺血性卒中患者26例,男性19例、女性7例,年龄32~67岁,平均年龄(48.6±11.3)岁。心功能分级(NYHA分级)Ⅰ级5例,Ⅱ级10例,Ⅲ级8例,Ⅳ级3例。入选标准:入院后明确诊断心源性缺血性卒中并接受体外循环心脏手术的患者。排除标准:最近一次卒中距心脏手术的时间超过1个月的患者或有昏迷症状者。
1.2手术方法 手术均采用胸部正中切口,升主动脉及右心房插管(房腔管或上、下腔插管,视手术方法而定),升主动脉阻断后,插左心引流管。在中度低温和中等流量体外循环下进行。早期(1个月内)手术指征包括反复心律失常、药物不可纠正的心力衰竭、反复栓塞及难以控制的感染。手术术式包括瓣膜置换术、室壁瘤切除术、黏液瘤切除术、冠状动脉搭桥术、血栓清除术及左心耳结扎术等。
1.3围手术期处理 入院后常规行头颅CT、心电图及超声心动图检查。请神经科会诊,协助诊疗,所有患者被确诊为缺血性卒中。术前处于卒中急性期者予以阿加曲班(10 mg/次,静滴)抗凝治疗,发热者予以药物降温和(或)物理降温,感染性心内膜炎者予以抗感染治疗,伴脑脓肿者术前予以脑脓肿清除术及脱水降颅压;术中予以甘露醇(20%甘露醇,250 ml/次,快速静滴30~60 min)来减轻脑水肿、甲基强的松龙(30 mg/kg,静滴)抗炎症反应及头孢唑肟钠预防感染。术后常规予以抗感染治疗,脑水肿者予以甘露醇。术后严密观察神志、瞳孔以及心功能状况,加强呼吸道护理。若出现精神、神经症状要尽早判断是否有脑出血或栓塞,或只是一过性的精神症状。
1.4随访方法 患者出院均建议密切门诊复查,无特殊情况术后3、6个月及1年,以后每隔1年门诊复查,未能来门诊复查者,电话随访。随访内容主要是神经系统并发症及死亡情况。
1.5统计学分析 采用IBM SPSS Statistics 21统计软件对本实验的数据进行分析,计量资料用平均数±标准差(±s)表示,组间比较采用t检验,计数资料用例数百分比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1研究对象基线资料 本研究入组26例无昏迷心源性缺血性卒中患者,年龄范围32~67岁,平均年龄(48.6±11.3)岁,最后一次脑卒中距手术的间隔时间1~30 d,平均间隔时间(16.1±7.6)d。二尖瓣置换术14例(同期行左房血栓清除术13例),主动脉瓣置换术6例,二尖瓣和主动脉瓣双瓣置换术1例,左室室壁瘤切除术3例(同期行冠状动脉搭桥术及左室附壁血栓清栓术),左房粘液瘤切除术2例。转流中灌注压保持在60~80 mmHg,鼻咽温保持在26~28℃,体外循环时间33~163 min,平均(116±47) min,主动脉阻断时间20~105 min,平均(68±34) min(表1)。
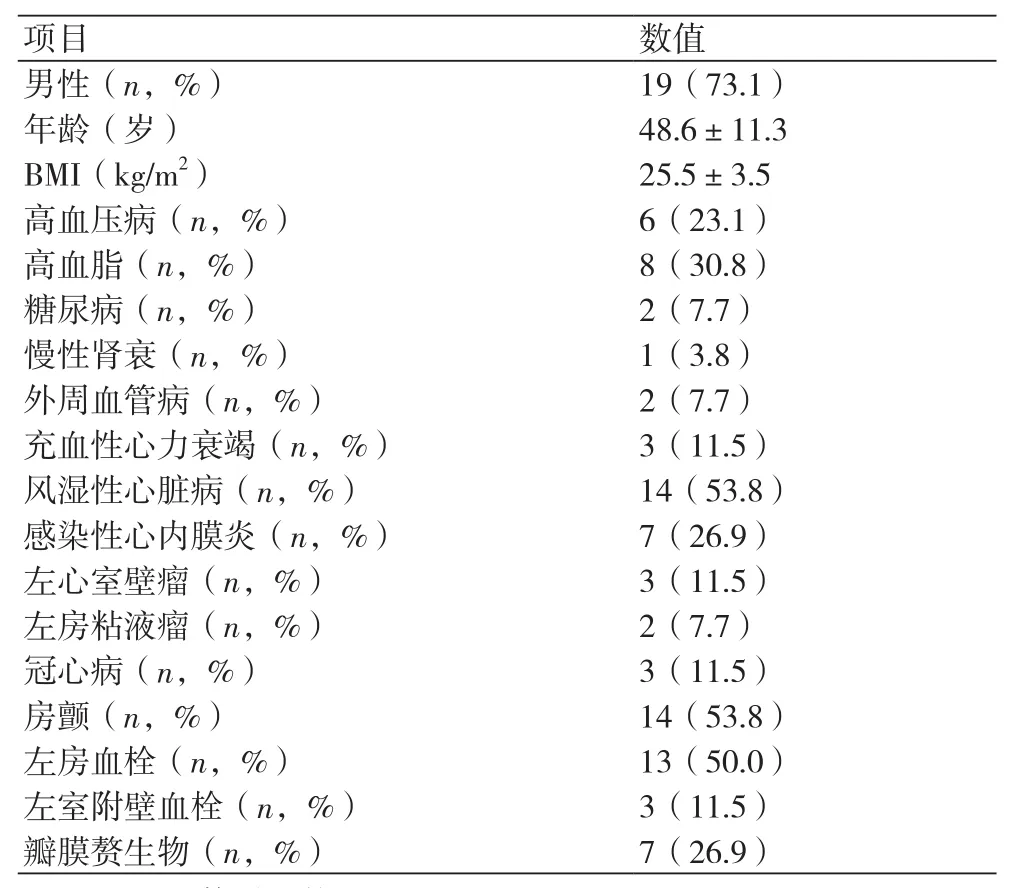
表1 研究对象基线资料
2.2术后及随访后不良事件发生情况 手术治愈26例,术后无一例原有神经系统症状加重或新发神经系统并发症,无围术期死亡,术后延迟苏醒3例,延迟拔管4例,二次开胸止血1例。随访时间3~60个月,平均随访时间(28.0±5.6)月,1例术后2个月因瓣膜置换术后抗凝不当死于脑出血,无再次发生脑卒中病例。
3 讨论
与非心源性卒中相比,心源性卒中更易于早期复发(复发率1%~10%)和长期复发(在第一年内复发率为2%~15%)[3]。但对于早期心源性缺血性卒中患者何时可以接受心脏手术,一直是心脏外科界悬而未决的问题,因为缺血性卒中患者早期在体外循环及肝素化下可能加重神经系统的损伤,其因素包括多方面的:①脑血管床进一步闭塞,致脑缺血及卒中;②由非出血性的卒中发展为出血性卒中;③加重脑水肿;④可能出现肺炎或肾功能衰竭等并发症;⑤在低心排出量综合征或全麻的状态下,由于正常脑组织的血管扩张,脑缺血部位的血流会减少(盗血现象)[1]。而且,术中对心脏的刺激本身即可造成栓子脱落进入体循环动脉,引起脑部血管栓塞,而引起新的神经系统损伤或加重原有神经系统损伤。因此,传统观念认为应在卒中3个月后再行体外循环下心脏手术,但对于左心附壁血栓、感染性心内膜炎、左心室室壁瘤和心脏粘液瘤等引起的缺血性脑卒中患者,常由于反复栓塞或血流动力学不稳定等原因,须尽早手术。
在卒中后,梗塞部位及周边组织的自身血流调节功能丧失4~5周,此时的组织灌注完全取决于血压,血压轻微降低即可造成梗塞灶的扩大或血压轻微升高则可造成高血压性脑病[1]。由此推断,应在自身血流调节功能恢复后再行心脏手术。然而,目前有一些证据显示心源性缺血性卒中患者在体外循环下早期心脏手术是可行的。1987年就有文献报道了15例心源性卒中患者在体外循环下早期开胸心脏手术,感染性心内膜炎14例和左房粘液瘤1例,其中3例为昏迷患者,12例为局灶性神经功能缺损患者,最后一次卒中距手术的间隔时间为2~28 d,术后除1例死于多脏器衰竭外,其余所有的患者神经症状改善并且有8例痊愈[1]。Fukuda报道了4例并发卒中的感染性心内膜炎患者,最后一次卒中距手术的间隔时间分别为0 d、1 d、24 d和1例不清楚,术后卒中症状都改善,无一例原有神经系统症状加重或新发神经系统并发症[4]。Naoto Morimoto也报道了17例感染性心内膜炎患者,其中15例并发缺血性卒中、1例并发出血性卒中和1例并发蛛网膜下腔出血,最后一次卒中距心脏手术的平均间隔时间2.9± 0.4 d,术后脑CT显示所有的患者无脑卒中恶化,也无脑出血转化[5]。新的2009年关于预防、诊断和治疗感染性心内膜炎的指南中推荐早期心脏手术的指征:心力衰竭、难以控制的感染和栓塞事件的预防,并且认为感染性心内膜炎合并缺血性卒中患者,有心力衰竭、难以控制的感染、脓肿或持续的高栓塞风险时,只要是没有昏迷表现和头颅CT排除脑出血,手术不应该被推迟[6]。García-Cabrera认为感染性心内膜炎患者并发卒中后,瓣膜置换术可能加剧脑损伤,但在小的缺血性脑卒中患者应立即手术和中、重度缺血性卒中患者2周后进行手术,术后出血的风险似乎是低的[7]。研究显示脑栓塞的心房粘液瘤患者在心房粘液瘤诊断后10 d内手术治疗,短期及长期生存率与因其他原因施行手术的心房粘液瘤患者相似[8],而且有几个报告强调左房粘液瘤合伴卒中患者一旦确诊应行急诊手术切除粘液瘤[9-11]。本组患者的最后一次脑卒中距手术的平均间隔时间(16.1±7.6) d,术后无一例原有神经系统症状加重或新发神经系统并发症。因此,我们认为心源性缺血性卒中患者在1个月内行体外循环下心脏手术是安全的,但对手术时机选择要慎重,不仅要根据心脏病变情况和血流动力学情况的状况,而且要考虑到再次卒中的危险。若有早期手术指征如反复心律失常、药物不可纠正的心力衰竭、反复栓塞及难以控制的感染时,不应推迟手术。
Morimoto研究发现急性脑卒中患者选择小剂量肝素和甲磺酸萘莫司他是体外循环心脏手术的一个安全策略[5]。但本实验体外循环时未使用甲磺酸萘莫司他。术中对心脏的刺激即可造成栓子脱落进,引起脑部血管栓塞,而引起新的神经系统损伤或加重原有神经系统损伤。而且在体外循环下心脏手术时,血液中存在大栓子及微栓子,而微栓子是加重脑损伤的重要原因,其主要来自体外循环管道排气不全以及外科医生的手术操作[12]。但本研究未监测体外循环中的微栓,我们体会:①手术操作要轻柔,锯胸骨时尽量减少震动,尽可能减少搬动心脏的次数和幅度,且应在阻断主动脉后再插左心引流管,以防血栓、赘生物或肿瘤碎块等脱落,同时使用动脉微栓滤器;②术中要彻底清除血栓、赘生物及肿瘤;③在清理左房血栓、赘生物或肿瘤时,应用小纱布堵住二尖瓣口,并用吸引器吸尽左心房血液,避免遗留碎块,清除后,应让麻醉师膨肺,并用大量生理盐水反复冲洗,尽量少用心内吸引;④在左心耳基底部用线结扎或在左房内心耳底部用线连续缝合,关闭左心耳,有巨大左心房者应行部分切除或左心房折叠成形术,以防术后栓塞的发生;⑤在主动脉开放前,用粗针头或灌注针头作主动脉根部排气并手按心脏和让麻醉师通过改变床的高低和膨肺来排尽心腔内气栓,以防出现脑部气体栓塞而加重卒中。本研究是回顾性研究,未设对照组,且病例数相对较少,不足以调整基线资料的差异,如围术期处理的混杂因素,和检测的偏差可能会影响我们的结果。最后,本研究的结果需要进一步的前瞻性大样本量随机对照研究来证实。
[1] Zisbrod Z,Rose DM,Jacobowitz IJ,et al. Results of open heart surgery in patients with recent cardiogenic embolic stroke and central nervous system dysfunction[J]. Circulation,1987,76(5Pt2):V109-12.
[2] 王文杰,姚建民. 心源性缺血性卒中早期体外循环心脏手术的进展[J]. 中国循证心血管医学杂志,2015,7(5):716-8.
[3] Nomura E,Ohshita T,Imamura E,et al. Early Administration of Non-Vitamin K Antagonist Oral Anticoagulants for Acute Ischemic Stroke Patients with Atrial Fibrillation in Comparison With Warfarin Mostly Combined With Heparin[J]. Circ J, 2015,79(4):862-6.
[4] Fukuda W,Daitoku K,Minakawa M,et al. Infective endocarditis with cerebrovascular complications: timing of surgical intervention[J]. Interactive CardioVascular and Thoracic Surgery,2012,14(1):26-30.
[5] Morimoto N,Henmi S,Yoshida M,et al. Cardiopulmonary bypass strategy with low-dose heparin and nafamostat mesilate in cardiac surgery:A safe option for patients with acute stroke[J]. J ThoracCardiovascSurg,2012,144(3):726-8.
[6] Habib G,Hoen B,Tornos P,et al. Guidelines on the prevention,diagnosis,and treatment of infective endocarditis (new version2009): the Task Force on the Prevention,Diagnosis,and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC).Endorsed by the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and the International Society of Chemotherapy (ISC) for Infection and Cancer[J]. European Heart Journal ,2009,30(19):2369-413.
[7] Garcia-cabrera E,Fernandez-hidalgo N,Almirante B,et al. Neurological Complications of Infective Endocarditis:RiskFactors,Outcome,and Impact of Cardiac Surgery:A Multicenter Observational Study[J]. Circulation,2013,127 (23):2272-84.
[8] Elbardissi A,Dearani J,Daly R,et al. Embolic Potential of Cardiac Tumors and Outcome after Resection: A Case-Control Study [J]. Stroke,2009,40 (1):156-62.
[9] Al-said Y,Al-rached H,Baeesa S,et al. Emergency excision of cardiac myxoma and endovascular coiling of intracranial aneurysm after cerebral infarction[J]. Case Reports in Neurological Medicine,2013,2013:839270.
[10] Baek SH,Park S,Lee NJ,et al. Effective mechanical thrombectomy in a patient with hyperacuteischemic stroke associated with cardiac myxoma[J]. J Stroke CerebrovascDis,2014,23(9):417-9.
[11] Tetsuka S,Ikeguchi K. Prevention of Cerebral Embolism Progression by Emergency Surgery of the Left Atrial Myxoma[J]. Case Rep Med,2015,2015:151802.
[12] Lou S,Ji B,Liu J,et al. Generation,detection and prevention of gaseous microemboli during cardiopulmonary bypass procedure[J]. Int J Artif Organs,2011,34(11):1039-51.
本文编辑:阮燕萍
Safety of early cardiac surgery under cardiopulmonary bypass in patients with cardiogenic ischemic stroke
WANG Wen-jie*, YAO Jian-min.*Clinical College of Anhui Medical University and General Hospital of Chinese PLA Beijing Military Area Command, Beijing 100700, China.
YAO Jian-min, E-mail: jimyao@vip.sina.com
Objective To investigate the safety of early cardiac surgery under cardiopulmonary bypass (CPB)in patients with cardiogenic ischemic stroke. Methods The patients with non-coma cardiogenic ischemic stroke (n=26) were chosen from Jul. 2000 to Aug. 2015, and given cardiac valve replacement, ventricular aneurysmectomy or resection of cardiac myxoma under CPB within 1 m due to some early surgical indications such as malignant arrhythmia, uncontrolled heart failure by drugs, uncontrolled infection and repeated embolism. The types of primary cardiac diseases, surgical modes, surgical effects and follow-up results were recorded. Results Of 26 cases, 19 (73.1%)were male and aged from 32 to 67 (48.6±11.3). There were 14 patients with rheumatic heart disease, 7 with infective endocarditis, 3 with coronary heart disease complicating left ventricular aneurysm and 2 with left atrial myxoma. There were 14 cases undergone mitral valve replacement, 6 undergone aortic valve replacement, 1 undergone mitral valve and aortic double valve replacement, 3 undergone coronary artery bypass grafting and left ventricular aneurysmectomy and 2 undergone resection of left atrial myxoma. There were 26 cases cured and no one died. There were 3 cases with delayed analepsia, 4 with delayed extubation and 1 with second chest opening for stanching. During the follow up period from 3 m to 60 m (28.0±5.6), 1 case died of cerebral hemorrhage due to improper anticoagulation 2 m after cardiac valve replacement, and there was no one with relapse of stroke. Conclusion Cardiac surgery under CPB within 1 m is safe for patients with cardiogenic ischemic stroke complicating malignant arrhythmia, uncontrolled heart failure by drugs, uncontrolled infection and repeated embolism.
Ischemic stroke; Cardiogenic stroke; Cardiopulmonary bypass; Safety
· 论著 ·
R743.3
A
1674-4055(2016)04-0483-03
1100700 北京,安徽医科大学北京军区总医院临床学院
姚建民,E-mail:jimyao@vip.sina.com
10.3969/j.issn.1674-4055.2016.04.30
