中华绒螯蟹和克氏原螯虾细菌性败血症病原学研究
2016-08-25姜光明钱彩源顾雪林魏宾徐乐宋学宏苏州市吴中区水产技术推广站江苏苏州58苏州大学基础医学与生物科学学院江苏苏州53
姜光明,钱彩源,顾雪林,魏宾,徐乐,宋学宏(.苏州市吴中区水产技术推广站,江苏 苏州 58;.苏州大学基础医学与生物科学学院,江苏 苏州 53)
中华绒螯蟹和克氏原螯虾细菌性败血症病原学研究
姜光明1,钱彩源1,顾雪林1,魏宾1,徐乐2,宋学宏2
(1.苏州市吴中区水产技术推广站,江苏苏州215128;2.苏州大学基础医学与生物科学学院,江苏苏州215123)
从一中华绒螯蟹和克氏原螯虾混养池的自然发生败血症的个体中分离到2株细菌,对其生物学性状、致病性及药物敏感性进行分析,旨在明确分离菌的种类、病原学意义及耐药特征。从发病蟹和虾的血液中分离细菌并获纯培养,通过对纯培养菌的形态特征、理化特性、16S rRNA基因序列测定及系统发育学分析,鉴定菌种。以不同浓度的分离菌悬液感染健康蟹和虾,测定其致病性;用琼脂扩散法和稀释法测定分离菌株对9种常用抗菌类药物的敏感性。分离出纯培养的2株菌分别鉴定为维氏气单胞菌(Aeromonas veronii)和弗氏柠檬酸杆菌(Citrobacter freundii);2株菌均具有较强致病性,对氟苯尼考、盐酸环丙沙星、乳酸诺氟沙星、盐酸诺氟沙星等4种抗生素敏感。
中华绒螯蟹;克氏原螯虾;细菌性败血症;维氏气单胞菌;弗氏柠檬酸杆菌;药物敏感性
doi:10.3969/j.issn.1004-2091.2016.04.010
中华绒螯蟹(Eriocheir sinensis)俗称河蟹,克氏原螯虾(Procambarus clarkii)俗称小龙虾,均属甲壳动物,为水产养殖的名贵品种,也是江苏省十大主推养殖品种。相比于产量在750 kg/667 m2以上的鱼类养殖而言,河蟹与小龙虾的养殖属于低密度养殖,而且近年来不少地方实行虾蟹混养的生态养殖模式,绝大多数池塘的承载量不高于150 kg/667 m2,但随着养殖年限的增加,养殖水源的污染日趋严重,导致虾蟹免疫力持续下降,而水体条件致病菌毒力上升、致病力增强,因而引发虾蟹细菌性传染病,养殖者常采用内服抗生素与外泼消毒剂,以及微生态制剂调节水质相结合的方法预防与治疗此类疾病,但防治效果越来越不稳定,给养殖生产带来严重的经济损失。
在苏州某养殖区域,养殖者采取中华绒螯蟹和克氏原螯虾混养模式,近年来养殖综合效益较好。但从2013年以来,作者在病害调查工作中发现,该地区从6月下旬开始,克氏原螯虾有部分死亡,至7月中旬中华绒螯蟹也出现死亡。该病发病率达30%以上,发病池的虾、蟹病死率达30%~50%,采用内服氟喹诺酮类抗生素及外泼氯制剂的方法治疗,其效果在2013年还较明显,但至2015年治愈率较低。鉴于这一现状,作者对该病的病原生物进行了分离调查,旨在明确该病的病原及其耐药情况,为该病的有效防治提供技术支撑。
1 材料与方法
1.1材料来源
病虾、蟹采集于苏州吴中区东山某养殖池塘,健康虾、蟹购于吴中区临湖某养殖场,中华绒螯蟹体质量23~25 g,克氏原螯虾体质量14~16 g。健康虾、蟹放在60 cm×40 cm×40 cm室内水族箱中驯养1周,水深保持20 cm左右。驯养期间投喂2%的商品饲料,每天换1/4的水、气泵增氧,水温保持(28± 1)℃。驯养结束后,取活动正常的虾、蟹进行试验。
1.2细菌分离及菌悬液的制备
取发病虾、蟹各5只,用酒精棉消毒发病虾蟹体表,无菌取血0.1 mL,涂布RS琼脂平板,37℃培养10~14 h,观察菌落形态。再用接种环挑取两株优势菌落的单个菌落(菌落数分别约占68%和32%),划线接种于麦康凯琼脂平板,37℃纯培养18~24 h,分别加终浓度为30%的甘油,-20℃保存用于进一步鉴定。分离的优势菌株编号分别为AH3和CF,将AH3和CF菌株分别接于新鲜营养琼脂斜面,经28℃恒温培养18~20 h,用0.70%的无菌生理盐水洗下菌苔,制成菌悬液浓度为5.0×108 CFU/mL备用。
1.3人工感染试验
取上述分离的2株代表菌,移接于普通营养肉汤管28℃培养18 h后,分别用0.70%的无菌生理盐水稀释成含量为5.0×107、5.0×106、5.0×105、5.0× 104、5.0×103CFU/mL的菌悬液,分别注入中华绒螯蟹和克氏原螯虾的第3步足基部关节软膜处,剂量为0.1mL/只,每个浓度组蟹和虾各10只,对照组分别于同一部位注射0.70%的无菌生理盐水。接种后隔离养殖于水族箱中,于25~28℃水温下饲养,不喂食,不换水,连续观察4 d。并对人工感染后发病的中华绒螯蟹和克氏原螯虾血液中再次分离病原并进行鉴定。
1.4分离菌株生理生化特征鉴定
依据《一般细菌常用鉴定方法》[1]、《常见细菌系统鉴定手册》[2]和《伯杰细菌鉴定手册》[3]等所述方法进行致病菌的生理生化特性试验,然后通过BBL Crystl微生物鉴定系统对试验结果进行扫描和统计分析。
1.5分离菌株16S rRNA基因序列分析
设计细菌16S rRNA的PCR扩增采用通用引物对(F:5'-AGAGTTTGATCATG GCTCAG-3',R: 5'-GGTACCTTGTTACGACTT-3'),以分离到的菌株为模板,进行16S rDNA的PCR扩增。PCR反应体系为25 μL:10×PCR Buffer 2.0 μL,2.5 mmol/L dNTP 0.5 μL,引物F、R(10 μmol/L)各0.5 μL,Taq DNA聚合酶(2.5 U/μL)0.5 μL,DNA模板0.5 μL,ddH2O补足25 μL。PCR扩增程序:94℃3 min,94 ℃40 s,65℃40 s,72℃1 min,共30个循环;72℃延伸8 min。PCR产物采用TIANGEN公司DNA快速纯化回收试剂盒进行回收纯化,纯化PCR产物用1.2%琼脂糖凝胶电泳检测。测序工作由苏州金唯智生物科技有限公司完成。所测序列通过GenBank的BLAST进行相似性比对分析,并通过MegAlign方法[4]构建系统发生树,进行同源性分析,最后确定细菌的种类。
1.6药敏试验
将经鉴定后的纯培养扩增培养,选择氟苯尼考、磺胺嘧啶、磺胺二甲嘧啶、盐酸环丙沙星、盐酸多西环、盐酸诺氟沙星、盐酸恩诺沙星、甲砜霉素、硫酸新霉素等生产上常用的9种抗生素(本实验室根据国标自制药敏试纸,药物均为标准品,由江苏省水生动物疫病预防控制中心赠送)作为试验药物,采用常规琼脂扩散法[5]进行敏感性测定,以抑菌圈直径大小作为敏感与耐药的判定指标。并以3倍稀释法进行最小抑菌试验浓度(MIC)试验。药物的敏感性评判标准参考NCCLS标准和CLSI标准(表1)。

表1 9种抗菌类药物的敏感性评判标准
2 结果与分析
2.1发病虾、蟹的症状
观察解剖发病的中华绒螯蟹和克氏原螯虾发现,无论是虾还是蟹行动迟缓、肢体无力,少食至不食,翻身困难,严重者无法翻身;解剖虾蟹可见鳃丝排列不整齐,肝胰脏颜色淡黄,肠道内无食,血液凝固缓慢或不凝固。池塘中先发现克氏原螯虾先发病,几天后出现死亡;随后中华绒螯蟹出现病症,同样几天后出现死亡。发病池水质指标正常。
2.2细菌的致病力
将纯化的优势菌AH3株和CF株感染健康的中华绒螯蟹和克氏原螯虾,结果显示这两株菌对蟹、虾均有很强的致病力。其中健康蟹的96 h最低致死量分别为2.1×104CFU/g和2.1×105CFU/g,健康虾的96 h最低致死量分别为3.3×104CFU/g和3.3×104CFU/g,对照的蟹和虾在96 h观察期内均正常存活(见表2和表3)。说明AH3株的毒性强于CF株。分别随机取3只感染死亡虾蟹的血液再次分离纯化,并进行形态及理化特性等复核性检验,表明分离菌检验结果与相应的感染菌一致。
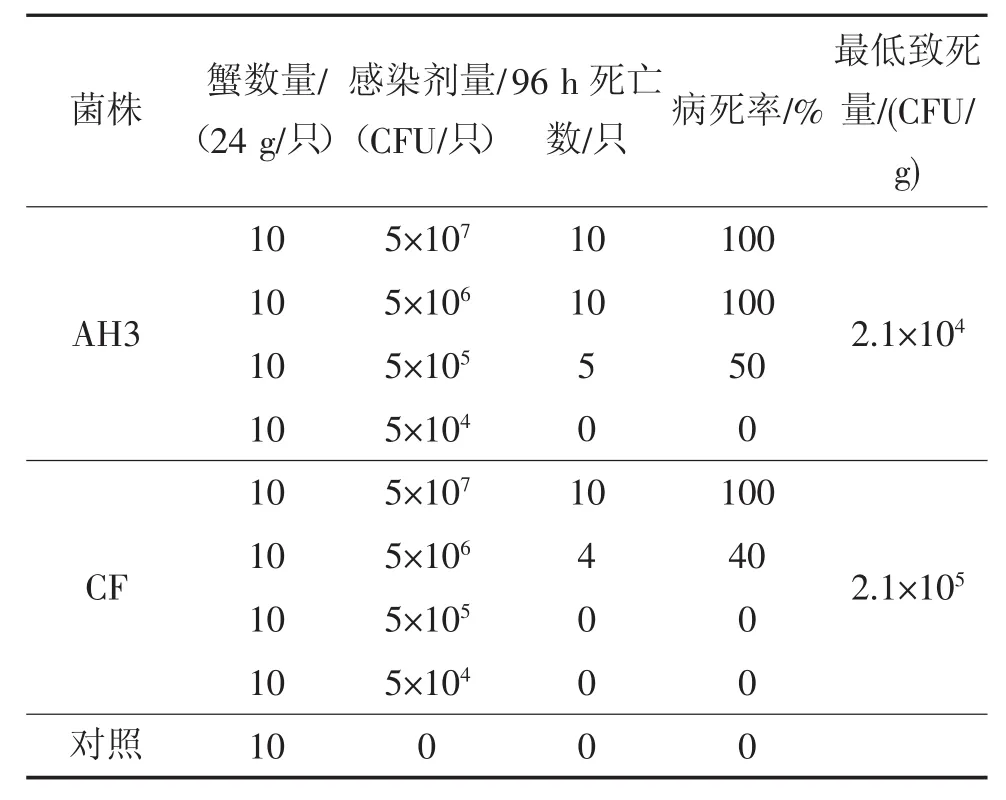
表2 AH3和CF对中华绒螯蟹的致病力
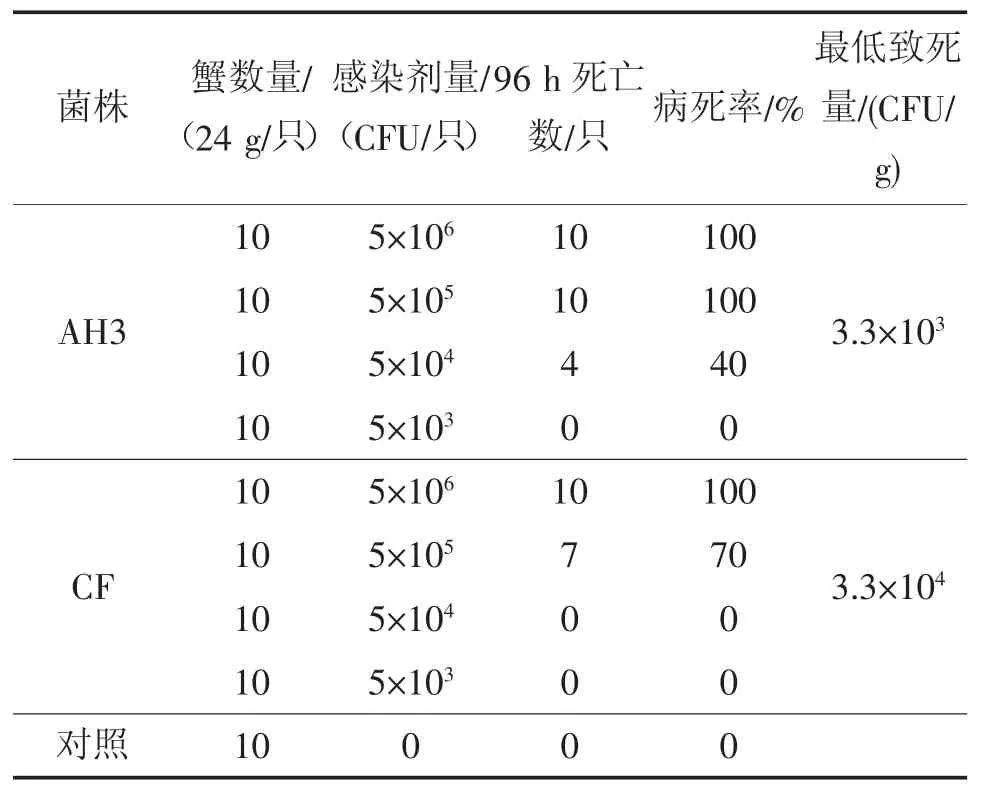
表3 AH3和CF对克氏原螯虾的致病力

表4 分离菌株AH3和CF的生理生化试验
2.3细菌鉴定
通过RS琼脂平板37℃恒温培育24 h,菌株AH3在营养琼脂平板上的菌落呈圆形光滑、边缘整齐、稍隆起、黄色,直径约2.0 mm,生长丰盛;菌株CF菌落呈圆形光滑、边缘整齐、稍隆起、绿色,菌落中心有黑点,直径约1.5 mm,生长丰盛。麦康凯琼脂平板上生长的AH3菌落呈黄色,CF菌落呈黄色,菌落中心呈玫瑰红。革兰染色结果显示,菌株AH3和CF均为革兰阴性,个体形态特征相似:短杆状或近球形、散在、个别的成双两端钝圆、无芽孢、大小(0.4~0.7)×(1~1.5)μm。分离菌株AH3和CF的系列生理生化试验结果见表4,基于BBL Crystl微生物鉴定系统对试验结果的扫描和统计分析,并对照《常见细菌系统鉴定手册》[2]和《伯杰细菌鉴定手册》[3],初步鉴定AH3和CF分别为维氏气单胞菌(Aeromonas veronii)和弗氏柠檬酸杆菌(Citrobacter freundii)。
通过16S rRNA的PCR扩增,所获AH3和CF 的PCR产物的1.2%琼脂糖凝胶电泳检测结果如图1,经测序分别获得片段长1 400 bp和1 376 bp的序列。GenBank的BLAST序列相似性比对分析结果显示,AH3菌株与维氏气单胞菌(Aeromonas veronii,登录号:KT964297.1)的亲缘关系最近,同一性为100%。CF菌株与弗氏柠檬酸杆菌(Citrobacter freundii),登录号:KR149315.1)的亲缘关系最近,同一性为99%。
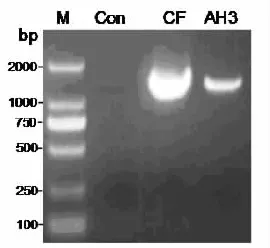
图1 AH3和CF的PCR扩增产物
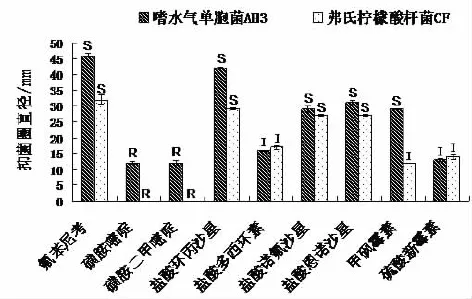
图2 嗜水气单胞菌与弗氏柠檬酸杆菌对9种抗生素的敏感性
2.4药敏试验
以NCCLS和CLSI药物敏感试验标准(表1),评判维氏气单胞菌AH3株和弗氏柠檬酸杆菌CF株对9种抗菌类药物的敏感性,试验结果见图2。结果显示,当细菌在贴有药物试纸的MH琼脂平板上28℃培养24 h后,维氏气单胞菌AH3对氟苯尼考、盐酸环丙沙星、盐酸诺氟沙星、盐酸恩诺沙星和甲砜霉素等5种药物敏感,对盐酸多西环和硫酸新霉素素等2种呈中度敏感,对磺胺嘧啶和磺胺二甲嘧啶等2种耐药。类似维氏气单胞菌AH3,弗氏柠檬酸杆菌CF对氟苯尼考、盐酸环丙沙星、盐酸诺氟沙星、盐酸恩诺沙星等4种药物敏感,但对甲砜霉素的敏感度低于维氏气单胞菌AH3,呈中度敏感;对盐酸多西环、硫酸新霉素素、磺胺嘧啶和磺胺二甲嘧啶等4种药物的敏感性同维氏气单胞菌AH3。同时,从最小抑菌浓度也可以发现(表5),弗氏柠檬酸杆菌CF株的最小抑菌浓度普遍高于维氏气单胞菌AH3株,说明其耐药性较高。然而我们从图2可以发现,维氏气单胞菌AH3株虽然对氟苯尼考、盐酸环丙沙星、盐酸诺氟沙星、盐酸恩诺沙星和甲砜霉素等5种药物敏感,但均出现二次生长的特性,最小抑菌试验结果同样表明,维氏气单胞菌AH3株细菌在1 mg/L的氟苯尼考、盐酸环丙沙星、盐酸恩诺沙星中前18 h培养液透明,无菌生长,但到24 h时,最小抑菌浓度均降到3~9 mg/L,表明这些药对维氏气单胞菌AH3株抑菌有效期较短,可能出现了耐药性状。

表5 9种抗生素对嗜水气单胞菌AH3和弗氏柠檬酸杆菌CF的最小抑菌浓度
3 讨论
3.1中华绒螯蟹和克氏原螯虾败血症的病原及其致病力
中华绒螯蟹和克氏原螯虾的细菌性疾病是养殖生产中常见的疾病。近年来,人们已从发病的中华绒螯蟹、克氏原螯虾体内分离到较常见的病原菌包括嗜水气单胞菌(Aeormonas hydrophila)、拟态弧菌(Vibro mimicus)[6-7]、副溶血弧菌(Vibrio parahaemolyticus)[8]、螺原体(Spiroplasma eriocheiris)[9]、易损气单胞菌(Aeromonas trota)[10]、豚鼠气单胞菌(Aeromonas caviae)[11]、弗氏柠檬酸杆菌[12-13]、维氏气单胞菌[14],因而引起水产科技工作者的高度关注。近三年来苏州吴中区某养殖区的中华绒螯蟹和克氏原螯虾败血症呈漫延趋势,该研究从吴中区某养殖区的中华绒螯蟹和克氏原螯虾败血症中分离到了2株致病菌,经鉴定为维氏气单胞菌和弗氏柠檬酸杆菌,该病属于混合感染。这2株菌的致病力较强,维氏气单胞菌AH3使中华绒螯蟹死亡的最低剂量为5×105CFU/g,低于郑世雄等[14]分离到的菌株使中华绒螯蟹死亡剂量107CFU/g,该菌对克氏原螯虾的死亡剂量更低,为5×104CFU/g。弗氏柠檬酸杆菌是克氏原螯虾的常见病原,近年来已有多次报道[13,15]。该研究得到的弗氏柠檬酸杆菌CF的致病力稍弱于维氏气单胞菌AH3,其致病力与沈锦玉等[13]从克氏原螯虾中分离到菌株的致病力一致,但高于陈红莲等[15]从克氏原螯虾中分离到菌株的致病力。因此,本次分离到的维氏气单胞菌AH3株和弗氏柠檬酸杆菌CF株均为强毒菌株;从中华绒螯蟹和克氏原螯虾败血症的流行特点也说明2株菌的混合感染引起了池塘虾蟹大量发病和死亡。根据症状与病原特点,作者认为该疾病为中华绒螯蟹和克氏原螯虾细菌性败血症。
3.2维氏气单胞菌和弗氏柠檬酸杆菌对抗生素的感受性
根据药敏实验结果对养殖者正确合理的施药具有很强的指导性。从药敏试验结果看,我们分离到的维氏气单胞菌AH3株和弗氏柠檬酸杆菌CF株对氟苯尼考、盐酸环丙沙星、盐酸诺氟沙星、盐酸恩诺沙星敏感,但其中的盐酸环丙沙星已被禁止在水产动物中应用,因此不能推广应用。2株菌对盐酸多西环和硫酸新霉素素呈中度敏感,对磺胺嘧啶和磺胺二甲嘧啶耐药;而对甲砜霉素的敏感性分析结果发现,弗氏柠檬酸杆菌CF株低于维氏气单胞菌AH3株。这种细菌对抗生素感受性的差异可能与细菌的种类和致病菌所接触抗生素类药物的频率有关[9]。该研究的药敏试验还发现,维氏气单胞菌AH3株虽然对上述抗生素敏感,但其有效期较短。当细菌在贴有药物试纸的MH琼脂平板上28℃培养24 h后出现了二次生长,说明维氏气单胞菌AH3株出现了抗性。养殖者也反映,中华绒螯蟹和克氏原螯虾败血症的治疗效果越来越差,这与近两年发病池塘常使用恩诺沙星、氟苯尼考等抗生素而产生抗性有关。因此,建议养殖生产者在生产实际中选择有效药物并采用多种药物交叉使用的方法,减缓病原菌对抗生素等药物耐药性产生的时间。
[1]中国科学院微生物研究所细菌分类组.一般细菌常用鉴定方法[M].北京:科学出版社,1978.
[2]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:107
[3]Krieg NR,Holt JG.Bergey's Manual of Systematic Bacteriology[M].vol 1.London:Williams and Wilkins Co,Baltimore,1984:458-461,516-548.
[4]Chen K,Durand D,Farach-Colton M.NOTUNG:a program for dating gene duplications and optimizing gene family trees[J].Journal of Computational Biology,2000,7(3-4): 429-447.
[5]叶应妩,王毓三.全国临床检验操作规程[M].2版.南京:东南大学出版社,1997:553-562.
[6]沈锦玉,尹文林,钱冬,等.中华绒螯蟹“腹水病”及“抖抖病”并发病病原的研究 [J].中国水产科学,2000,7(3): 89-92.
[7]陆宏达,金丽华,范丽萍,等.中华绒螯蟹细菌性病原的分离和鉴定[J].水产学报,1999,23(4):381-386.
[8]陈昌福,刘远高,何广文,等.克氏原螯虾暴发病细菌性病原的研究[J].华中农业大学学报,2009,28(2):193-197.
[9]Wang W,Gu W,Gasparich G E,et al.Spiroplasma eriocheiris sp.nov.,associated with mortality in the Chinese mitten crab,Eriocheir sinensis[J].International Journal of Systematic and Evolutionary Microbiology,2011,61(4):703-708.
[10]徐海圣,徐步进.中华绒螯蟹细菌性病原的分离和鉴定[J].中国兽医学报2002,22(2):137-139.
[11]徐海圣,黄立峰,王淑霞.中华绒螯蟹豚鼠气单胞菌的分离和鉴定 [J].浙江大学学报:农业与生命科学版,2001,27(6):677-681.
[12]李华,邢殿楼,白国福,等.弗氏柠檬酸杆菌对河蟹致病性的研究[J].水生生物学报,2001,25(3):217-223.
[13]沈锦玉,顾志敏,潘晓艺,等.红螯螯虾弗氏柠檬酸杆菌病病原的分离与鉴定 [J].中国水产科学,2005,12(2): 197-200.
[14]郑世雄,祖国掌.池塘养殖中华绒螯蟹细菌性疾病病原的分离与鉴定[J].水产养殖,2013,34(1):45-48.
[15]陈红莲,宋光同,何吉祥,等.克氏原螯虾弗氏柠檬酸杆菌的分离鉴定与药敏试验 [J].淡水渔业,2014,44(1): 73-77.
The etiological agents of bacterial septicemia in Eriocheir sinensis and Procambarus clarkia
Jiang Guangming1,Qian Caiyuan1,Gu Xuelin1,Wei Bin1,Xu le2,Song Xuehong2
(1.Suzhou Wuzhong Aquaculture Technology Extension Station,Suzhou 215128,China;2.School of Biology and Basic Medical Sciences,Soochow University,Suzhou 215123,China)
Two strains of bacteria were isolated from Chinese mitten crab(Eriocheir sinensis)and red swamp crayfish(Procambarus clarkii)with naturally occurring bacterial septicemia in a polyculture system.Both bacterial strains were tested for their biological traits,pathogenicity and drug sensitivity,to determine the bacterial entity,etiological significance,and drug resistance characteristics.The bacteria were isolated from blood samples of E.sinensis and P.clarkia,and sub-cultured repeatedly to obtain pure bacterial culture.The pure bacterial cultures were subsequently used to identify the bacterial species by their biological traits,physical and chemical properties,16S rRNA gene sequence,and phylogenetic characterization.The pathogenicity test was performed by infecting healthy crab and/or crayfish with serial dilutions of bacteria suspension from these two strains.The susceptibility of these bacteria to nine common antimicrobial agents was determined using agar diffusion technique and serial dilution method.The two bacterial strains isolated from pure cultures were identified as Aeromonas veronii and Citrobacter freundii,respectively,and both showed stronger pathogenicity,but were sensitive to four antibiotics,including florfenicol,ciprofloxacin,norfloxacin lactate,and norfloxacin hydrochloride.
Eriocheir sinensis;Procambarus clarkia;bacterial septicemia;Aeromonas veronii;Citrobacter freundii;drug susceptibility
中途分类号:S966.1A
1004-2091(2016)04-0046-06
江苏省三新工程项目(Y2014-36)、苏州市应用基础项目(SYN201505)
姜光明(1982-),男,工程师,研究方向:水产动物营养、疾病E-mail:jiang_guangming@aina.com
宋学宏,副教授,E-mail:songxh@suda.edu.cn
(2015-12-25)
