GSK-3β蛋白在胶质瘤中的表达水平及临床意义
2016-08-25张峰杨宏李庆堂殷英桃
张峰杨宏李庆堂殷英桃
GSK-3β蛋白在胶质瘤中的表达水平及临床意义
张峰①杨宏②李庆堂①殷英桃③
目的:检测正常脑组织和不同级别胶质瘤中GSK-3β的表达以及其意义。方法:收集41例胶质瘤和9例正常脑组织,利用免疫组织化学SP法检测GSK-3β在组织中的表达,分析其表达在不同级别胶质瘤中的差异,进而明确其在胶质瘤进展中的作用。结果:GSK-3β在正常脑组织中呈高表达,为棕黄色细颗粒状,主要表达定位于细胞质中,其在胶质瘤组织中呈低表达,两组比较差异有统计学意义(P<0.01)。进一步的分析发现,GSK-3β的表达水平随着肿瘤级别的升高而逐步下降,WHO分级中Ⅰ、Ⅱ、Ⅲ、Ⅳ级间比较差异有统计学意义(P<0.01)。但GSK-3β的表达水平与患者的性别和年龄无关(P>0.05)。结论:GSK-3β的表达随着胶质瘤恶性程度的增加而逐步下降,表明其在胶质瘤的发生发展中可能具有抑癌作用,GSK-3β有望成为治疗胶质瘤的一个新靶点。
胶质瘤; GSK-3β; 免疫组织化学; 脑
[20]叶燕,张鸣生,李新平.表皮干细胞定向分化形成毛囊的研究进展[J].临床医学工程,2015,22(7):958-960.
[21]刘光荣,陈清元,胡冠松,等.表皮干细胞表面标志物及向皮肤分化:理论特色与应用的可行性[J].中国组织工程研究,2014,18(28):4573-4577.
[22] Morasso M I,Tomic-Canic M.Epidermal stem cells: the cradle of epidermal determination,differentiation and wound healing[J]. Biol Cell,2005,97(3):173-183.
[23] Fu X B,Li J F,Sun X Q,et al.Epidermal stem cells are the source of sweat glands in human fetal skin:Evidence of synergetic development of stem cells,sweat glands,growth factors, and matrix metallopmteinascs[J].Wound Repair Regen,2005,13(5):102-108.
[24] Zhou J,Chen S,Liu W,et al.Enrichment and identification of human ‘fetal’ epidermal stem cells[J].Hum Reprod,2004,l9 (4):968-974.
[25]田亚宁,周智辉,梁漫,等.人表皮干细胞的分离培养[J].中国实用医药,2013,8(30):21-22.
First-author’s address:The Fourth Affiliated Hospital of Guangzhou Medical University,Guangzhou 511447,China
doi:10.3969/j.issn.1674-4985.2016.22.007
胶质瘤为颅内最常见的恶性肿瘤,亦称神经胶质瘤。其是起源于神经间质细胞,发生于神经外胚层的肿瘤[1-3]。关于胶质瘤的发病机制目前研究的还不甚透彻,并且此类肿瘤的浸润性生长非常明显,导致肿瘤细胞与正常脑组织的边界难以区分,通过手术难以切除干净,因此外科治疗效果不甚理想[3-4]。另外,通常的放化疗副作用大,且难以有效抑制肿瘤,从而复发率高。目前的临床数据表明,患者的5年生存率仅5%左右[5-6]。因此,了解胶质瘤的发病过程,对其发生发展的分子机制进行探讨,将可为临床治疗提供新的思路。GSK-3(Glycogen synthase kinase-3,糖原合酶激酶-3)是表达广泛的丝氨酸/苏氨酸激酶,由α、β两个异构体组成,且在进化上高度保守。目前对GSK-3β研究的最为广泛深入,而关于GSK-3α的功能还知之甚少[7]。GSK-3β在所有组织中都有表达,而在脑组织中的表达幅度尤为富集。GSK-3β首先被发现的功能是可以抑制糖原的合成,而随着研究的深入发现其作用相当广泛,可对多种底物包括转录因子、结构蛋白、代谢和信号转导相关蛋白等进行磷酸化,进而调控细胞的增殖、凋亡与迁移等,因而GSK-3β是一个重要的调节激酶[8]。现有研究发现GSK-3β在肿瘤的发生发展中具有重要作用,但有关GSK-3β和胶质瘤的研究目前较少[9]。因此,本研究对正常脑组织和不同级别胶质瘤中GSK-3β的表达进行检测,从而探讨其在胶质瘤发病过程中的意义。
1 材料与方法
1.1材料 胶质瘤石蜡标本共41份,均来源于2010年4月-2013年3月本院神经外科进行手术切除的患者。术前均未行放、化疗,且为第1次手术切除,并经病理证实,按WHO分级分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级。同时选择高血压脑出血或颅脑损伤患者行内减压手术时的脑组织标本9例作为对照组,石蜡标本由本院病理科负责切片提供,以4μm厚连续切片4张。
1.2HE染色 二甲苯脱蜡2次,10 min/次;浓度梯度酒精(100%-90%-80%-70%)作用2 min/次,蒸馏水洗2遍,1 min/次。加入苏木素染液染色10 min,水洗1 min。加入分化液(1%盐酸酒精)分化3 s,水洗。加入伊红液浸染2 min,水洗后浓度梯度酒精(80%-90%-100%)分别脱水2、4、5 min。移入二甲苯Ⅰ中透明3~5 min,移入二甲苯Ⅱ中透明5~10 min,树胶封固。
1.3免疫组化SP法 68 ℃烤片后,进行常规二甲苯脱蜡,梯度酒精脱水。加入3% H2O2于37 ℃孵育10 min,阻断灭活内源性过氧化物酶,然后用PBS冲洗5 min,重复3次。加入0.01M枸橼酸缓冲液(pH 6.0)进行抗原修复,重复上述步骤PBS冲洗。加入正常羊血清工作液封闭,然后滴加GSK-3β一抗(CST公司)于4 ℃冰箱孵育过夜,PBS冲洗3×5 min;滴加生物素标记二抗,37 ℃孵育30 min,PBS冲洗3×5 min;加入辣根过氧化物酶标记的链霉素卵白素工作液,37 ℃孵育30 min,PBS冲洗3次,5 min/次;DAB/H2O2反应进行染色,自来水冲洗充分后,苏木素复染,常规脱水,透明,干燥,封片。以PBS液代替一抗作阴性对照,用已知阳性的乳腺癌组织作为阳性对照。
1.4GSK-3β表达分析 200倍显微镜下观察,按随机原则选取10个视野进行细胞计数,呈棕黄色染色的细胞为GSK-3β表达阳性细胞,总的阳性细胞个数记为n1,再计算总的胶质细胞个数记为n2,n1/n2即为标记指数(Label index,LI),取其平均值。对每例标本的GSK-3β表达标记指数进行计算,分析其表达与临床病理的关系[10]。
1.5统计学处理 使用SPSS 17.0统计软件进行分析,组间标记指数的比较采用两组独立样本间的t检验,以P<0.05为差异有统计学意义。
2 结果
2.1胶质瘤HE染色观察 HE染色图中可见肿瘤细胞大小不一,细胞质呈粉红色,细胞核呈蓝色,且核异型性明显,核桨比例增大;随着WHO级别的升高,瘤细胞的密度逐渐增大,有的可见瘤巨细胞,见图1。
2.2GSK-3β在胶质瘤及正常脑组织中的表达差异 SP法免疫组化检测结果显示,GSK-3β主要表达于细胞质中,呈棕黄色致密细颗粒状(图2)。GSK-3β在正常脑组织中呈高表达,平均标记指数为58.43%,在胶质瘤组织中相对低表达,平均标记指数为20.84%,两者比较差异有统计学意义(t=6.928,P<0.01)。而在胶质瘤组织中,GSK-3β在Ⅰ级胶质瘤中仍然表达较高,Ⅱ级中中等表达,Ⅲ级中低表达,Ⅳ级中极低或无表达(图2)。

图1 胶质瘤HE染色结果(×200)
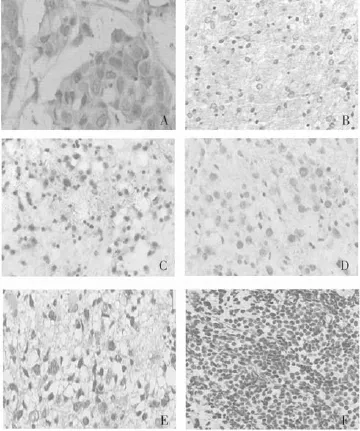
图2 免疫组化SP法检测GSK-3β的表达(×200)
2.3GSK-3β表达的临床意义 共检测41例胶质瘤标本,其中男21例,女20例,平均标记指数分别为22.0%和19.6%,两者比较差异无统计学意义(t=0.503,P=0.618)。按年龄段进行统计分析,年龄2~66岁,中位年龄32岁,分为≤20岁、20~40岁、40~60岁和≥60岁4个年龄段,病例数分别为13、12、15和1例,平均标记指数分别为28.4%、18.0%、17.0%和15.5%,各年龄组比较差异无统计学意义(P>0.05)。按肿瘤类型划分,其中星形细胞瘤11例,室管膜瘤9例,少支胶质细胞瘤9例,混合性胶质瘤7例,多形胶质母细胞瘤3例,髓母细胞瘤和胚胎发育不良性上皮瘤各1例,阳性细胞率分别为6.5%、15.0%、22.7%、39.9%、39.5%、0和42.9%,各组间比较差异有统计学意义(P<0.01)。按WHO分级划分,Ⅰ级8例,Ⅱ级11例,Ⅲ级14例,Ⅳ级8例,平均标记指数分别为40.6%、26.8%、16.4%、0.8%,各组间比较差异有统计学意义(P=0.008、0.006、0.000)
3 讨论
人们最初发现GSK-3β是一种磷酸化糖原合成酶,促使葡萄糖进行糖酵解代谢[11]。不过随着研究的深入,目前发现GSK-3β作用相当广泛,它能磷酸化多种底物,例如转录因子、代谢酶类等,进而调控细胞的生长、凋亡等。其在体内与多种生理病理活动相关,包括细胞增殖、细胞周期调控、凋亡、迁移、胚胎发育、血管生成和微管微丝的稳定等[12]。目前有关其在一些神经系统疾病,如老年痴呆症、中风和精神病,以及糖尿病和炎症中的治疗研究表明,其有可能是比较有效的靶点之一[13]。
鉴于GSK-3β在肿瘤发生发展中的重要意义,其被认为是一个重要的治疗靶点。不过目前关于其是具有抑癌作用还是促癌作用仍然没有定论[14-16],有关研究表明,GSK-3β具有肿瘤抑制作用。例如在皮肤癌和乳腺癌中,GSK-3β活化或表达上调能够抑制细胞的恶性转化和肿瘤发展,这是因为GSK-3β能通过Wnt/β-catenin信号通路而导致癌基因β-catenin磷酸化降解,并且在HIV-tat、血小板活化因子(Platelet activating factor,PAF)和PKC抑制剂staurosporine引起的细胞凋亡中发挥作用[17]。不过同时有研究发现,GSK-3β在结肠癌、胰腺癌等表达上调,并且具有促肿瘤生长作用。其机制是,GSK-3β能磷酸化NF-κB信号通路的成员,进而促进NF-κB介导的基因表达,最终对细胞增殖具有促进作用[18]。目前相互矛盾的观点表明,在不同的肿瘤微环境下,GSK-3β可能表现出不同的功能,在某些肿瘤中,GSK-3β具有抑肿瘤生长的作用;而在另一些肿瘤中,其具有促进肿瘤生长的功能。上述的研究结果提示,GSK-3β在人类肿瘤发生发展中的作用可能复杂多变,因此对于GSK-3β在不同肿瘤环境中的具体作用机制和信号通路调控的系统研究,将有助于肿瘤发生机制的正确认识,从而为恶性肿瘤的治疗提供新的靶点和理论依据[19-20]。对于GSK-3β在正常脑组织和胶质瘤组织中的表达差异,本研究进行了全面系统的检测分析。结果表明,GSK-3β在正常脑组织中呈高表达,而在胶质瘤组织中呈低表达,且GSK-3β的表达水平随着肿瘤级别的升高而逐步下降。由上述结果可推测,GSK-3β在胶质瘤中可能具有抑制癌细胞增殖转移的作用。Zhao等[21]研究表明,GSK-3β能通过mTOR/p70S6K1信号通路而抑制胶质瘤的发生发展,其非活化形式p-GSK-3β(Ser9)的表达在胶质瘤组织中表达上调。Gürsel等[22]从患者来源的胶质母细胞瘤中分离出具有干细胞特征的细胞进行研究也发现,下调GSK-3β第9位Serine的磷酸化水平后,细胞增殖能力下调,而凋亡增加;不过当GSK-3β表达增加时,细胞增殖和克隆形成能力下降,而细胞凋亡增强。因此,本研究的发现与目前的研究进展相一致。
综上所述,GSK-3β在胶质瘤中表达下调,其活性增加有可能会抑制胶质瘤细胞的生长迁移,因此GSK-3β有可能成为胶质瘤治疗的一个新靶点。
[1]高岚,步星耀,马春晓,等.脑胶质瘤组织中磷酸酯酶及张力蛋白同源物和Ki-67表达及相关性分析[J].中华实用诊断与治疗杂志,2016,30(3):260-261.
[2]时毅敏,魏川江,唐世洁,等.MARVELD1在脑胶质瘤中表达的实验研究[J].中国医学创新,2015,12(9):37-39.
[3]邓靖单,张岳农,廖亿粦.麻醉期间应用FloTrac/Vigileo监测液体治疗对胶质瘤开颅切除术患者预后的影响[J].中国医学创新,2015,12(13):65-67.
[4]仰浈臻,刘瑜洁,齐宪荣.脑胶质瘤治疗及其动物模型的研究进展[J].药学研究,2014,33(10):559-563.
[5]冯利明,罗林.胶质瘤的现代治疗进展[J].云南医药,2015,36(1):78-80.
[6]杨冬谊,步星耀,周志龙,等.高级别脑胶质瘤术后同步会师化放疗联合粒巨噬细胞集落刺激因子治疗效果观察[J].中华实用诊断与治疗杂志,2015,29(7):662-664.
[7] Doble B W,Woodgett J R.GSK-3:tricks of the trade for a multitasking kinase[J].J Cell Sci,2003,116(Pt 7):1175-1186.
[8] Grimes C A,Jope R S.The multifaceted roles of glycogen synthase kinase 3beta in cellular signaling[J].Prog Neurobiol,2001,65 (4):391-426.
[9]黄中华,梁庆模.GSK-3:肿瘤细胞命运的调节因子[J].中国现代医药杂志,2011,13(1):115-118.
[10] Ougolkov A V,Fernandez-Zapico M E,Savoy D N,et al.Glycogen synthase kinase-3beta participates in nuclear factor kappaB-mediated gene transcription and cell survival in pancreatic cancer cells[J].Cancer Res,2005,65(6):2076-2081.
[11] Ma C,Wang J,Gao Y,et al.The role of glycogen synthase kinase 3beta in the transformation of epidermal cells[J].Cancer Res,2007,67(16):7756-7764.
[12] Farago M,Dominguez I,Landesman-Bollag E,et al.Kinaseinactive glycogen synthase kinase 3beta promotes Wnt signaling and mammary tumorigenesis[J].Cancer Res,2005,65(13):5792-5801.
[13] Beurel E,Jope R S.The paradoxical pro- and anti-apoptotic actions of GSK3 in the intrinsic and extrinsic apoptosis signaling pathways[J].Prog Neurobiol,2006,79(4):173-189.
[14]陶丽,盛晓波,刘玉萍,等.GSK-3β活性调节与肿瘤治疗[J].中国药理学通报,2014,30(6):741-744.
[15]杨静,官成浓.GSK-3β对肿瘤细胞的双重调节[J].中国医疗前沿,2013,8(6):14-15.
[16] Leis H,Segrelles C,Ruiz S,et al.Expression,localization,and activity of glycogen synthase kinase 3beta during mouse skin tumorigenesis[J].Mol Carcinog,2002,35(4):180-185.
[17] Cohen P,Frame S.The renaissance of GSK3[J].Nat Rev Mol Cell Biol,2001,2(10):769-776.
[18] Ding Q,He X,Xia W,et al.Myeloid cell leukemia-1 inversely correlates with glycogen synthase kinase-3beta activity and associates with poor prognosis in human breast cancer[J].Cancer Res,2007,67(10):4564-4571.
[19] Park J H,Shin Y J,Riew T R,et al.The indolinone MAZ51 induces cell rounding and G2/M cell cycle arrest in glioma cells without the inhibition of VEGFR-3 phosphorylation: involvement of the RhoA and Akt/GSK3β signaling pathways[J].PLoS One,2014,9(9):e109 055.
[20] Zou Q,Hou Y,Shen F,et al.Polarized regulation of glycogen synthase kinase-3β is important for glioma cell invasion[J].PLoS One,2013,8(12):e81 814.
[21] Zhao P,Li Q,Shi Z,et al.GSK-3β regulates tumor growth and angiogenesis in human glioma cells[J].Oncotarget,2015,6 (31):31 901-31 915.
[22] Gürsel D B,Banu M A,Berry N,et al.Tight regulation between cell survival and programmed cell death in GBM stemlike cells by EGFR/GSK3b/PP2A signaling[J].J Neurooncol,2015,121(1):19-29.
Expression and Clinical Significance of GSK-3β in Glioma
ZHANG Feng,YANG Hong,LI Qing-tang,et al.//Medical Innovation of China,2016,13(22):028-031
Objective:To analysis the expression and significance of GSK-3β in normal brain and different grade glioma tissues.Method:41 gliomas and 9 normal brain tissues were collected, and immunohistochemistry SP method was used to detect GSK-3β expression. Then its expression in different grades of glioma was analyzed,and its role in the development of gliomas was investigated.Result:GSK-3β was highly expressed in normal brain tissue,which was mainly localized in the cytoplasm with brown granular,its expression was low in the glioma tissues, compared two groups,the difference was statistically significant(P<0.01). The expression level of GSK-3β gradually decreased while the WHO grade of glioma increasing,there were statistically significant differences in the comparison of WHO classification Ⅰ,Ⅱ,Ⅲ,Ⅳ(P<0.01).But its expression level was not related to the gender and age of the patients.Conclusion:With the increase of the malignant degree of gliomas,the expression of GSK-3β decreased gradually,which indicated that it may play a role in the occurrence and development of glioma, and GSK-3β is expected to be a new target for the treatment of glioma.36-42.
Glioma; GSK-3β; Immunohistochemistry; Brain
①广州医科大学附属第四医院 广东 广州 511447
②广州医科大学附属第二医院
③广东三九脑科医院
杨宏
(2016-01-22) (本文编辑:周亚杰)
(2016-05-23) (本文编辑:周亚杰)
