OH-浓度对地下水中铁碳酸盐沉淀形成的影响
2016-08-25罗凌云张文静张峻豪
陈 日,罗凌云,洪 梅*,张文静,张峻豪
OH-浓度对地下水中铁碳酸盐沉淀形成的影响
陈 日1,罗凌云1,洪 梅1*,张文静2,张峻豪1
(1.吉林大学,地下水资源与环境教育部重点实验室,吉林 长春130021;2中国环境规划院,北京 100012)
铁的碳酸盐沉淀是Fe0-PRB运行过程中最为常见的铁腐蚀产物,其对Fe0-PRB的长期运行有重要的影响.探究这类沉淀产物形成的环境条件,可为控制Fe表面碳酸盐沉淀的生成提供重要依据.本文以FeCl2、NaOH、Na2CO3为反应物,考察了缺氧条件下不同[OH-]=0.02, 0.06,0.1mol/L及=[Fe2+]/[OH-]、¢=[CO32-]/[OH-]对铁的碳酸盐沉淀生成情况的影响.结果表明,不同实验条件下检测到了FeCO3、Fe2(OH)2CO3及Fe6(OH)12CO3三种铁的碳酸盐沉淀.Fe6(OH)12CO3仅能在低浓度[OH-]=0.02mol/L时生成,高浓度的OH-条件下不能生成.Fe2(OH)2CO3在较低的OH-浓度,较小的条件下生成;较高的OH-浓度,较大的同样有利于Fe2(OH)2CO3的生成.FeCO3仅在[OH-]=0.02mol/L,[Fe2+]、[CO32-]均较低情况下与Fe2(OH)2CO3共同生成.
FeCO3;Fe2(OH)2CO3;Fe6(OH)12CO3;OH-浓度
零价铁PRB技术作为含水层污染物治理的方法显示了较好的经济效益且相对于传统的抽出处理有较明显的优势[1].大量的有机和无机有害废物都能被此种方法去除[2-3].地下水中化学组分造成的铁腐蚀是零价铁PRB长期运行的主要风险[4-6].HCO3-/CO32-是地下水中最普遍最丰富的无机阴离子,零价铁处理污染物过程中,铁的厌氧腐蚀会导致体系中pH值升高,使碳酸平衡体系发生变化,产生CO32-,生成碳酸盐沉淀附着在零价铁表面,影响Fe0-PRB的运行.
FeCO3,Fe2(OH)2CO3(碱式碳酸亚铁), Fe6(OH)12CO3(绿锈)是Fe0-PRB运行过程中最为常见的3类碳酸盐沉淀[7-11].不同的沉淀对零价铁处理污染物会产生不同的影响.Agrawal等[11]及Klausen[4]研究表明,铁表面生成FeCO3会钝化Fe,阻碍反应的进一步进行.Williams等[12]指出,绿锈因结构中有较大比例的Fe(Ⅱ),推测其具有还原污染物的能力.Fe2(OH)2CO3是PRB中常见的矿物沉淀,Jeen等[5]研究发现,沉淀的积累 (CaCO3及Fe2(OH)2CO3)导致了Fe活性的下降,Weber等[13]利用模型证明在缺氧条件下,PRB在长期运行过程中,由于沉淀(Fe2(OH)2CO3, FeCO3等)的积累致使铁的腐蚀速率减小.但Kohn等[8]和Jeen等[14]的研究推断,Fe2(OH)2CO3为氧化还原活性相物质,不会降低Fe0的活性,可以在污染物与零价铁之间传递电子.
相关研究表明:碳酸根浓度不同时,生成的沉淀种类也不同.在HCO3-浓度为0.5~1.0,0.1~0.2, 0.02~0.05mol/L时,相对应的沉淀产物分别为FeCO3、Fe2(OH)2CO3、Fe6(OH)12CO3[15], Reffass等[16]研究发现,在低浓度HCO3-(0.1mol/L)时沉淀产物为Fe6(OH)12CO3,而高浓度HCO3-(0.5mol/L)时为FeCO3; Refait等[17]实验指出,在浓度为0.1mol/L的HCO3-/CO32-溶液中,中性及弱碱性条件下会生成Fe6(OH)12CO3;Johnson等[18]利用模型及实验验证指出,Fe在0.02mmol/L的NaHCO3溶液中,pH= 10.91时会形成FeCO3及Fe(OH)2沉淀; Rémazeilles等[19]混合FeCl2、NaOH、Na2CO3溶液,结果表明, [OH-]=0.2mol/L时,离子浓度比例大于化学式中元素个数比时,即=[Fe2+/OH-]>1,¢=[CO32-/OH-]>0.5时,Fe2(OH)2CO3是唯一的沉淀产物,当Fe2+或CO32-不足时,会生成Fe2(OH)2CO3及Fe(OH)2的混合物,理论上=[Fe2+]/[OH-]>1,¢=[CO32-]/[OH-]>0.5时,溶液中有Fe2+及CO32-剩余但未能得到FeCO3沉淀,Azoulay等[20]通过实验验证了低pH值、低碱度条件下FeCO3容易生成.
以往对3种碳酸盐沉淀的研究,主要集中在以FeCl2、NaOH、Na2CO3为反应物,铁碳酸盐形成条件的研究,未考虑到OH-浓度变化对碳酸盐沉淀形成种类的影响.本文考查了OH-浓度及OH-、Fe2+、CO32-之间的浓度配比对铁碳酸盐沉淀产物的影响,并通过检测反应过程中体系的pH、h值、离子浓度的变化,判断不同类型沉淀形成的影响因素,以期通过控制环境条件达到控制Fe表面碳酸盐沉淀生成种类的目的.
1 材料与方法
1.1 材料
超纯水、NaOH、Na2CO3·10H2O、FeCl2·4H2O、浓盐酸、甲基橙、酚酞、FeNH4(SO4)2×12H2O、硫氰酸钾、过硫酸铵、N2等实验材料均为分析纯.
1.2 实验方法
通过调节[OH-]、[Fe2+]及[CO32-]与[OH-]的配比,考察不同[OH-]对铁碳酸盐生成的影响.以NaOH、Na2CO3、FeCl2为反应物,共设置3种OH-浓度,分别为0.02,0.06,0.1mol/L,设置=[Fe2+]/[OH-]为0.6、1.1;对应值设置不同浓度的CO32-,即¢=[CO32-]/[OH-]为1、1.5、2,离子浓度及配比情况见表1.将混合好的溶液密封静置7d.检测7d里溶液中pH、h及各种离子浓度变化情况.7d后将底部沉淀物取出放入离心管中以3000r/min离心5min,将沉淀物与水分离,然后在氮气保护的条件下,将离心管中的上清液倒掉,沉淀物保留,沉淀物上层加入乙醇隔绝空气,密封,准备进行XRD检测.
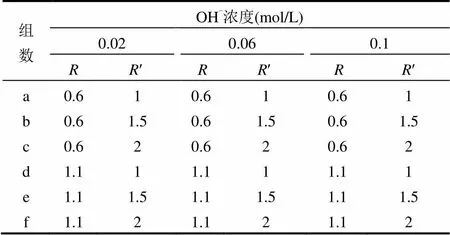
表1 实验条件下各组体系中离子浓度及配比 Table 1 The ion concentrations and ratios in the experiments
1.3 分析方法
pH值、h采用YSI100进行测定;HCO3-、CO32-采用酸标准溶液滴定法测定;Fe2+及Fe3+浓度通过硫氰酸盐比色法测定.
反应后的沉淀产物采用D/MAX2500PC型X射线粉末衍射仪分析,其主要参数:18KW旋转阳极,铜靶,石墨单色器;体系沉淀物的2角测试范围10~90°,扫描速度为10°/min.测角仪半径285mm、测角仪测角精度优于0.01°2,最大分辨率0.06°2.制备的样品中含有铁元素,背底较高,数据质量低且易氧化,无法进行定量分析,本实验中仅用XRD做定性分析.
2 结果与讨论
2.1 [OH-]=0.02mol/L时,体系中碳酸盐沉淀的生成条件
图1中,6个体系共检测到了FeCO3(29- 0696)、Fe2(OH)2CO3(33-0650)、Fe6(OH)12CO3(46-0098)3种产物. [OH-]=0.02mol/L时,体系中=[Fe2+]/[OH-]控制沉淀种类,=0.6时产物主要为Fe2(OH)2CO3,=1.1时为Fe6(OH)12CO3.=0.6时,沉淀产物除a外均为Fe2(OH)2CO3,a中有出峰较弱的FeCO3,随着¢=[CO32-]/[OH-]的增大,Fe2(OH)2CO3出峰位置增多,峰强增大,结晶效果变好,即在Fe2(OH)2CO3可生成条件下,增大CO32-浓度,有利于结晶效果较好的Fe2(OH)2CO3生成.=1.1时,d、e、f沉淀产物均为Fe6(OH)12CO3,说明在[OH-]=0.02mol/L时,Fe6(OH)12CO3的生成需要较高的Fe2+比例.
厌氧条件下提取的样品均呈现灰绿或者灰白色,XRD测定完成后,能够清晰看到在表面处形成了较多的黄色沉淀,与铁氧化物颜色相同,由于检测条件限制,无法避免检测过程中样品氧化,因此推断Fe3O4及Fe2O3并非体系中生成的沉淀物,而是样品检测时暴露于空气中的氧化产物.
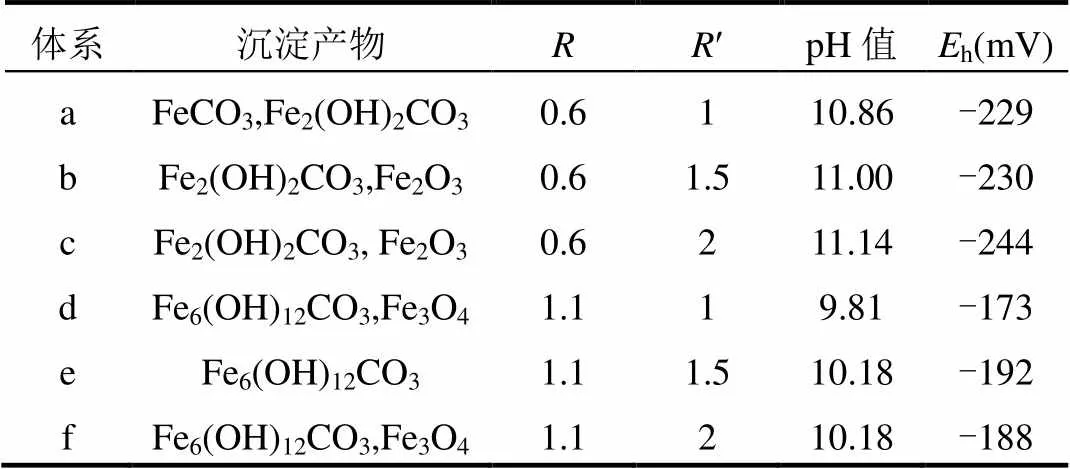
表2 [OH-]=0.02mol/L的各体系反应7d后检测结果 Table 2 The detection results in [OH-]=0.02mol/L systems after reaction 7 days
如表2所示,反应过程中各体系pH值、h变化不大,基本维持稳定,d、e、f体系中pH值低于,而h值高于a、b、c体系,说明Fe6(OH)12CO3的生成需要较Fe2(OH)2CO3生成有更低的pH值及更高的h值.生成FeCO3的体系pH值为10.86,低于其他生成Fe2(OH)2CO3的体系,在后续增加[OH-]的体系中,均未出现FeCO3, Azoulay等[20]研究表明,FeCO3的生成需要较Fe2(OH)2CO3生成有较低的pH值及OH-浓度.因此本条件下未能生成单一的FeCO3.
2.2 [OH-]=0.06mol/L时,体系中碳酸盐沉淀的生成条件
如图2所示, [OH-]=0.06mol/L 与[OH-]= 0.02mol/L体系差异较大,体系中碳酸盐沉淀只有Fe2(OH)2CO3(33-0650),即[OH-]=0.06mol/L有利于Fe2(OH)2CO3生成而抑制其他两种碳酸盐沉淀生成.由a与d,b与e,c与f的对比可以看出,[CO32-]/[OH-]不变,增加[Fe2+]/[OH-],即¢不变,增加体系中的Fe2+的浓度,体系中Fe2(OH)2CO3的出峰位置减少,非晶峰面积减小,结晶效果变好.样品中检测到氧化所致的Fe3O4及Fe2O3.d、e、f体系中的Fe2(OH)2CO3沉淀效果相近,即[OH-]=0.06mol/L,¢=1.1时, CO32-浓度对体系的Fe2(OH)2CO3沉淀效果影响不大.
=0.6,¢=2的体系中出现了Fe(OH)2,该体系有较多的OH-及CO32-剩余,pH值达到了11.19,为各体系的最高值,该体系的h值为-253mV,为各体系最低值,说明Fe(OH)2的生成,需要较Fe2(OH)2CO3生成有更高的pH值及更低的h值.=1.1体系较=0.6体系有相对较低的pH值(d、e、f低于a、b、c),是由于体系较高的Fe2+离子浓度消耗了溶液中更多的OH-及CO32-,降低了体系pH值.d中出现了Fe(HCO3)2沉淀,消耗了更多的CO32-及Fe2+离子,降低了体系pH值,增大了体系h值.
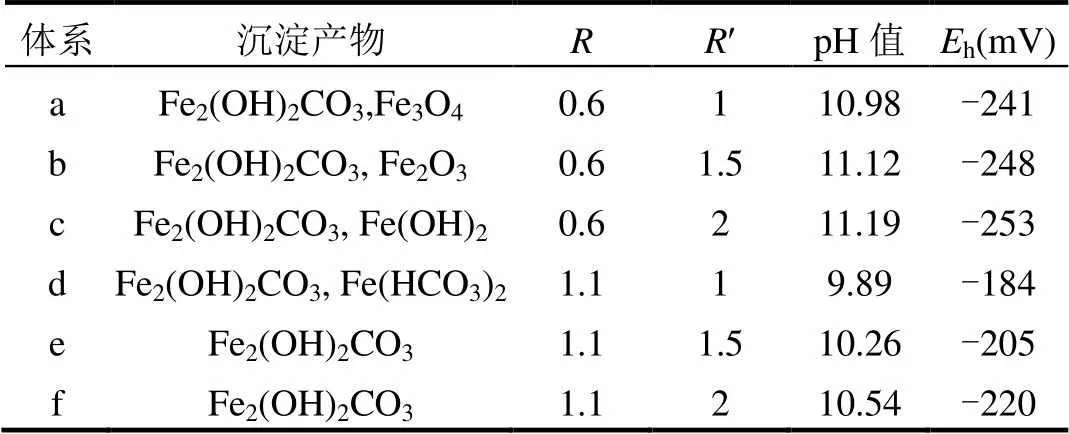
表3 [OH-]=0.06mol/L的各体系反应7d后检测结果 Table 3 The detection results in [OH-]=0.06mol/L systems after reaction 7 days
2.3 [OH-]=0.1mol/L时,体系中碳酸盐沉淀的生成条件
=0.6及=1.1的体系,增大¢,体系中pH值增加,h值下降(表4),但生成沉淀物种类不变.此浓度下的沉淀产物结晶效果受离子比例影响较小,相同产物的体系中沉淀结晶效果相近.
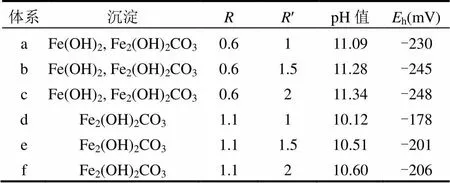
表4 [OH-]=0.1mol/L的各体系反应7d后检测结果 Table 4 The detection results in [OH-]=0.1mol/L systems after reaction 7 days
2.4 各OH-浓度下体系中CO32-、HCO3-、Fe2+浓度
在7d反应过程中对各体系中的CO32-、HCO3-、Fe2+、Fe3+离子浓度进行检测,各体系离子浓度变化较小且趋势相同,图4中,除d体系外,其余各体系中[OH-]= 0.06mol/L时,主要沉淀物为Fe2(OH)2CO3,CO32-相对剩余量较少,利用率高于[OH-]=0.02、0.1mol/L的体系,d中相对较高的CO32-浓度可能是由于溶液中有溶解度较高的Fe(HCO3)2所致.Fe6(OH)12CO3的生成较Fe2(OH)2CO3需要更多的Fe2+,体系中不足以形成Fe6(OH)12CO3沉淀的Fe2+更多,因此溶液中检测到的浓度较高.相同¢条件下,=1.1的体系中由于初始投加Fe2+浓度大于=0.6的体系,会消耗体系更多的CO32-,降低体系pH值,使碳酸平衡向HCO3-方向移动,体系出现HCO3-.
现有实验条件下,需要进一步探寻沉淀保存的更佳条件,避免沉淀检测过程中的氧化,来验证体系中铁氧化物的产生原因,以期实现对沉淀形成条件进一步作出定量分析.
3 结论
3.1 实验中检测到了FeCO3、Fe2(OH)2CO3Fe6(OH)12CO3及Fe(OH)2.
3.2 Fe6(OH)12CO3在低浓度[OH-]=0.02mol/L条件下生成,高浓度的[OH-]=0.06,0.1mol/L不能生成;Fe2(OH)2CO3在[OH-]=0.02,0.06,0.1mol/L时均可以生成,[OH-]=0.06mol/L的体系更利于Fe2(OH)2CO3的生成,在[OH-]=0.02mol/L,=0.6及[OH-]=0.1mol/L,=1.1时更利于Fe2(OH)2CO3的生成.其结晶效果受及¢的影响,[OH-]=0.02, 0.1mol/L时,增大¢, [OH-]=0.06mol/L时及¢增大,均有利于产物结晶效果增强;FeCO3在各离子浓度均较低时生成,即[OH-]=0.02mol/L,= 0.6,¢=1且检测到的为FeCO3、Fe2(OH)2CO3共沉淀, FeCO3出峰数量较少,强度较弱;Fe(OH)2沉淀需要较高的[OH-],浓度越高,出峰位置较多,结晶效果较好.
3.3 Fe6(OH)12CO3在低pH值条件下有更大的氧化还原电位区间,因此在[OH-]=0.01mol/L,=1.1条件下易生成Fe6(OH)12CO3;本实验仅在低[OH-]、低¢值,即[OH-]=0.02mol/L,¢=1体系中检测到FeCO3,Fe2(OH)2CO3在中性及弱碱性条件下,更易稳定存在,随着OH-浓度的增加,沉淀结晶效果更好, [OH-]=0.1mol/L体系中的Fe2(OH)2CO3结晶效果优于[OH-]=0.02, 0.06mol/L体系.
Higgins M R, Olson T M. Life-Cycle Case Study Comparison of Permeable Reactive Barrier versus Pump-and-Treat Remediation [J]. Environmental Science & Technology, 2009,43(24):9432-9438.
张 娜,陈 日,张海涛,等.模拟地下水中重碳酸盐浓度对零价铁还原硝基苯的影响 [J]. 中国环境科学, 2014,34(8):2010-2016.
邓红卫,贺 威,胡建华,等. Fe0-PRB修复地下水硝酸盐污染数值模拟 [J]. 中国环境科学, 2015,35(8):2375-2381.
Klausen J, Vikesland P J, Kohn T, et al. Longevity of Granular Iron in Groundwater Treatment Processes:Solution Composition Effects on Reduction of Organohalides and Nitroaromatic Compounds [J]. Environmental Science & Technology, 2003,37(6):1208-1218.
Jeen S W, Gillham R W, Blowes D W. Effects of carbonate precipitates on long-term performance of granular iron for reductive dechlorination of TCE. [J]. Environmental Science & Technology, 2006,40(20):6432-6437.
Kamolpornwijit W, Liang L, Moline G R, et al. Identification and Quantification of Mineral Precipitation in Fe0 Filings from a Column Study [J]. Environmental Science & Technology, 2004, 38(21):5757-5765.
Bonin P M L, Odziemkowski M S, Reardon E J, et al. In situ identification of carbonate-containing green rust on iron electrodes in solutions simulating groundwater [J]. Journal of Solution Chemistry, 2000,29(10):1061-1074.
Kohn T, Roberts A L. effect of silica on the degradation of Organohalides in Granular iron columns [J]. Journal of Contaminant Hydrology, 2006,83(1):70-88.
Roh Y, Lee S Y, Elless M P. Characterization of corrosion products in the permeable reactive barriers [J]. Environmental Geology, 2000,40(1/2):184-194.
Bi E, Bowen I, Devlin J F. Effect of Mixed Anions (HCO3−− SO42−− ClO4−) on Granular Iron (Fe0) Reactivity [J]. Environmental Science & Technology, 2009,43(15):5975-5981.
Agrawal A, Ferguson W J, Gardner B O, et al. Effects of carbonate species on the kinetics of dechlorination of 1, 1, 1-trichloroethane by zero-valent iron [J]. Environmental Science & Technology, 2002,36(20):4326-4333.
Williams A G B, Scherer M M. Kinetics of Cr (VI) reduction by carbonate green rust [J]. Environmental Science & Technology, 2001,35(17):3488-3494.
Weber A, Ruhl A S, Amos R T. Investigating dominant processes in ZVI permeable reactive barriers using reactive transport modeling [J]. J. Contam. Hydrol., 2013,151:68-82.
Jeen S W, Jambor L J, Blowes D W, et al. Precipitates on Granular Iron in Solutions Containing Calcium Carbonate with Trichloroethene and Hexavalent Chromium [J]. Environmental Science & Technology, 2007,41:1989-1994.
Nishimura T, Dong J. Corrosion behavior of carbon steel for overpack in groundwater containing bicarbonate ions [J]. Journal of Power and Energy Systems, 2009,3(1):23-30.
Reffass M, Sabot R, Savall C, et al. Localised corrosion of carbon steel in NaHCO3/NaCl electrolytes: role of Fe (II)-containing compounds [J]. Corrosion Science, 2006,48(3):709-726.
Refait P, Abdelmoula M, Génin J M R, et al. Green rusts in electrochemical and microbially influenced corrosion of steel [J]. Comptes Rendus Geosciences, 2006,338:476–487.
Johnson T L, Scherer M M, Tratnyek P G. Kinetics of halogenated organic compound degradation by iron metal [J]. Environmental Science & Technology, 1996,30(8):2634-2640.
Rémazeilles C, Refait P. Fe (II) hydroxycarbonate Fe2(OH)2CO3(chukanovite) as iron corrosion product: Synthesis and study by Fourier Transform Infrared Spectroscopy [J]. Polyhedron, 2009, 28(4):749-756.
Azoulay I, Rémazeilles C, Refait P. Determination of standard Gibbs free energy of formation of chukanovite and Pourbaix diagrams of iron in carbonated media [J]. Corrosion Science, 2012,58:229-236.
* 责任作者, 教授, hongmei@jlu.edu.cn
Investigation of the effect of OH-concentration on the formation of iron carbonate precipitation in groundwater
CHEN Ri1, LUO Ling-yun1, HONG Mei1*, ZHANG Wen-jing2, ZHANG Jun-hao1
(1.Key Lab of Groundwater Resources and Environment, Ministry of Education, Jilin University, Changchun 130021, China;2.Chinese Academy for Environmental Planning, Beijing 100012, China)., 2016,36(7):2051~2057
Iron Carbonate precipitation is the most common corrosion products during the process of Fe0-PRB operation, which have important influence on the long-term operation of Fe0-PRB. Exploring the precipitate formation condition can provide vital evidence to controll its formation on the Fe surface. Experiments were conducted in FeCl2, NaOH, and Na2CO3solutions to investigate the effect of different OH-concentration (0.02、0.06、0.1mol/L) and=[Fe2+]/[OH-]、¢=[CO32-]/[OH-] on the precipitate formation under anaerobic conditions. FeCO3、Fe2(OH)2CO3and Fe6(OH)12CO3were detected under the different experimental conditions, Fe6(OH)12CO3can formation in the low concentration [OH-]=0.02mol/L and not formation in the high OH-concentration solutions. The low OH-concentration and low, high OH-concentration and largehave positive effect on the formation of Fe2(OH)2CO3. FeCO3just be detected and precipitated with Fe2(OH)2CO3in the system with low concentrations of Fe2+、CO32-、OH-.
FeCO3;Fe2(OH)2CO3;Fe6(OH)12CO3;OH-concentration
X132.1
A
1000-6923(2016)07-2051-07
陈 日(1989-),女,内蒙古赤峰人,硕士研究生,研究方向为污染场地控制与修复.
2015-12-20
国家自然科学基金项目(41102146,41530636)
