我国药物警戒系统运行新进展
2016-08-24麻志萍辉瑞中国研究开发有限公司安全监测与风险管理部上海201203
麻志萍(辉瑞(中国)研究开发有限公司安全监测与风险管理部,上海201203)
我国药物警戒系统运行新进展
麻志萍
(辉瑞(中国)研究开发有限公司安全监测与风险管理部,上海201203)
我国的药物警戒体系是在药物不良反应监测体系基础上发展而来。近年来,随着国家对药物警戒工作的认识和重视度的不断提高,我国药物警戒工作取得了较快发展。本文就我国在药物警戒工作中的2个重要组成部分——个例安全性报告(Individual case safety report,ICSR)和定期安全性更新报告(periodic Safety Update Reports,PSUR)取得的新进展进行探讨。
药物警戒;个例不良反应报告;定期安全性更新报告
doi:10.16753/j.cnki.1008-2344.2016.04.025
[Abstract]In our country,pharmacovigilance evolved from the adverse drug reaction surveillance system,as increase awareness of which value,pharmacovigilance developed rapidly in recent years.Individual case safety report(ICSR)and periodic Safety Update Reports(PSUR)are key tasks of pharmacovigilance,this paper focused on discussing the new progress of these two parts.
[Key words]pharmacovigilance;ICSR;PSUR
个例安全性报告(Individual case safety report,ICSR)是药物警戒体系的重要组成部分,其数据的真实性、完整性和准确性是科学客观地评价药物安全性的基础,其来源及内容会极大影响后续的风险信号评估。定期安全性更新报告(periodic Safety Update Reports,PSUR)是制药企业定期向药品监管部门汇总某一药品上市后某一时间段内全球安全性信息的一种报告形式[16],用以平衡评估上市药品的效益或风险,是药物警戒工作的重要内容。本文就我国在药物警戒的2个重要组成部分ICSR和PSUR在工作中取得的新进展进行探讨。
1 药物警戒的历史
1965年第18届世界卫生大会通过关注药品不良反应监测的决议,并于1966、1967和1970年相继通过决议推动成立了国际药物监测合作计划(ProgrammeforInternationalDrugMonitoring,PIDM)[1]。随着药物不良反应监测活动的广泛开展,药物警戒的概念于1974年被法国人正式提出,欧盟将其逐步深化,并于2002年被世界卫生组织(WHO)正式将其定义扩展为:发现、评估、理解和防范与药物有关的不良作用或其他任何可能与药物相关安全性问题的科学活动[2]。虽然药品不良反应监测工作在我国开展较晚。1999年,国家食品药品监督管理总局与卫生部联合正式颁布《药品不良反应监测管理办法(试行)》,首次立法提出开展不良反应报告和监测工作[3]。2001年2月28日,全国第九届全国人民代表大会常务委员会第二十次会议修订通过《中华人民共和国药品管理法》,并于2001年12月1日起施行,其中第71条明确规定“国家实行药品不良反应报告制度”,从此我国正式依法开展了药品不良反应监测工作[4]。2004年,药物警戒概念在国内首次被提出[5]。2007年11月29日,我国第一届药物警戒研讨会在北京召开,会议决定在药物不良反应监测体系基础上建立药物警戒制度[6]。2011年7月1日,我国正式实施新版《药品不良反应报告和监测管理办法》(卫生部令第81号)(以下简称《管理办法》)[7]。在十几年间,我国通过不断加强立法有效地推动了药物警戒开展,截止至2011年,全国333个地市都成立了药品不良反应监测机构,药品不良反应监测信息网络系统也在2011年开始试运行,为深入开展药品不良反应监测工作奠定了基础[8]。截至2014年,我国药品不良反应监测网络用户已扩展至24万余个医疗机构、药品生产经营企业,2014年收到《药品不良反应/事件报告表》132.8万份,能开展数据评价分析和风险信号挖掘,并开始推进定期安全性更新报告的实行,具备了一定的风险管理水平[9]。
2 ICSR
2.1ICSR来源由于我国管理体制原因,ICSR来源与美国等国家有明显不同。美国在药品不良反应/事件搜集工作中并用的两大系统——企业强制报告系统(生产者、分销商、包装者)和MedWatch自愿上报系统(医疗卫生专家和消费者)起到了良好作用,据统计在2000年底至2001年底,FDA不良事件报告系统收到的报告绝大多数来自生产企业,可高达96.43%,另外美国消费者也有较高的安全意识,成为ICSR的主要来源之一,见图1[10-11]。相比之下,根据我家药品不良反应监测年度报告(2014年)显示:2014年全国收到《药品不良反应/事件报告表》132.8万份,其中医疗机构的报告占82.2%,药品经营企业的报告占16.0%,药品生产企业的报告占1.4%,个人及其他来源的报告占0.4%[9],虽然《管理办法》规定药品生产企业是药品安全第一责任人,但我国药品生产企业仍然没有充分发挥作用和优势,在ICSR搜集方面仍有广大资源没有发挥利用。
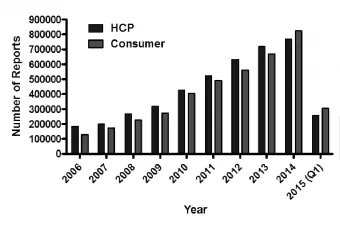
图12006 至2015年美国医疗专业人员和消费者Adverse Event Reporting System(FAERS)报告不良事件情况
2.2ICSR内容从ICSR内容看,我国《管理办法》将药品不良反应定义为合格药品在正常用法用量下出现的与用药目的无关的有害反应[7]。药品质量问题、药物滥用和用药差错等情形未被列入报告范围内。而美国的监测范围拓展为“患者用药期间发生与药品相关的任何不幸事件”,既包括正常用药情况下的不良反应,也包括超剂量用药、混用、误用、滥用、失效、缺陷、可疑、污染、包装破损等非正常情况下的用药问题[12]。相对而言,我国监测范围较窄,值得一提的是用药差错(medication errors)在近些年尤其被重视,用药差错是指医疗专业人员、患者或消费者在使用药物治疗过程中出现的任何能导致用药不当或危害患者健康的可预防事件。1999年,美国医学研究机构公布数据表明每年美国约有近44 000~98 000例住院患者死于用药差错事件,位居美国死亡率的第8位。每年大约发生150万的用药差错,每例住院患者平均每天就有1次用药差错[13]。可见用药差错发生频率之高,危害之大,但《管理办法》尚未包含此项监测,我国亦应提高对用药差错的危害性的认识,扩大监测范围以减少要害事件发生。
2.3ICSR规范我国新的药物不良反应监测系统于2012年1月1日正式上线[6]。我国最初的药品不良反应监测系统存在许多不足,如系统功能尚不完备;部分监测中心网络设备较匮乏,数据库设计不够合理,软件缺少优化,系统不够稳定;缺乏标准医学及药学字典、导致数据不规范;缺乏有效统计汇总平台[14-15]。人用药品注册技术要求国际协调会议(The International Conference on Harmonisation of Technical Requirements for the Registration of Pharmaceuticals for Human Use,ICH)E2B为ICSR电子的递交提供了标准,同时采用了WHO药物字典和国际医学用语词典(The drug dictionary for regulatory activities,MedDRA),统一规范了药物和医学用语编码,使ICSR在不同国家、组织之间被高效地交换、利用和管理成为可能[15]。鉴于ICH E2B早已为国际广泛采用,我国应积极引进ICH E2B规范及标准化字典库,争取与国际惯例接轨,以便更加充分地利用国内外交换的信息,为我国药物警戒工作服务。
3 PSUR
《管理办法》第三十六条首次规定:药品生产企业应当对本企业生产药品的不良反应报告和监测资料进行定期汇总分析,汇总国内外安全性信息,进行风险和效益评估,撰写定期安全性更新报告。国家也于2012在参考ICH E2C(R1)的基础上,依据当前认识发布了PSUR撰写规范,并不断开展培训和加强监督推进PSUR的实施;这一举措更加完善了我国药物警戒体系。虽然PSUR在我国刚刚兴起,但追述其历史,PSUR早已在1996年11月在ICH进程第4阶段被采纳,列入ICH指导原则E2C(R1)[17],在二十年发展过程中其内容已被ICH进一步深化和完善,2012年12月,ICH E2C(R2)正式将PSUR升级为药品定期获益风险评估报告(PeriodicBenefit-RiskEvaluation Report,PBRER),其优点在于更加强调对药品获益与风险的综合评价、对信号的评价、对累积数据的评价,并且欧盟已经正式率先开展PBRER。相比之下,我国采用的PSUR概念相对陈旧,工作开展较晚,目前普遍企业尚未充分认识PUSR的重要性,存在人员配备和培训不到位,递交的报告质量不高,风险信息评估不充分等问题。
由以上比较可见:我国虽然沿用了药物警戒这一概念,但是目前国内的法规及监测系统尚不能满足药物警戒的需求。我国若要真正有效地开展药物警戒工作,仍需政府进一步加强立法,拓展ICSR的内涵,在提高ICSR数量的同时更关注ICSR的质量和规范性,进一步优化数据库,加大对基础设施的投入,为后期的信号处理和数据挖掘打下良好基础;除了加强立法,还需细化规定,为药物警戒工作开展提供详细依据,加强对相关工作人员的培训,让药企在政府的扶持和监督下更好地发挥药品安全第一责任人的作用,并不断扩大宣传教育工作,提高公众对药物警戒的认识,让广大民众积极参与到药物警戒活动中。
4 小结
近年来,随着对药物警戒认识的不断提高,国家通过不断学习国际先进理念和经验,逐步完善立法,建立了符合我国国情的药物警戒体系,并不断推广和深化,使我国药物警戒工作取得了突飞猛进的发展,但与欧盟和美国等先进国家实施的药物警戒活动相比,我国的相关工作在各方面都仍有一定差距。与此同时,值得指出的是,我国已成为全球药品消费增速最快的地区之一。中国医药市场在国际地位的迅速提升为我国的药物警戒工作提出了更高要求和更严峻挑战,因此我们更加需要不断地学习和实践,由政府、企业、医疗机构和公众共同努力将我国药物警戒工作提高一个新台阶,为公众的用药安全提供有力保障。
[1]WHO.The 38th Annual Meeting of Representatives of the National Pharmacovigilance Centres participating in the WHO Programm for International Drug Monitoring,4-6 November,2015,New Delhi,India.http://www.who.int/medicines/areas/quality_safety/ safety_efficacy/india_annual_meeting/en/
[2]宋洋,杨悦.欧盟药物警戒体系建立运行与实施进展[J].中国药物警戒,2014,11(7):401-406.
[3]周延安,胡先明.我国与欧盟药品不良反应报告制度和监测制度比较分析[J].中国药师,2012,15(12):1784-1787.
[4]CFDA.《中华人民共和国药品管理法》(主席令第45号). http://www.sda.gov.cn/WS01/CL0064/23396.html
[5]刘花,冯变玲,杨世民.药品不良反应研究现状与展望[J].医药导报,2013,32(10):1384-1388.
[6]黄莉婷,陆世娟,陆朝甫.我国药物警戒体系建设的现状与发展趋势[J].药学与临床研究,2014,22(1):96-99.
[7]CFDA.《药品不良反应报告和监测管理办法》(卫生部令第81号).http://app1.sfda.gov.cn/WS01/CL0053/62621.html
[8]CFDA.2011年国家药品不良反应监测年度报告[R]. http://www.sda.gov.cn/WS01/CL0078/72193.html
[9]CFDA.国家药品不良反应监测年度报告(2014年)[R]. http://www.sfda.gov.cn/WS01/CL0078/124407.html
[10]董铎,刘翠丽.美国药品生产企业上市后监测制度研究及启示[J].中国药物警戒,2013,10(8):456-459.
[11]FDA.FAERS Reporting by Healthcare Providers and Consumers by Year[11/24/2015].http://www.fda.gov/Drugs/Guidance ComplianceRegulatoryInformation/Surveillance/Adverse Drug Effects/ucm070456.htm
[12]严瑾,邵蓉.中美药品不良反应/事件监测报告内容对比与启示[J].广东药学院学报,2014,30(1):71-75.
[13]蔡慎,杨悦.美国用药差错监测与干预及对我国的启示[J].实用药物与临床,2012,15(5):297-300.
[14]秦艳荣.药品不良反应监测系统的设计与实现[D].成都:电子科技大学,2013.
[15]叶小飞,郭晓晶,赵璐.个例安全性报告规范(ICH E2B)简介及应用[J].中国药物警戒,2012,9(3):149-151.
[16]袁兴东,高菁,周鹃,等.我国药品定期安全性更新报告的实施现状与展望[J].中国药物警戒,2014,11(6):333-335.
[17]魏树民,甄志芹,李科南.药品生产企业在《药品定期安全性更新报告》的作用[J].中国药物警戒,2014,11(9):547-549.
(文敏编辑)
Research Progress of Individual Case Safety Report and Periodic Safety Update Reports
MA Zhiping
(Pfizer(China)Research and Development Co.,Ltd.Safety Surveillance and Risk Management,Shanghai 201203,China)
R969.3
A
1008-2344(2016)04-0302-03
2016-02-11
