紫杉醇化疗联合参一胶囊对晚期非小细胞肺癌患者的疗效及安全性
2016-08-22牛朝霞李宁宁
牛朝霞 李宁宁 梁 芳
(1 河南医学高等专科学校病理生理学教研室,郑州,451191; 2 郑州大学附属郑州中心医院肿瘤科,郑州,450007)
紫杉醇化疗联合参一胶囊对晚期非小细胞肺癌患者的疗效及安全性
牛朝霞1李宁宁1梁芳2
(1 河南医学高等专科学校病理生理学教研室,郑州,451191; 2 郑州大学附属郑州中心医院肿瘤科,郑州,450007)
目的:探讨紫杉醇化疗联合参一胶囊对晚期非小细胞肺癌(Non-small-cell Carcinoma,NSCLC)患者的疗效及安全性,为NSCLC临床治疗提供可参考依据。方法:选择2010年1月至2013年3月100例我院初诊为晚期NSCLC的患者作为研究对象,根据患者意向性分为观察组与对照组,观察组给予紫杉醇联合参一胶囊治疗,对照组仅给予紫杉醇单独化疗治疗。比较观察2组患者的近远期临床疗效及不良反应的发生情况。同时采用酶联免疫吸附法检测血管内皮生长因子(VEGF)水平。结果:观察组总有效率67.9%明显高于对照组47.7%,2组比较差异有统计学意义(P<0.05)。观察组患者1年、2年生存率分别为42.9%、25.0%,均明显高于对照组22.7%、9.1%,且观察组平均生存时间亦长于对照组,差异有统计学意义(P<0.05)。治疗后2组VEGF水平均有明显降低,与治疗前相比差异有统计学意义(P<0.05),且观察组VEGF水平降低更明显(P<0.05)。结论:紫杉醇化疗联合参一胶囊可以明显增加化疗治疗NSCLC的疗效,延长NSCLC患者的生存时间,且对降低VEGF水平有积极作用,值得临床推广应用。
紫杉醇;参一胶囊;非小细胞肺癌;疗效
非小细胞肺癌(Non-small-cell Carcinoma,NSCLC)占全部肺癌的80%~85%,是最常见的肺癌类型,临床上由于NSCLC癌细胞生长分裂比较慢,恶性度比较低,常常不易被发现,当患者被确诊时,多数已发生扩散转移,20%~40%的患者错过手术最佳时机[1]。因此化疗治疗是NSCLC的主要治疗方案[2]。参一胶囊具有培元固本,补益气血的作用,可改善患者的气虚症状,提高机体免疫功能[3]。在此背景下,本研究即探讨紫杉醇化疗联合参一胶囊对晚期NSCLC患者的疗效及安全性,为NSCLC临床治疗提供可参考依据。
1 资料与方法
1.1一般资料选择2010年1月至2013年3月100例我院初诊为晚期NSCLC的患者作为研究对象,诊断符合中华医学会NSCLC诊断标准,其中男68例,女32例,年龄38~72岁,平均年龄(53.12±4.75)岁,平均病程(7.11±1.79)个月;中央型肺癌39例,占39.0%,周围型肺癌61例,占61.0%;体力状况(ECOG)评分:0分59例,占59.0%,1分41例,占41.0%。根据患者意向性分为观察组56例与对照组44例,2组一般资料比较差异无统计学意义(P>0.05)。纳入标准:有不同程度的咳血、胸部胀痛、低热等表现,胸部X线片或CT检查,并行病理学检查确诊。排除标准:化疗禁忌证,拒绝接受化疗治疗,结缔组织病,凝血异常等。所有患者均签署知情同意书,且经过伦理委员会批准。
1.2治疗方法记录相关信息,完善相关影像学及生化检查,观察组给予紫杉醇联合参一胶囊治疗,给予紫杉醇治疗前12 h口服地塞米松10 mg,治疗前30 min给予苯海拉明肌注20 mg,生理盐水500 mL+紫杉醇(北京协和药厂生产,国药准字H10980069)135 mg/m2治疗,21 d为1周期,共4周期;参一胶囊(吉林亚泰制药股份有限公司生产,国药准字Z20030044)20 mg/次,2次/d,与紫杉醇联用4周期后继续维持服用,8周为1个疗程,不间断2周继续下1个疗程治疗,至患者复发或出现严重药物不良反应。对照组仅给予紫杉醇单独化疗治疗,治疗方案同观察组,4周期后不给予参一胶囊治疗。
1.3疗效评价随访2年(维持治疗开始后计算),定期复查血细胞分析、肝功能、肾功能等生化指标。比较观察2组患者的近远期临床疗效及不良反应的发生情况。同时空腹抽取静脉血2 mL,采用酶联免疫吸附法检测血管内皮生长因子(VEGF)水平,试剂盒购自北京韦斯特公司,操作严格按照说明进行。
疗效评价采用WHO实体瘤评价标准进行[4]:1)完全缓解:肿瘤完全消失;2)部分缓解:肿瘤的最大直径X最大垂直直径的值缩小≥50%;3)病变稳定:肿瘤缩小≥25%,<50%;4)病变进展:肿瘤缩小<25%或出现新的病灶。以完全缓解+部分缓解+病变稳定计算总有效率。

2 结果
2.12组患者近期疗效比较分析维持治疗8周后比较2组患者近期疗效发现:观察组总有效率67.9%明显高于对照组47.7%,2组比较差异有统计学意义(P<0.05)。见表1。
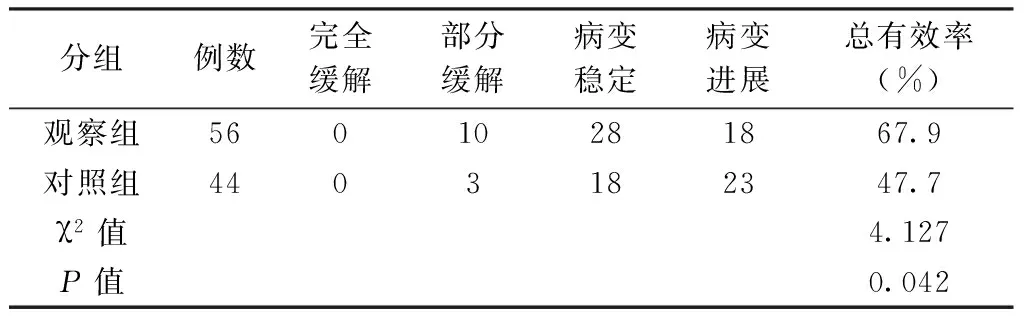
表1 2组患者近期疗效比较分析
2.22组患者不良反应发生情况比较2组患者不良反应比较结果显示:2组患者均无药物相关性死亡发生,且2组出现白细胞降低、贫血、恶心呕吐等不良反应的比较差异无统计学意义(P>0.05)。见表2。
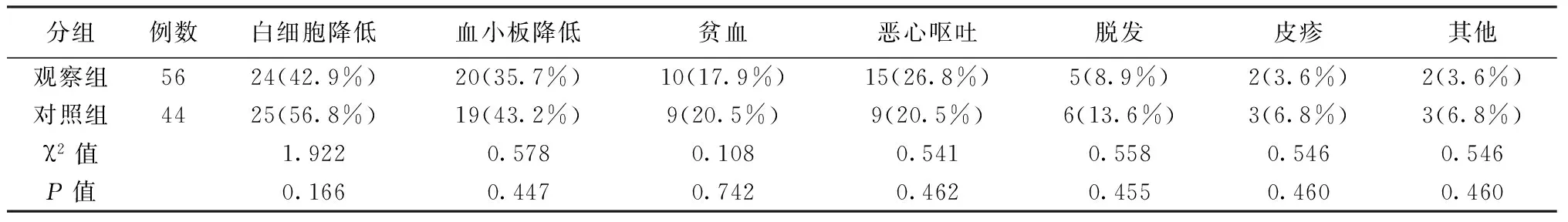
表2 2组患者不良反应发生情况比较
2.32组患者远期疗效差异分析随访2年比较2组患者远期疗效发现:观察组患者1年、2年生存率分别为42.9%、25.0%,均明显高于对照组22.7%、9.1%,且观察组平均生存时间亦长于对照组,差异有统计学意义(P<0.05);6月2组生存率为67.9%、63.6%,差异无统计学意义(P>0.05)。见表3。
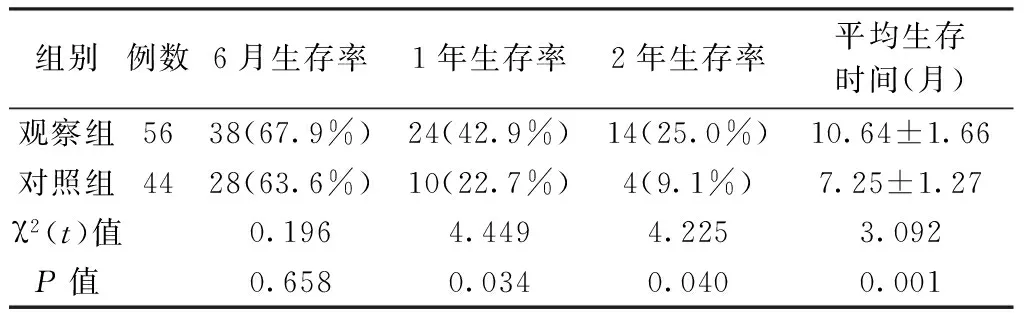
表3 2组患者远期疗效差异分析
2.4治疗前后2组患者VEGF水平比较治疗前后2组患者VEGF水平比较发现:治疗前2组患者VEGF水平比较差异无统计学意义(P>0.05);治疗后2组VEGF水平均有明显降低,与治疗前相比差异有统计学意义(P<0.05),且观察组VEGF水平降低更明显,差异有统计学意义(P<0.05)。见表4。
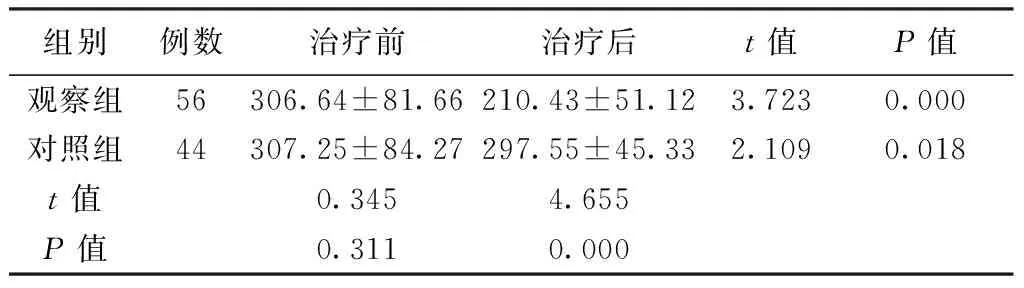
表4 治疗前后2组患者VEGF水平比较
3 讨论
目前吸烟、二手烟等多种因素的影响,同时医学技术水平的提高,NSCLC的发生率及诊断率日益增高。由于其发展慢,确诊时多数患者已发生转移,化疗治疗及中药辅助治疗成为其主要治疗方法。2009年《非小细胞肺癌临床实践指南》中建议对于体力状况较好NSCLC患者在一线化疗药物治疗4~6周的基础上,维持治疗可以使用抗血管生成药物治疗[4]。参一胶囊是我国批准上市的第1个血管生成抑制剂。
本研究比较维持治疗8周后2组患者近期疗效发现,观察组总有效率67.9%明显高于对照组47.7%。可见在常规紫杉醇化疗基础上联合参一胶囊可以明显提高患者近期治疗效果[5-7]。师彦敏等[8]研究亦发现,3个月时使用参一胶囊患者近期控制率71.4%明显高于未使用参一胶囊患者37.5%,差异有统计学意义(P<0.05)。支持本研究结果。分析认为参一胶囊由人参皂苷Rg3单一成分组成。亦有研究认为[9],参一胶囊通过抑制新生血管的生成,进而可以起到抑制肿瘤细胞增殖、浸润及转移作用。本研究比较2组不良反应未发现有统计学意义。可见联合使用参一胶囊不会增加NSCLC患者不良反应发生风险,有较好的安全性。
本研究进一步随访发现,观察组患者1年、2年生存率分别为42.9%、25.0%,均明显高于对照组22.7%、9.1%,且观察组平均生存时间亦长于对照组。王新强等[10]进行类似研究亦发现,参一胶囊组平均疾病无进展生存期为4.45个月(95%CI为3.86~5.03),优于对照组的2.47个月(95%CI为2.06~2.88)(P<0.01)。且参一胶囊组平均生存时间为10.2个月(95%CI为9.2~11.2),优于对照组的7.7个月(95%CI为6.9~8.5)(P<0.01)。可见参一胶囊可以明显提高化疗的疗效,延长患者的生存时间。研究认为[11],肿瘤新生血管形成可以破坏血管壁结构并发生浸润,而参一胶囊可以通过促进一氧化氮的生成阻止肿瘤细胞发生黏附,进而抑制粘连蛋白的增殖及肿瘤新生血管形成。此外有研究发现[6],参一胶囊中人参皂苷Rg3还可以基因水平抑制细胞生长因子及血管内皮生长因子表达,进而抑制肿瘤生长。因此对延长NSCLC患者生存时间有积极作用。
VEGF是一种重要的血管内皮细胞有丝分裂素,与及受体结合参与了肿瘤组织的血管生成及调控[12]。本研究比较2组患者VEGF水平发现,治疗后2组VEGF水平均有明显降低,且观察组VEGF水平降低更明显。可见参一胶囊明显降低了VEGF的生成。分析认为VEGF是惟一参与胚胎组织血管生成及调节血管生理功能的因子,主要参与新生血管的形成。其作用方式可以为两者结合后的自分泌方式,亦可以通过旁分泌方式作用于肿瘤组织中血管的内皮细胞,最终可以引起肿瘤组织新生血管的生成及促进其发生转移[13]。亦有研究发现[14],VEGF与其受体互结合后可使其受体本身发生磷酸化,进而促进血管内皮细胞增生,血管发生增生及扩张,与此同时其激活Ras轴,通过蛋白激酶信号转导发挥有丝分裂的作用,引起内皮细胞增生。
综上所述,本研究显示,紫杉醇化疗联合参一胶囊可以明显增加化疗治疗NSCLC的疗效,延长NSCLC患者的生存时间,且对降低VEGF水平有积极作用,值得临床推广应用。
[1]戴宏宇,夏春伟,陈文萍,等.培美曲塞或多西他赛治疗晚期非小细胞肺癌的临床观察[J].临床肺科杂志,2013,18(4):696-697.
[2]姜新,辛颖,罗景华,等.参一胶囊联合放疗对晚期非小细胞肺癌疗效的临床观察[J].中华放射医学与防护杂志,2012,32(2):196-198.
[3]Kim YH,Hirabayashi M,Togashi Y,et al.Phase II study of carboplatin and pemetrexed in advanced non-squamous,non-smallcell lung cancer:Kyoto Thoracic Oncology Research Group Trial 0902[J].Cancer Chemother Pharmacol,2012,70(2):271-276.
[4]李代蓉,李启英,王莉,等.紫杉醇联合奈达铂治疗老年非小细胞肺癌的临床观察[J].现代肿瘤医学,2012,20(10):2060-2062.
[5]张斌,肖寒,李蔚,等.益气养阴中药联合紫杉醇、顺铂治疗中晚期非小细胞肺癌23例临床研究[J].江苏中医药,2013,57(5):21-23.
[6]李蕊仙,王翠峰.紫杉醇化疗同步三维适行放疗对非小细胞肺癌患者血清VEGF和MMP-9的影响[J].现代中西医结合杂志,2014,22(18):1942-1944,1947.
[7]郑积华,林金容,谢波,等.培美曲塞与多西他赛二线随机分组治疗晚期非小细胞肺癌对比分析[J].中华肿瘤防治杂志,2013,20(5):368-370.
[8]师彦敏,孙金锋,王勇,等.参一胶囊维持治疗晚期非小细胞肺癌临床效果观察[J].临床合理用药杂志,2015,10(4):43-44.
[9]Hirai F,Seto T,Inamasu E,et al.Feasibility of cisplatin/pemetrexed with 15 mg/kg bevacizumab for the treatment of patients with advanced non-squamous non-small cell lung cancer[J].Oncol Lett,2015,9(6):2577-2582.
[10]王传岱,刘霞.沙参麦冬汤加减联合化疗治疗中晚期非小细胞肺癌疗效观察[J].现代中西医结合杂志,2015,24(12):1322-1324.
[11]Rice TW,Blackstane EH,Rusch VW.7th edition of the MCC Cancer Staging Manual;esophagus and esophagogastric junction[J].Ann Surg Oncol,2010,17(7):1721-1724.
[12]吴依芬,徐舒,贾筠,等.诱导化疗后参一胶囊维持治疗对晚期非小细胞肺癌患者的生存影响[J].广州中医药大学学报,2014,31(1):40-43.
[13]Khromova N,Kopnin P,Rybko V,et al.Downregulation of VEGF-C expression in lung and colon cancer cells decelerates tumor growth and inhibits metastasis via multiple mechanisms[J].Oncogene,2012,31(11):1389-1397.
[14]Trotsenko SD,Solodky VA,Sotnikov VM,et al.Results of surgical and combined treatment for non-small cell lung cancer with postoperative hypofractionated radiotherapy:overall and disease-specific survival[J].Vopr Onkol,2015,61(1):71-76.
(2015-11-17收稿责任编辑:徐颖)
Efficacy and Safety of Shenyi Capsule Combined with Paclitaxel in Treating Patients with Non-small Cell Lung Cancer
Niu Zhaoxia1,Li Ningning1,Liang Fang2
(1DepartmentofPathophysiology,HenanMedicalCollegeZhengzhou451191,China; 2DepartmentofOncology,ZhengzhouCentralHospitalAffiliatedtoZhengzhouUniversity,Zhengzhou450007,China)
Objective:To evaluate the efficacy and adverse reactions of Shenyi capsule combined with paclitaxel in the treatment of patients with non-small cell lung cancer (NSCLC).Methods:A hundred patients with NSCLC admitted in in the hospital from January 2010 to March 2013 were included.All patients were divided into observation group and control group according to the intention of patients.Patients in observation group were given Shenyi capsule combined with paclitaxel treatment,and patients in control group were given paclitaxle treatment sorely.The long term survival and adverse reactions were observed and compared between the two groups.At the same time,the level of vascular endothelial growth factor (VEGF) was detected and compared using enzyme-linked immunosorbent method.Results:The total effective rate in observation group was 67.9%,which was higher than that of 47.7% in control group.The difference is statistically significant (P<0.05).The 1 year,2 year survival rates in observation group were 42.9% and 25.0%,which were higher than 22.7% and 9.1% in the control group.The difference is statistically significant (P<0.05).The average survival time in observation group was longer than that of the control group,and the differences was statistically significant (P<0.05).The VEGF levels after treatment in two groups were lower than those before treatment and the difference is statistically significant (P<0.05).The VEGF levels in observation group after treatment were lower than that of the control group,and the difference is statistically significant (P<0.05).Conclusion:Shenyi capsule combined with paclitaxel can prolong the survival time,improve quality of life to patients with NSCLC.Also,it can low the levels of VEGF,which is worthy of clinical promotion.
Paclitaxel; Shenyi capsule; Non-small cell lung cancer; Curative effect
河南省教育厅科学技术研究重点项目(编号:14B310002)
牛朝霞(1979.10—),女,硕士,讲师,研究方向:主要从事恶性肿瘤发病机制的研究,E-mail:nzx99@163.com
R242;R273
A doi:10.3969/j.issn.1673-7202.2016.07.029
