ABT-737对顺铂耐药的乳腺癌细胞的杀伤作用及机制
2016-08-22吴力丰庄国华付水杭州市余杭区第一人民医院浙江杭州311100
吴力丰,庄国华,付水(杭州市余杭区第一人民医院,浙江 杭州311100)
ABT-737对顺铂耐药的乳腺癌细胞的杀伤作用及机制
吴力丰,庄国华,付水
(杭州市余杭区第一人民医院,浙江 杭州311100)
目的研究ABT-737是否能提高顺铂对耐药乳腺癌细胞株MDA-MB-231/R的杀伤活性并探讨其机制。 方法采用顺铂梯度处理法构建顺铂耐药乳腺癌细胞株MDA-MB-231/R;采用MTT法检测ABT-737是否能增强顺铂对MDA-MB-231/R的杀伤活性;Western blot试验检测常规MDA-MB-231细胞及MDA-MB-231/R细胞Bcl-2,Bcl-xl及Bcl-w的表达水平;采用流式细胞术检测ABT-737联合顺铂对MDA-MB-231/R细胞的凋亡诱导效应及对线粒体膜电位的影响。结果顺铂对MDA-MB-231/R细胞的杀伤活性显著低于MDA-MB-231。联合ABT-737治疗后,顺铂对MDA-MB-231/R细胞的杀伤活性显著提高,与MDA-MB-231细胞相比,MDA-MB-231/R细胞的Bcl-2抗凋亡蛋白家族成员Bcl-w表达水平显著上调,但Bcl-2和Bcl-xl表达水平不受影响。ABT-737显著增强顺铂对MDA-MB-231/R细胞线粒体膜电位的损伤,促进细胞色素C的释放,进而诱导MDA-MB-231/R细胞发生凋亡。结论ABT-737通过抑制Bcl-w的功能促进顺铂对耐药乳腺癌细胞的凋亡诱导效应。
ABT-737;MDA-MB-231/R;Bcl-w;线粒体凋亡
乳腺癌是女性发病率最高的恶性肿瘤[1]。顺铂是治疗多种实体瘤的一线药物,它能损伤肿瘤细胞的DNA进而诱导细胞进入凋亡程序[2]。然而,顺铂的反复应用常常诱导乳腺癌细胞产生耐药性,限制顺铂的临床应用[3]。ABT-737是一种合成药物,能与Bcl-2抗凋亡蛋白家族成员 (如Bcl-2、Bcl-w、Bcl-xl)的BH3位点特异性结合,使这些抗凋亡蛋白失去对促凋亡蛋白(如Bim、Bax、Bak)的抑制作用[4-5]。因此,ABT-737被报道有较好的抗肿瘤效应,如它能通过靶向ERK1/2信号通路上调Bim的表达从而诱导口腔癌细胞发生凋亡[6],又如ABT-737还能通过线粒体途径增强姜黄素的抗黑色素瘤作用[7]。Bcl-w是细胞中重要的抗凋亡蛋白,因此下调Bcl-w蛋白的表达是肿瘤治疗的一个重要策略[8]。本研究的目的在于探讨Bcl-2抑制剂ABT-737是否能逆转耐药乳腺癌细胞株MDA-MB-231/R对顺铂的耐药性并研究其具体机制。
1 材料与方法
1.1MDA-MB-231/R细胞的构建本研究从2013年5月~2015年5月完成于本院实验室。人乳腺癌细胞系MDA-MB-231购于美国模式菌种收集中心ATCC,肿瘤细胞培养在RPMI-1640培养基中,含10%胎牛血清,培养环境为37℃恒温且通入5%的CO2。顺铂耐药MDA-MB-231(MDA-MB-231/R)细胞的构建采用顺铂梯度暴露法[9],步骤如下:将MDA-MB-231细胞用一个浓度的顺铂处理48小时,之后将其移至无顺铂培养基培养48小时,重复3次后将细胞移至更高浓度顺铂进行培养。顺铂的初始培养浓度为1μmol/L,以后顺铂浓度每轮增加0.5μmol/L,直至将MDA-MB-231/R细胞最终培养在含3μmol/L顺铂的培养基中。
1.2实验试剂RPIM-1640培养基 (#11875-085)购于美国Gibco公司,胎牛血清(HB0205)购于杭州四季青生物工程有限公司。顺铂(479306),地高辛(1200000),JC-1(T4069),噻唑蓝(M2128),AnnexinⅤ凋亡试剂盒 (APOAF)购自美国sigma公司。ABT-737(S1002)购于德国Selleckchem公司,βactin(#4967)、Bcl-2(#2872)、Bcl-xl(#2764)、Bcl-w (#2724)、细胞色素C抗体(#4280)购自美国Cell signal公司。ECL试剂盒(NCI4106)购于美国Pierce。Lipofectamine 2000(11668030)购于美国Invitrogen。
1.3方法
1.3.1质粒构建及转染将Bcl-w基因cDNA全长序列(Gene ID:NM_001199839)以分子克隆的方法与pcDNA3.1连接后构建成pcDNA3.1-Bcl-w重组真核表达质粒[10]。使用Lipofectamine 2000按照试剂操作说明书步骤将2μg/ml Bcl-w表达质粒转染入MDA-MB-231/R细胞中,培养24小时。
1.3.2MTT试验将MDA-MB-231或MDA-MB-231/R细胞按5×103/孔接种在96孔板上。将2μg/ ml Bcl-w表达质粒转染到细胞中,孵育24小时,然后再加2μmol/L ABT-737及不同浓度的顺铂培养48小时。之后加5mg/mL MTT 20μL,继续培养4小时。弃上清,在570nm波长下用酶标仪检测OD值,细胞活力抑制率用以下公式计算:抑制率=(OD对照组-OD治疗组)/OD对照组×100%。
1.3.3Western blot试验 将2μg/mL Bcl-w表达质粒转染到MDA-MB-231/R细胞中,孵育24小时,然后再加2μmol/L ABT-737及10μmol/L顺铂培养48小时。之后将MDA-MB-231或MDA-MB-231/R细胞用生理盐水洗涤2次,之后将细胞裂解,将蛋白裂解液用12.5%SDS PAGE进行分离,之后通过电转方法将蛋白质转到PVDF膜上。将膜放入β-actin、Bcl-2、Bcl-xl、Bcl-w、细胞色素C一抗稀释液中孵育过夜,之后再用二抗稀释液孵育两小时后在X胶片上进行曝光,之后用Image J图像处理软件进行处理,使蛋白表达灰度值用数字表示,目标蛋白相对表达量=目的蛋白灰度值/相应β-actin内参蛋白灰度值。
1.3.4线粒体膜电位测定将2μg/mL Bcl-w表达质粒转染到MDA-MB-231/R细胞中,孵育24小时,然后再加2μmol/L ABT-737及10μmol/L顺铂培养48小时。之后将细胞用生理盐水洗涤2次,加入5μmol/L JC-1孵育20分钟,用流式细胞术检测细胞的线粒体膜电位。线粒体膜电位丧失的细胞不发射JC-1的红色荧光,因此MDA-MB-231/R细胞的线粒体膜电位下降率用未发出红色荧光的细胞占所有细胞的百分比表示[11]。
1.3.5细胞色素C释放率测定将2μg/mL Bcl-w表达质粒转染到MDA-MB-231/R细胞中,孵育24小时,然后再加2μmol/L ABT-737及10μmol/L顺铂培养48小时,之后将MDA-MB-231/R细胞重悬在地高辛裂解液中(75μg/mL地高辛溶解在250mmol/L蔗糖水溶液中)孵育15分钟,之后在15000g中离心30分钟,所得的细胞沉淀中含完整的线粒体,而上清液中不含线粒体[12]。用Western blot方法分别检测细胞沉淀及上清液中细胞色素C的表达水平,细胞色素C释放率用上清液中细胞色素C的蛋白灰度与细胞沉淀中细胞色素C的蛋白灰度的比值表示。
1.3.6细胞凋亡试验将2μg/mL Bcl-w表达质粒转染到MDA-MB-231/R细胞中,孵育24小时,然后再加2μmol/L ABT-737及10μmol/L顺铂培养48小时。将细胞用生理盐水洗涤2次,按照凋亡试剂盒说明书步骤将Annexin-V加入细胞中孵育20分钟,采用流式细胞术检测肿瘤细胞的凋亡,细胞凋亡率用Annexin-V阳性细胞占所有细胞比值表示。
2 结果
表1 顺铂对MDA-MB-231及MDA-MB-231/R细胞的活力抑制作用(±s)

表1 顺铂对MDA-MB-231及MDA-MB-231/R细胞的活力抑制作用(±s)
与对照组比较*P<0.05,与相同浓度顺铂处理的MDAMB-231细胞组比较△P<0.05
组别 n/孔 活力抑制率(%)MDA-MB-231细胞 MDA-MB-231/R细胞对照组3 0 0 1μmol/L顺铂组 3 17.5±1.3*△ 1.8±0.9 2μmol/L顺铂组 3 22.7±2.0*△ 3.2±1.1 4μmol/L顺铂组 3 45.9±3.1*△ 6.2±1.3*8μmol/L顺铂组 3 60.9±4.6*△ 11.3±1.4*16μmol/L顺铂组 3 69.6±5.0*△ 18.9±1.1*32μmol/L顺铂组 3 82.1±6.1*△ 38.5±2.8*64μmol/L顺铂组 3 90.5±7.8*△ 53.6±4.1*
2.1ABT-737逆转MDA-MB-231/R的顺铂耐药相比于MDA-MB-231细胞,MDA-MB-231/R细胞对顺铂显著耐药,详见表1。尽管低剂量的ABT-737(2μmol/L)单独治疗对MDA-MB-231/R细胞仅有微弱的杀伤作用,但显著增强顺铂对MDA-MB-231/R细胞的杀伤活性,详见表2。
表2 ABT-737增强顺铂对MDA-MB-231/R细胞的活力抑制作用(±s)
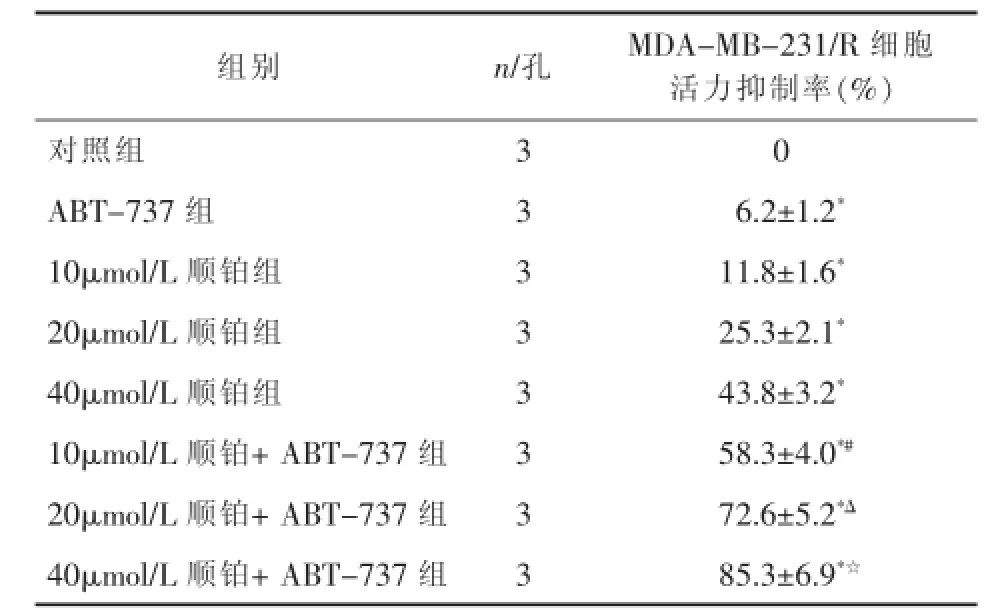
表2 ABT-737增强顺铂对MDA-MB-231/R细胞的活力抑制作用(±s)
注:ABT-737浓度为2μmol/L与对照组比较*P<0.05;与10μmol/L顺铂组比较#P<0.05;与20μmol/L顺铂组比较ΔP<0.05;与40μmol/L顺铂组比较☆P<0.05。
组别 n/孔 MDA-MB-231/R细胞活力抑制率(%)对照组 3 0 ABT-737组 3 6.2±1.2*10μmol/L顺铂组 3 11.8±1.6*20μmol/L顺铂组 3 25.3±2.1*40μmol/L顺铂组 3 43.8±3.2*10μmol/L顺铂+ABT-737组 3 58.3±4.0*#20μmol/L顺铂+ABT-737组 3 72.6±5.2*Δ40μmol/L顺铂+ABT-737组 3 85.3±6.9*☆
2.2ABT-737通过Bcl-w途径逆转MDA-MB-231/R的顺铂耐药与MDA-MB-231相比,MDAMB-231/R细胞的Bcl-2及Bcl-xl的表达水平变化不明显,但Bcl-w的表达水平显著提高,详见表3。当用Bcl-w表达质粒转染MDA-MB-231/R细胞,使细胞强制表达Bcl-w后,ABT-737对顺铂治疗的协同作用丧失,详见表4。
表3MDA-MB-231与MDA-MB-231/R细胞Bcl-2抗凋亡蛋白家族成员表达情况(±s)
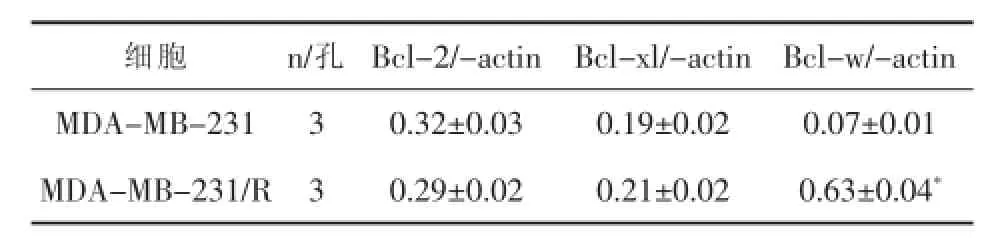
表3MDA-MB-231与MDA-MB-231/R细胞Bcl-2抗凋亡蛋白家族成员表达情况(±s)
与MDA-MB-231比较*P<0.05
细胞 n/孔 Bcl-2/-actin Bcl-xl/-actin Bcl-w/-actin MDA-MB-231 3 0.32±0.03 0.19±0.02 0.07±0.01 MDA-MB-231/R 3 0.29±0.02 0.21±0.02 0.63±0.04*
表4 Bcl-w表达质粒废除ABT-737对顺铂的协同作用(±s)

表4 Bcl-w表达质粒废除ABT-737对顺铂的协同作用(±s)
注:顺铂浓度为10μmol/L,ABT-737浓度为2μmol/L,空白质粒及Bcl-w质粒浓度为2μg/mL。与对照组比较*P<0.05,与顺铂+ABT-737+空质粒组比较△P<0.05
组别 n/孔 MDA-MB-231/R细胞活力抑制率(%)对照组 3 0顺铂+ABT-737组 3 59.3±4.5*空质粒组 3 2.2±0.9顺铂+ABT-737+空质粒组 3 60.7±4.7*Bcl-w质粒组 3 1.1±0.8顺铂+ABT-737+Bcl-w质粒组 3 18.3±2.1*△
2.3ABT-737联合顺铂诱导MDA-MB-231/R细胞发生线粒体途径的凋亡ABT-737显著增强顺铂对MDA-MB-231/R细胞线粒体膜电位的损伤并促使细胞色素C从线粒体中释放到细胞质中,诱导MDA-MB-231/R细胞发生凋亡,详见表5、图1。
表5 ABT-737联合顺铂诱导MDA-MB-231/R细胞发生线粒体途径的凋亡(±s,%)

表5 ABT-737联合顺铂诱导MDA-MB-231/R细胞发生线粒体途径的凋亡(±s,%)
与对照组比较*P<0.05,与10μmol/L顺铂组比较ΔP<0.05,与2μmol/L ABT-737+10μmol/L顺铂+2μg/ml空质粒组比较#P<0.05。
组别 n/孔 线粒体膜电位降低率 细胞色素C释放率 细胞凋亡率对照组 3 0 0.01±0.01 2.0±0.2 2μmol/L ABT-737组 3 3.9±0.2 0.04±0.01 4.6±0.3 10μmol/L顺铂组 3 6.5±0.5* 0.06±0.02* 8.8±0.7*2μmol/L ABT-737+10μmol/L顺铂组 3 46.2±3.4*Δ 0.39±0.04*Δ 46.7±3.9*Δ2μmol/L ABT-737+10μmol/L顺铂+2μg/ml空质粒组 3 47.4±3.6*Δ 0.37±0.04*Δ 48.3±3.8*Δ2μmol/L ABT-737+10μmol/L顺铂+2μg/ml Bcl-w质粒组 3 12.5±1.4*# 0.12±0.02*# 13.5±1.7*#
3 讨论
当肿瘤细胞出现凋亡信号(如DNA损伤)后,活化的促凋亡蛋白能打开肿瘤细胞的线粒体外膜孔道,使线粒体膜电位丧失,从而促使线粒体来源的促凋亡物质(如细胞色素C)释放到细胞质中。细胞色素C能直接诱导细胞进入caspase依赖的凋亡程序,使肿瘤细胞发生凋亡性死亡[13-14]。然而肿瘤细胞中过量的抗凋亡蛋白(如Bcl-w)能保护细胞逃避凋亡信号,因此靶向于抗凋亡蛋白的ABT-737被证实有良好的抗肿瘤活性。尽管已经有临床试验证明ABT-737有较好的抗肿瘤疗效和安全性[15],但目前仍然缺乏其与其他抗肿瘤药物联合治疗乳腺癌的研究。
在本研究中,作者构建了顺铂耐药的乳腺癌细胞模型,用以研究ABT-737是否能逆转肿瘤细胞对顺铂的耐药性,提高化疗疗效。本研究表明ABT-737确能提高耐药乳腺癌细胞对顺铂的敏感性,显著降低顺铂的治疗浓度。在机制研究中,作者通过 Western blot试验发现耐药乳腺癌细胞的Bcl-w表达水平异常升高,因此推测ABT-737可能通过抑制Bcl-w的功能实现对顺铂的协同效应。当用Bcl-w表达质粒转染MDA-MB-231/R细胞,使MDA-MB-231/R细胞强制表达Bcl-w后,作者发现ABT-737对顺铂的协同效应显著下降,证明了Bcl-w途径在顺铂耐药中的重要作用。为了进一步研究ABT-737联合顺铂杀伤MDA-MB-231/R细胞的机制,作者检测了肿瘤细胞的线粒体膜电位和细胞色素C的释放,结果发现ABT-737联合顺铂能诱导耐药乳腺癌细胞发生线粒体的损伤和细胞色C的释放,进而促使耐药乳腺癌细胞发生凋亡性死亡。
综上所述,本研究证明了ABT-737能在体外提高顺铂对耐药乳腺癌细胞的杀伤活性,其分子机制可能为通过抑制Bcl-w的功能,提高促凋亡蛋白的活性,进而促进耐药乳腺癌细胞在顺铂的治疗下发生线粒体途径的凋亡,这些实验结果为ABT-737逆转化疗耐药临床应用上提供了理论依据。

图1 ABT-737通过Bcl-w途径促进顺铂对MDA-MB-231/R细胞的凋亡诱导效应
[1]Cho KH,Yu SL,Lee HY,et al.Breast cancer metastasis suppressor 1(BRMS1)attenuates TGF-β1-induced breast cancer cell aggressiveness through downregulating HIF-1α expression.BMC Cancer,2015,15(1):829
[2]Wang Y,Gao Y,Tan W,et al.Stanniocalcin 2 promotes cell proliferation and cisplatin resistance in cervical cancer. Biochem Biophys Res Commun,2015,466(3):362
[3] Seoane S,Arias E,Perez-Fernandez R,et al.Pit-1 inhibits BRCA1 and sensitizes human breasttumors to cisplatin and vitamin D treatment.Oncotarget,2015,6(16):14456
[4]Khaw SL,Huang DC,Roberts AW.Overcoming blocks in apoptosis with BH3-mimetictherapyin haematological malignancies.Pathology,2011,43(6):525
[5]Bodur C,Basaga H.Bcl-2 inhibitors:emerging drugs in cancer therapy.Curr Med Chem,2012,19(12):1804
[6] Shin JA,Kim LH,Cho SD,et al.Targeting ERK1/2-bim signaling cascades by BH3-mimetic ABT-737 as an alternative therapeutic strategy for oral cancer.Oncotarget,2015,6 (34):35667
[7]Yu T,Chen C,Shi X,et al.ABT-737 sensitizes curcumininduced anti-melanoma cell activity through facilitating mPTP death pathway.BiochemBiophysResCommun,2015,464(1):286
[8]Zhang X,Zhang Y,Wang C,et al.MicroRNA-203 Is a PrognosticIndicatorinBladderCancerandEnhances Chemosensitivity to Cisplatin via Apoptosis by Targeting Bcl-w and Survivin.PLoS One,2015,10(11):e0143441
[9]Ou Y,Zhai D,Li X,et al.Downregulation of miR-363 increases drug resistance in cisplatin-treated HepG2 by dysregulating Mcl-1.Gene,2015,572(1):116
[10]Sun JG,Xiang J,Liu FY,et al.Clitocine induces apoptosis and enhances the lethality of ABT-737 in human colon cancer cells by disrupting the interaction of Mcl-1 and Bak.Cancer Lett,2014,355(2):253
[11]Prathapan A,Vineetha VP,Raghu KG.Protective effect of Boerhaavia diffusa L.against mitochondrial dysfunction in angiotensin II induced hypertrophy in H9c2 cardiomyoblast cells.PLoS One,2014,9(4):e96220
[12]Geserick P,Wang J,Leverkus M,et al.The ratio of Mcl-1 and Noxa determines ABT737 resistance in squamous cell carcinoma of the skin.Cell Death Dis,2015,6:e1673
[13]Kremer KN,Peterson KL,Hedin KE,et al.CXCR4 chemokine receptorsignalinginducesapoptosisinacutemyeloid leukemia cells via regulation of the Bcl-2 family members Bcl-XL,Noxa,and Bak.J Biol Chem,2013,288(32):22899
[14]Choi YM,Kim HK,Choi S,et al.Mechanism of Cisplatin-Induced Cytotoxicity Is Correlated to Impaired Metabolism Due to Mitochondrial ROS Generation.PLoS One,2015,10 (8):e0135083
[15]Lieber J,Armeanu-Ebinger S,Fuchs J.The role of BH3-mimetic drugs in the treatment of pediatric hepatoblastoma. Int J Mol Sci,2015,16(2):4190
