周期素依赖性蛋白激酶5过度活性与肾小球足细胞凋亡的关系研究
2016-08-19陆晓华郑亚莉罗红艳毕逢辰
陆晓华,郑亚莉,张 霞,李 博,保 莉,罗红艳,曹 丽,鄂 静,张 彬,毕逢辰
·论著·
周期素依赖性蛋白激酶5过度活性与肾小球足细胞凋亡的关系研究
陆晓华,郑亚莉,张 霞,李 博,保 莉,罗红艳,曹 丽,鄂 静,张 彬,毕逢辰
目的通过在肾小球足细胞中转染p25基因,探讨周期素依赖性蛋白激酶5(Cdk5)的活性对足细胞结构及功能的影响。方法2014年度,于含10%胎牛血清的RPMI 1640培养液中培养分化成熟的小鼠离体足细胞,将足细胞分为对照组、空转染组和p25转染组。应用pAdTrack-CMV病毒载体克隆p25基因,并转染足细胞,48 h收集细胞;采用Western blotting法测定Cdk5、p25、p35及细胞凋亡相关蛋白Cleaved caspase3的表达水平;应用免疫沉淀和同位素γ-32P标记法测定Cdk5活性;足细胞免疫荧光化学染色,观察Cdk5、p35在足细胞中的表达,以及足细胞Actin的排列情况。结果HEK293细胞Cdk5表达阳性,p35表达阴性,肾脏皮质、足细胞和肾小球中均有不同程度的Cdk5和p35的表达。对照组和空转染组p25表达阴性,p25转染组p25表达阳性。各组细胞凋亡相关蛋白Cleaved caspase3表达水平和Cdk5活性比较,差异有统计学意义(P<0.05);其中p25转染组细胞凋亡相关蛋白Cleaved caspase3表达水平和Cdk5活性高于对照组和空转染组(P<0.05)。p25转染组足细胞内Actin排列紊乱,细胞形态发生异常改变,对照组和空转染组细胞内Actin排列正常,细胞形态没有发生改变。结论p25引起Cdk5过度活性可致肾小球足细胞形态改变,Actin排列紊乱,诱发细胞凋亡。因此,Cdk5的活性在维持足细胞正常结构和功能方面发挥重要作用。
足细胞;细胞周期蛋白依赖激酶5;p35;p25;细胞凋亡
陆晓华,郑亚莉,张霞,等.周期素依赖性蛋白激酶5过度活性与肾小球足细胞凋亡的关系研究[J].中国全科医学,2016,19(23):2793-2797.[www.chinagp.net]
LU X H,ZHENG Y L,ZHANG X,et al.Relationship between overactivation of Cdk5 and the glomerulus podocyte apoptosis[J].Chinese General Practice,2016,19(23):2793-2797.
周期素依赖性蛋白激酶5(Cdk5)与其激活蛋白p35结合形成Cdk5/p35复合物,其活性与中枢神经系统疾病的发生、发展密切相关。在某些病理因素下,p35被水解形成活性更高的p25。Cdk5/p25具有神经毒性,诱发神经元凋亡,引起神经退行性病变[1]。目前发现,Cdk5和p35也存在于肾小球足细胞,并具有维持足细胞结构和功能的作用。正常足细胞中是否存在p25,以及Cdk5的过度激活复合物Cdk5/p25是否引起足细胞损害尚不明确。本研究通过在足细胞中过度表达p25,观察Cdk5/p25活性对足细胞结构和功能的影响。
1 材料与方法
1.1抗体和试剂分化成熟的小鼠离体肾脏皮质、足细胞和肾小球标本(美国国立卫生研究院,国家糖尿病、消化系统病和肾病研究所Dr.Jeffrey Kopp实验室提供),HEK293细胞(美国Cayman公司),抗Cdk5抗体(1∶1 000或1∶100)、抗p35抗体(1∶1 000或1∶100)、抗WT1抗体(1∶2 500,美国Santa Cruz公司),抗Cleaved caspase3抗体(1∶1 000,美国Cell Signaling Technology),抗Tubulin抗体和抗β-actin抗体(1∶3 000或1∶500,美国Sigma公司),Roscovitine(美国ChEMBL公司),Lipofectamin 2000基因转染试剂、DMEM培养液(美国Invitrogen生命技术公司),胎牛血清(美国Hyclone公司)。
1.2方法
1.2.1细胞的培养及分组2014年度,参考文献[2]体外培养分化成熟的小鼠离体足细胞,将细胞培养在胶原Ⅰ涂层的培养瓶或培养皿中,培养基为含10%胎牛血清的RPMI 1640,加入2 mmol/L谷氨酰胺,10 mmol/L HEPES液,1 mmol/L丙戊酸钠,100 U/ml青霉素和链霉素。将细胞放置33 ℃孵育箱,并在培养液中加10 U/ml重组鼠γ-interferon诱发细胞增生。将细胞铺板,放置到37 ℃,5% CO2的孵育箱内培养10~14 d,使细胞分化。将细胞分为对照组、空转染组和p25转染组。
1.2.2p25基因转染设计并合成p25引物[3],PCR扩增,将扩增产物进行DNA测序分析正常后,将扩增产物和腺病毒质粒载体pAdTrack-CMV用限制性酶NotI和ECORV酶切,从DNA胶里提取线性片段,将两者混合后,37 ℃水浴 2 h,加入 DNA连接酶,获得含有p25靶基因病毒质粒。将上述质粒转入HEK293细胞内,繁殖48 h后收取病毒,纯化并滴定最佳的转染浓度。将足细胞铺板于6-well培养盘,使其分化10 d后转染空载体或携带有p25基因的腺病毒(1 μl/ml),48 h后收取足细胞。
1.2.3Cdk5、p25、p35及细胞凋亡相关蛋白Cleaved caspase3的表达采用Western blotting法测定Cdk5、p25、p35及细胞凋亡相关蛋白Cleaved caspase3的表达水平,将提取的蛋白上样到4%~20%的聚丙烯酰胺凝胶上,电泳分离,转膜(100 V,90 min)。用5%脱脂奶粉封闭液封闭1 h;加入一抗(用封闭液稀释),4 ℃孵育过夜;漂洗后与山羊抗鼠或山羊抗兔的IgG(H+L)-HRP共轭二抗(1∶2 500)室温下孵育 1~2 h;X线底片曝光,定性分析Cdk5、p35在HEK293细胞、肾脏皮质、足细胞、肾小球,以及Cdk5、p25和p35在不同转染组中的表达;以光密度值反映细胞凋亡相关蛋白Cleaved caspase3的表达水平。实验重复3次。
1.2.4Cdk5活性应用免疫沉淀和同位素γ-32P标记法测定Cdk5活性,裂解细胞,提取蛋白,蛋白质比色定量分析(BCA法)进行蛋白定量分析。取300 μg蛋白加Cdk5多克隆抗体(1∶20),4 ℃孵育过夜,次日加IgA琼脂糖凝胶珠4 ℃孵育4 h,用细胞溶解液洗涤3次,用同位素γ-32P标记法测定Cdk5活性。实验重复3次。
1.2.5免疫荧光化学染色4%多聚甲醛溶液固定细胞30 min,用磷酸盐缓冲液(PBS)洗涤3次,5%牛血清清蛋白(BSA)封闭液封闭30 min,加入一抗,4 ℃孵育过夜。次日用PBS洗涤3次,加入二抗,室温孵育1 h,再用PBS洗涤3次,细胞核用DAPI染色5 min,加盖载玻片。采用Zeiss LSM-510激光扫描共聚焦显微镜采集荧光图像,观察Cdk5、p35在足细胞中的表达,以及足细胞Actin的排列情况。

2 结果
2.1Cdk5、p25、p35的表达HEK293细胞Cdk5表达阳性,p35表达阴性,肾脏皮质、足细胞和肾小球中均有不同程度的Cdk5和p35的表达(见图1)。免疫荧光化学染色显示,足细胞Cdk5和p35表达阳性(见图2,本文彩图详见本刊官网www.chinagp.net电子期刊相应文章附件)。对照组和空转染组p25表达阴性,p25转染组p25表达阳性(见图3)。

注:1为HEK293细胞,2为肾脏皮质,3为足细胞,4为肾小球;Cdk5=周期素依赖性蛋白激酶5
图1Western blotting法测定Cdk5和p35的表达
Figure 1The expression of Cdk5 and p35 detected by Western blotting
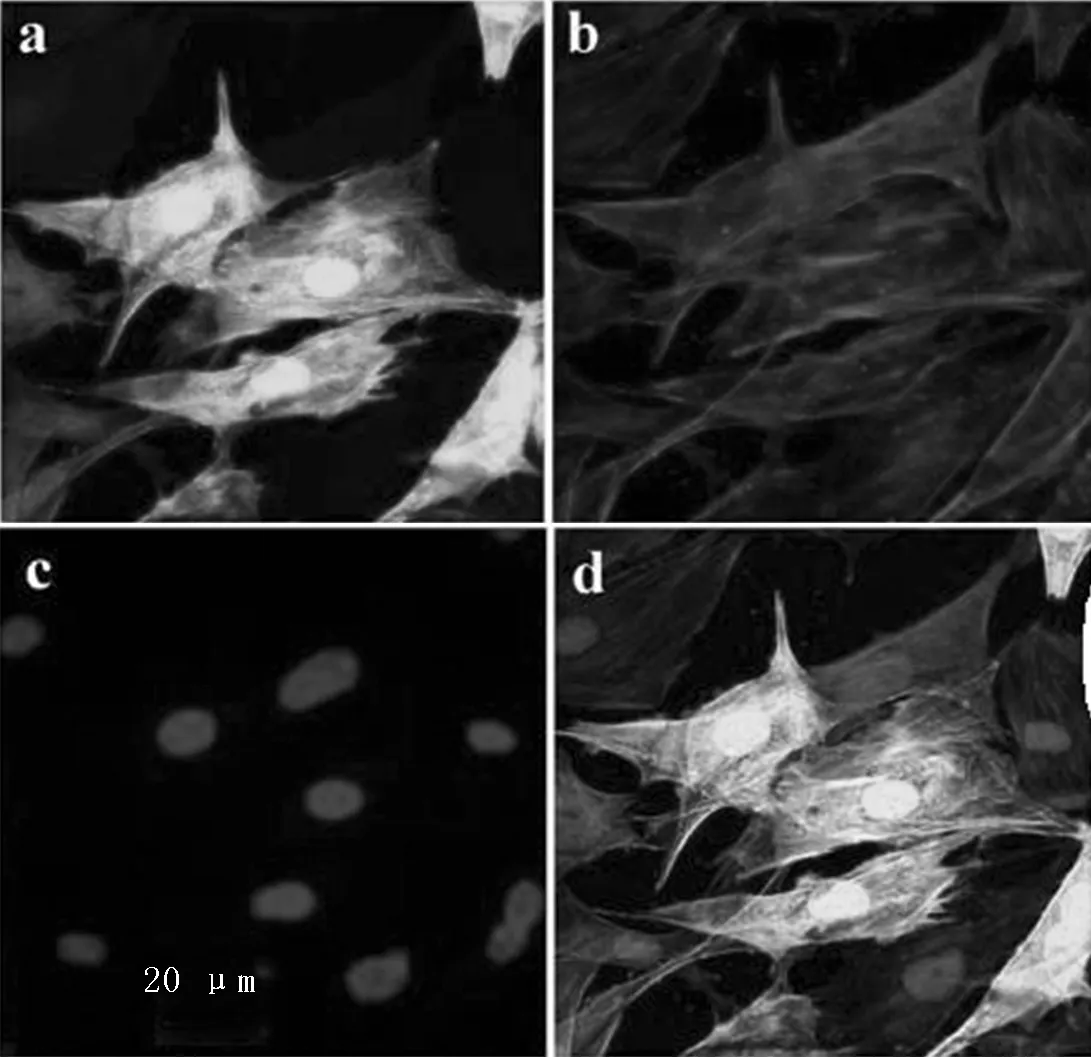
注:a示Cdk5在足细胞表达,b示p35在足细胞表达,c示足细胞核染色,d示重叠
图2免疫荧光染色测定Cdk5和p35在足细胞中的表达(×400)
Figure 2The expression of Cdk5 and p35 in podocyte determined by immunofluorescence staining
2.2细胞凋亡相关蛋白Cleaved caspase3的表达各组细胞凋亡相关蛋白Cleaved caspase3表达水平和Cdk5活性比较,差异有统计学意义(P<0.05);其中p25转染组细胞凋亡相关蛋白Cleaved caspase3表达水平和Cdk5活性高于对照组和空转染组,差异有统计学意义(P<0.05,见表1)。
2.3细胞结构和形态改变p25转染组足细胞内Actin排列紊乱,细胞形态发生异常改变,对照组和空转染组细胞内Actin排列正常,细胞形态没有发生改变(见图4)。

注:1为对照组,2为空转染组,3为p25转染组
图3各组细胞转染后Cdk5、p25和p35的表达
Figure 3The expression of Cdk5,p25 and p35 among different transfected cells group
3 讨论
Cdk5是细胞周期素依赖蛋白激酶家族的特殊成员,是脯氨酸限制性丝氨酸/苏氨酸蛋白激酶,Cdk5并不直接参与细胞周期的调节,主要通过对其底物的磷酸化来发挥功能。生理情况下,与p35结合而被激活,在维持神经元和胰岛细胞正常功能中发挥重要作用[3-4]。
在神经退行性疾病,如阿尔茨海默病的发生过程中,Cdk5通过如下机制诱导神经元的凋亡,首先p35被水解形成分子量更小的多肽片段p25,并与Cdk5结合形成活性更高的Cdk5/p25复合物,使得Cdk5被过度激活,过度激活的Cdk5具有明显的神经毒性,通过诱导神经元中tau的异常磷酸化,导致神经元骨架破坏,诱发神经元的凋亡,使得机体相应的功能发生障碍[5-6]。足细胞是肾小球基底膜外高度分化的细胞,参与肾小球的细胞滤过屏障。目前发现,Cdk5和p35也存在于肾小球足细胞,并具有维持足细胞结构和功能的作用。本研究通过在足细胞中转入p25基因观察Cdk5/p25活性对足细胞结构和功能的影响。

Table 1The expression of apoptosis related protein Cleaved caspase3 and Cdk5 activition among different groups
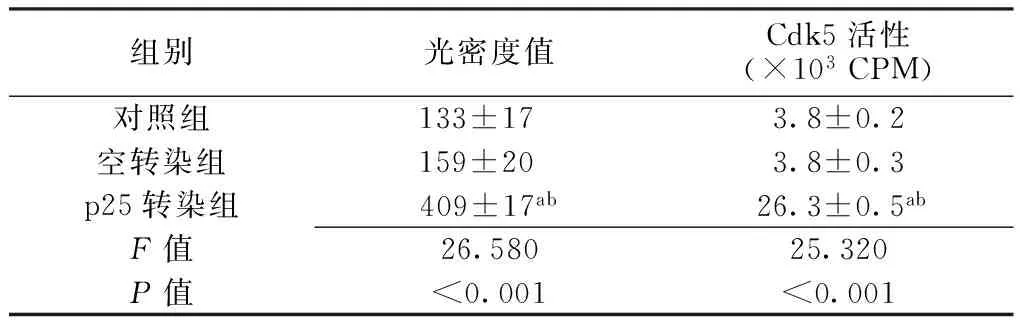
组别光密度值Cdk5活性(×103CPM)对照组133±17 3.8±0.2空转染组159±20 3.8±0.3p25转染组409±17ab26.3±0.5abF值26.58025.320P值<0.001<0.001
注:Cdk5=周期素依赖性蛋白激酶5;与对照组比较,aP<0.05;与空转染组比较,bP<0.05

图4 各组Actin的排列和细胞形态(免疫荧光化学染色,×400)
前期研究发现,正常分化成熟的离体足细胞有Cdk5和p35的表达,Cdk5/p35活性在维持足细胞生理结构和功能中发挥一定作用[7-8],该结果在本研究中进一步得到证实。本研究发现,在正常肾组织和足细胞中没有p25表达。将p25基因转染足细胞时,Cdk5活性被过度活化,使细胞凋亡相关蛋白Cleaved caspase3表达水平升高,足细胞内Actin排列紊乱,细胞形态发生异常改变,细胞凋亡增加,与神经元和胰岛β细胞中诱发和转入p25基因的研究结果相同[9-12]。说明p25过度激活Cdk5的活性引起细胞凋亡这一途径在足细胞的凋亡中也同样发生。
肾小球足细胞是一种终末分化的上皮细胞,生理情况下附着在肾小球基底膜外,是肾小球细胞最后一道屏障,损伤后无再生能力[13],足细胞损伤常被认为是导致各种肾小球疾病发生和发展的关键因素,足细胞的破坏已成为反映肾脏损伤严重程度和进展的重要评判指标。因此,p25可引起足细胞结构紊乱、诱发细胞凋亡,对研究引起肾小球足细胞损伤的原因、凋亡的机制以及足细胞损伤的治疗具有重要意义。
综上所述,生理情况下足细胞中没有p25的表达,Cdk5被p35激活,在维持足细胞结构的稳定和生理功能中发挥重要作用。病理情况下,足细胞中表达p25也可引起Cdk5的过度激活,引起足细胞结构紊乱,形态改变,诱发足细胞凋亡。但诱发p25产生的病理情况以及Cdk5过度激活引起足细胞凋亡的机制有待于进一步深入研究。
作者贡献:陆晓华、郑亚莉进行课题设计与实施、资料收集整理、撰写论文、成文并对文章负责;张霞、李博、保莉、罗红艳、曹丽、鄂静、张彬、毕逢辰进行课题实施、评估、资料收集;郑亚莉进行质量控制及审校。
本文无利益冲突。
[1]LI X,CHAN L,ZHANG H,et al.Effects of arsenic poisoning on neuronal cell apoptosis and mRNA and protein expression of calpain 1,calpain 2,and cdk5/p25[J].Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi,2014,32(3):202-206.
[2]GRIFFIN S V,HIROMURA K,PIPPIN J,et al.Cyclin-dependent kinase 5 is a regulator of podocyte differentiation,proliferation,and morphology[J].Am J Pathol,2004,165(4):1175-1185.
[3]TAN X,CHEN Y,LI J,et al.The inhibition of Cdk5 activity after hypoxia/ischemia injury reduces infarct size and promotes functional recovery in neonatal rats[J].Neuroscience,2015,290:552-560.
[4]TIAN F,XU L H,WANG B,et al.The neuroprotective mechanism of puerarin in the treatment of acute spinal ischemia-reperfusion injury is linked to cyclin-dependent kinase 5[J].Neurosci Lett,2015,584:50-55.
[5]BINUKUMAR B K,SHUKLA V,AMIN N D,et al.Peptide TFP5/TP5 derived from Cdk5 activator P35 provides neuroprotection in the MPTP model of Parkinson′s disease[J].Mol Biol Cell,2015,26(24):4478-4479.
[6]KE K,SHEN J,SONG Y,et al.CDK5 contributes to neuronal apoptosis via promoting MEF2D phosphorylation in rat model of intracerebral hemorrhage[J].J Mol Neurosci,2015,56(1):48-59.
[7]毕逢辰,张霞,郑亚莉.Cdk5在肾小球足细胞中的表达及作用[J].宁夏医学杂志,2014,36(3):193-195.
BI F C,ZHANG X,ZHENG Y L.Expression and function of Cdk5 in glomerular podocyte[J].Ningxia Medical Journal,2014,36(3):193-195.
[8]杨丽嵘,李博,郑亚莉.沉默p35表达引起肾小球足细胞凋亡的研究[J].宁夏医学杂志,2014,36(3):198-200.
YANG L R,LI B,ZHENG Y L.The expression of silence p35 in the glomerular podocyte resulting in cell apoptosis[J].Ningxia Medical Journal,2014,36(3):198-200.
[9]MOHSENI P,SUNG H K,MURPHY A J,et al.Nestin is not essential for development of the CNS but required for dispersion of acetylcholine receptor clusters at the area of neuromuscular junctions[J].J Neurosci,2011,31(32):11547-11552.
[10]ZHANG Y,LI H,HAO J,et al.High glucose increases Cdk5 activity in podocytes via transforming growth factor-beta1 signaling pathway[J].Exp Cell Res,2014,326(2):219-229.
[11]HAGMANN H,TANIGUCHI Y,PIPPIN J W,et al.Cyclin I and p35 determine the subcellular distribution of Cdk5[J].Am J Physiol Cell Physiol,2015,308(4):C339-347.
[12]LIU W,ZHANG Y,HAO J,et al.Nestin protects mouse podocytes against high glucose-induced apoptosis by a Cdk5-dependent mechanism[J].J Cell Biochem,2012,113(10):3186-3196.
[13]LIAO R,LIU Q,ZHENG Z,et al.Tacrolimus protects podocytes from injury in lupus nephritis partly by stabilizing the cytoskeleton and inhibiting podocyte apoptosis[J].PLoS One,2015,10(7):e132724.
(本文编辑:吴立波)
Relationship Between Overactivation of Cdk5 and the Glomerulus Podocyte Apoptosis
LUXiao-hua,ZHENGYa-li,ZHANGXia,LIBo,BAOLi,LUOHong-yan,CAOLi,EJing,ZHANGBin,BIFeng-chen.
DepartmentofNephrology,NingxiaPeople′sHospital,Yinchuan750021,China
ZHENGYa-li,DepartmentofNephrology,NingxiaPeople′sHospital,Yinchuan750021,China;E-mail:424570556@qq.com
ObjectiveTo study the influence of Cdk5 activity on the structure and function of glomerulus podocyte by transfection of p25 gene.MethodsIn 2014,differentiated and mature isolated mouse podocytes were cultured in RPMI 1640 medium with 10% fetal bovine serum and divided into three groups including control group,empty group and p25 group.p25 gene was cloned through the pAdTrack-CMV viral vector,and transfected into podocytes.After 48 hours,cells were collected for further analysis.Cdk5,p25,p35,Cleaved caspase3 expressions were detected by Western blotting method;Cdk5 activity were tested through immunoprecipitation and isotope γ-32P marking methods.In order to observe the expression of Cdk5,p35 and structure of Actin in podocyte,immunofluorescent staining were conducted.ResultsCak5 in HEK293 cells had positive expression while p35 had negative expression;there were different levels of Cdk5 and p35 in renal cortex,podocyte and glomerulus.p25 had negative expression in control group and empty group while positive expression in p25 group.As for the expression levels of Cleaved caspase3 and Cdk5 activity in different groups,differences were of statistical significance(P<0.05);the expression levels of Cleaved caspase3 and Cdk5 activity in p25 group was higher than those in the other two groups(P<0.05).In p25 group,Actin within podocyte were arranged in disorder and forms of cells were abnormal,while those conditions were on the contrary in the other two groups.Conclusionp25 causes overactivation of Cdk5 and induces podocyte morphological change,Actin arrangement disorder and cell apoptosis.Therefore,Cdk5 activity plays an important role in maintaining normal structure and function of podocyte.
Podocytes;Cyclin-dependent kinase 5;p35;p25;Apoptosis
国家自然科学基金资助项目(81160093,81460161);宁夏自然科学基金资助项目(NZ14160);宁夏科技支撑基金资助项目(2013ZYS103)
750021宁夏银川市,宁夏回族自治区人民医院 西北民族大学医学院第一附属医院肾内科(陆晓华,郑亚莉,张霞,李博,保莉,罗红艳,曹丽,鄂静,毕逢辰);宁夏医科大学研究生学院(张彬)
郑亚莉,750021宁夏银川市,宁夏回族自治区人民医院 西北民族大学医学院第一附属医院肾内科;E-mail:424570556@qq.com
R 322.61
A
10.3969/j.issn.1007-9572.2016.23.011
2015-11-24;
2016-04-25)
