脂多糖对体外培养的人冠状动脉平滑肌细胞生长的影响
——对建立支架内再狭窄炎症细胞模型的探索
2016-08-19李红梅王显
李红梅,王显
脂多糖对体外培养的人冠状动脉平滑肌细胞生长的影响
——对建立支架内再狭窄炎症细胞模型的探索
李红梅1,2,王显1,2
目的 探讨不同浓度脂多糖(LPS)作用不同时间对体外培养的人冠状动脉平滑肌细胞(HCASMC)生长的影响,分析其应用于HCASMC的无毒性反应浓度范围,为开展介入术后再狭窄相关研究建立HCASMC炎症活化模型提供实验数据支持。方法 体外培养的HCASMC 3~5代,加入96孔细胞培养板,用噻唑蓝比色实验(MTT法)检测不同浓度(0 μg/ml,0.01 μg/ml,0.1 μg/ml,0.5 μg/ml,1 μg/ml,5 μg/ml,10 μg/ml,100 μg/ml)LPS在不同作用时间(24 h,46 h,72 h)下对HCASMC活力影响,酶标仪492 nm处测定各组A值,细胞活力=(实验组A值-调零孔A值)/对照组A值。结果 LPS在低于100 μg/ml浓度范围内,干预HCASMC时间短于48 h未出现细胞毒性,多表现为促细胞增殖效应,而干预时间大于48 h则显现出较为明显的细胞毒性,且细胞活力随LPS浓度的增大而减低;干预72 h后LPS浓度在0~0.01μg/ml范围内有促增殖作用,0.1~0.5μg/ml浓度则产生轻微的细胞抑制作用,但细胞毒性不明显,在1~100 μg/ml浓度下HCASMC毒性反应逐渐出现,且HCASMC活力随LPS浓度的升高而减低。同一浓度水平的LPS随着作用时间延长,HCASMC的细胞活力逐步下降,且作用时间越长下降越明显。结论LPS在浓度0.1 μg/ml以下未出现明显的细胞毒性,其中LPS浓度0.01 μg/ml干预24 h,人冠状动脉平滑肌细胞增殖最显著,可作为建立炎症诱导人冠状动脉平滑肌细胞活化模型的最佳条件。
脂多糖;人冠状动脉平滑肌细胞;细胞活力;细胞毒性
经皮冠状动脉介入治疗(PCI)是动脉粥样硬化性心血管疾病治疗史上的一大突破,然而介入术后3个月内仍有10%~20%的再狭窄率,部分甚至并未降低主要不良心血管事件的发生[1,2]。目前国内外十分关注支架内再狭窄和支架血栓与炎症因子之间的密切关系,公认血管内膜增生是动脉血管对各种损伤的一种反应,也是PCI术后再狭窄的重要标志[3,4]。人冠状动脉平滑肌细胞(HCASMC)被各种损伤刺激激活后,由静息状态转变为增殖表型并移行到内膜下,参与合成各种细胞外基质,在内膜增生过程中具有重要作用。越来越多的证据表明各种组织损伤能够通过诱导先天免疫反应,促进动脉壁的炎症,进而激活HCASMC加剧血管内膜增生。炎症诱导活化的HCASMC在介入术后再狭窄形成中起关键作用,针对HCASMC进行炎症相关实验研究成为明确再狭窄核心机制的切入点。
脂多糖(lipopolysaccharide,LPS)也被称为内毒素,是革兰阴性细菌细胞壁的主要组成成分之一,作为具有高度保守结构的病原相关分子模式,在细胞内信号转导中充当Toll样受体(Toll-like receptors,TLRs)信号转导分子配体,可刺激HCASMC分泌多种炎症细胞因子、趋化因子、基质金属蛋白酶等,适合用于炎症状态下HCASMC功能的研究。由于建立HCASMC炎症状态下活化模型是再狭窄机制研究的基础,本实验选用不同浓度LPS作用不同时间于体外培养的HCASMC,观察不同条件下LPS对体外培养的HCASMC生长和增殖的影响,探索建立炎症刺激HCASMC活化模型的LPS最佳浓度和作用时间,以期为利用LPS研究HCASMC炎症增殖所致介入术后再狭窄机制提供实验数据支持。
1 材料和方法
1.1主要材料
1.1.1试剂 HCASMC(货号:FC-0031)、平滑肌细胞培养基、胰酶、胰酶抑制剂、冻存液均购自美国Life line公司;磷酸盐缓冲液、噻唑兰(MTT)粉末250 mg、二甲基亚矾(DMSO)瓶装100 ml,均购自北京索莱宝科技有限公司;脂多糖10 mg/ml(货号:L8880-10),购自Sigma (L2880)。
1.1.2仪器 超净工作台CJT-E-Ⅱ(北京昌平长城空气净化工程公司)、倒置相差显微镜(Olympus CKX×41)、低速离心机LD4-2(北京雷勃尔离心机有限公司)、培养箱MCO-20AIC(SANYO Elecronic.Ltd.JAPEN)、-80℃低温冰箱(美国REVCO Legaci)、电热恒温水箱(HH.W21.420)、全自动酶标仪(Clinicbio 128C)、十万分之一精密电子分析天平(日本岛津AEC-45SM)。
1.2方法
1.2.1人冠状动脉平滑肌细胞的体外培养 将保存于液氮罐中的细胞取出后立刻放到干冰上,将管子浸入37℃水浴中,待细胞悬液融化后将细胞接种于培养瓶,并放入培养箱中(37℃,5%CO2)培养,次日更换培养基。之后2~3 d传代一次,实验选用3~5代细胞。
1.2.2实验分组 实验时设置调零孔、对照孔(5个复孔)、LPS孔(每组6个复孔)。调零孔不加细胞,对照孔加细胞但培养基不加LPS,LPS孔加细胞和溶解有不同浓度LPS的培养基(0.01 μg/ml组,0.1 μg/ml组,0.5 μg/ml组,1 μg/ml组,5 μg/ml组,10 μg/ml组和100 μg/ml组)。
1.2.3接种细胞 当细胞数占整个瓶底70%~80%时,将细胞消化计数后调整细胞密度为8×104个/mL,接种于三块96孔板(调零孔加100μl无细胞培养基),100μl/孔,边缘孔加入150μl PBS液填充,然后置于37℃、5%CO2培养箱中培养,次日加不同浓度LPS。
1.2.4LPS干预措施 加LPS 次日取出三块96孔板以无菌PBS冲洗2遍,调零孔和对照组每孔加入100μl正常培养基,LPS组每孔加入对应等体积浓度的LPS溶液,置于37℃、5%CO2培养箱中孵育。其中96孔板一用LPS刺激24 h,96孔板二用LPS刺激48 h,96孔板三用LPS刺激72 h。
1.2.5检测细胞抑制率 96孔板达到各自LPS刺激时间后每孔加入20μl 0.5 mg/ml的对应MTT培养基溶液,然后置于37℃、5%CO2培养箱继续培养4 h后,吸弃上清,每孔加150μl DMSO振荡10 min,待结晶全部溶解后于酶标仪492 nm处测各孔A值,并计算不同浓度LPS刺激不同时间对HCASMC生长的影响。细胞活力=(实验组A值-调零孔A值)/对照组A值。
1.3统计学处理 用SPSS 17.0统计软件进行数据处理,计量资料采用均数±标准差(±s)表示,组间均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1细胞培养 通过倒置相差显微镜观察,刚复苏的HCASMC漂浮于培养基中呈未贴壁状态,细胞缩为圆形,单个或成团存在,体积较小。培养6 h后大部分细胞贴壁,24 h后细胞贴壁完全。贴壁的HCASMC变为梭形生长,伸展性好,透明度好,3 d后进入对数生长期并相互重叠生长,呈致密束状排列(图1,图2)。
2.2不同浓度LPS作用24 h对HCASMC生长及增殖的影响 倒置显微镜镜下观察,刚种入96孔板的HCASMC体积较小,为圆形,非贴壁漂浮于培养基中,2 h后逐渐贴壁变为梭形生长,加入不同浓度LPS前各孔细胞已进入对数生长期并铺满孔底80%。不同浓度LPS作用24 h后均对HCASMC产生促增殖作用,各LPS孔细胞数量增多,密度较对照组偏大。

图1 倒置相差显微镜下HCASMC (40×)
图2 倒置相差显微镜下HCASMC (100×)
统计学结果显示:与对照组相比,低中浓度(0.01 μg/ml、0.1 μg/ml、1 μg/ml及5 μg/ml)LPS对HCASMC有明显促增殖作用,差异有统计学意义(P均<0.05)。各浓度LPS都能增强细胞活力,其中0.01 μg/ml组LPS促增殖能力最明显,细胞活力最强。但各组促增殖作用并未体现出浓度依赖性(表1,图3)。
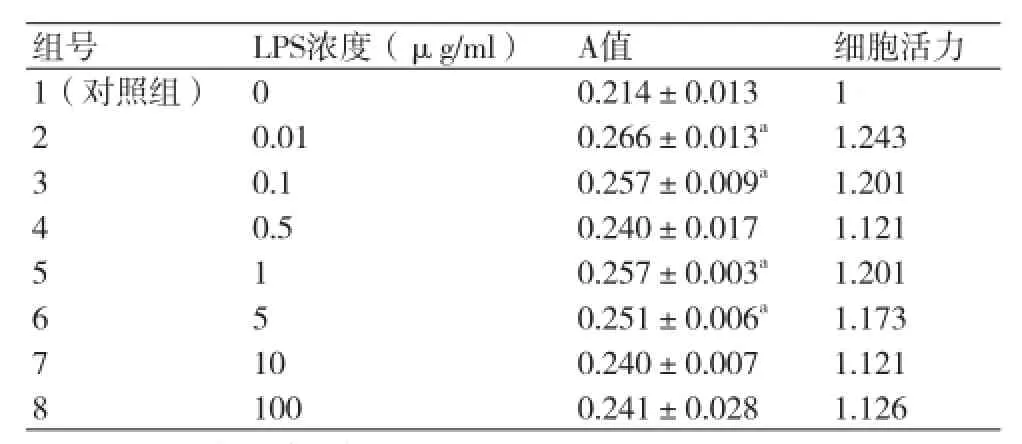
表1 不同浓度LPS作用24 h对HCASMC生长的影响
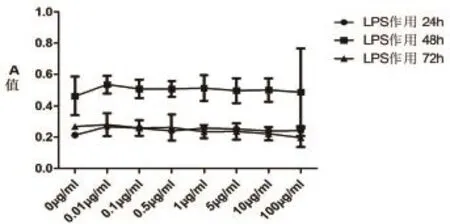
图3 不同浓度LPS作用不同时间对HCASMC生长的影响
2.3不同浓度LPS作用48 h对HCASMC生长及增殖的影响 倒置显微镜镜下观察,加入不同浓度LPS前各孔细胞已进入对数生长期并铺满孔底80%。不同浓度LPS作用48 h后均对HCASMC产生促增殖作用,各LPS孔细胞数量增多,密度增大,与作用24 h相比促细胞增殖能力稍有下降。
统计学结果显示:与对照组相比,不同浓度LPS对HCASMC增殖无明显影响,差异无统计学意义(P均>0.05)。但不同浓度LPS都对HCASMC活力有增强作用,其中0.01 μg/ml浓度的LPS促增殖能力最强。LPS孵育48 h促增殖作用无浓度依赖性(表2,图3)。
2.4不同浓度LPS作用72h对HCASMC生长及增
殖的影响 倒置显微镜镜下观察,0.01μg/ml组 LPS作用72 h后HCASMC细胞数量增多,密度较对照组偏大,1~100μg/ml浓度组各孔细胞缩小变圆,部分细胞脱落漂浮于培养基中,细胞透明度降低,舒缩性较差,其余LPS浓度孔细胞与对照组相比未见显著改变。
统计学结果显示:与对照组相比,100μg/ml 组LPS作用72 h后对HCASMC增殖的抑制作用明显,差异有统计学意义(P<0.05),显现明显的细胞毒性。LPS浓度在0~0.01 μg/ml范围内有促增殖作用,0.1~0.5 μg/ml浓度产生轻微的细胞抑制作用,但细胞毒性不明显,在1~100 μg/ml浓度下HCASMC毒性反应逐渐出现,且HCASMC活力随LPS浓度的升高而减低(表3,图3)。
2.5不同浓度LPS不同作用时间对HCASMC细胞活力的影响对比 各浓度组作用24 h后细胞活力升高,作用48 h后轻度升高,而作用72 h后细胞活力下降。同一浓度水平的LPS随着作用时间延长,HCASMC的细胞活力逐步下降,且作用时间越长下降越明显(表4,图4)。
3 讨论
动脉粥样硬化性心血管疾病引发的急性心血管事件是严重危害人类生命健康的头号杀手,经导管支架植入术成为目前治疗的有效途径,然而支架术后有10%~20%再狭窄率以及延迟性支架血栓形成风险成为介入领域广泛关注的热点和难点。通常认为,支架内再狭窄是局部血管对损伤的一种反应,支架术后血管重塑与炎症、平滑肌细胞增殖和凋亡、内皮功能损害、血栓形成等密切相关[5],血管平滑肌细胞表型转换、增殖和迁移是常见血管病变的共同病理基础[6,7]。研究表明,在炎症细胞浸润和血小板聚集的共同作用下,大量细胞因子和生长因子释放,激活血管中层平滑肌细胞,促进平滑肌细胞表型转换、增殖和迁移,并合成大量细胞外基质,导致血管内膜增厚和管腔狭窄[8-10]。
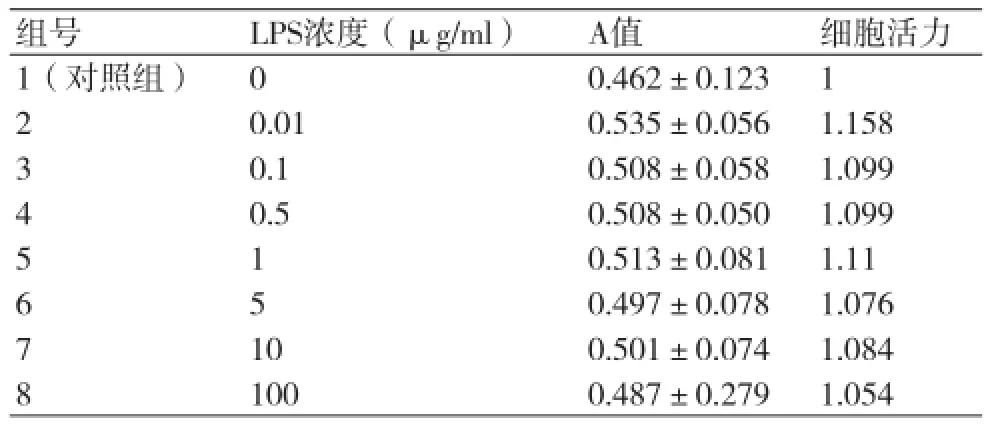
表2 不同浓度LPS作用48h对HCASMC生长的影响
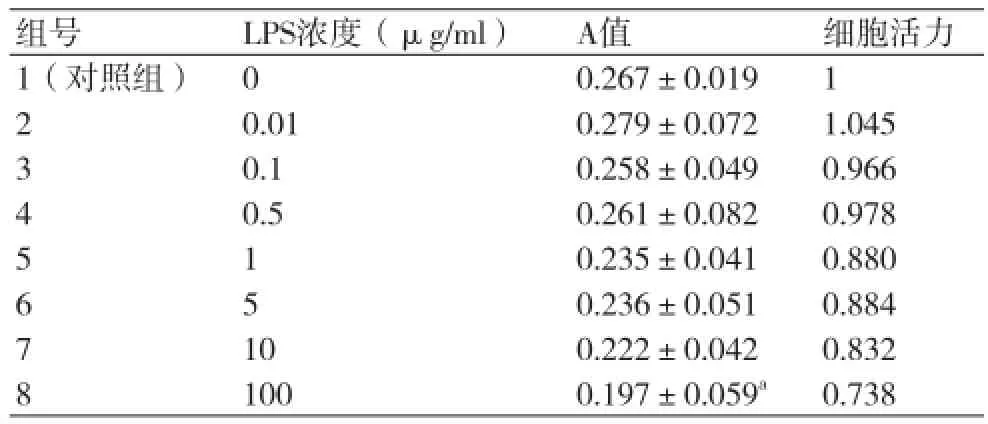
表3 不同浓度LPS作用72h对HCASMC生长的影响
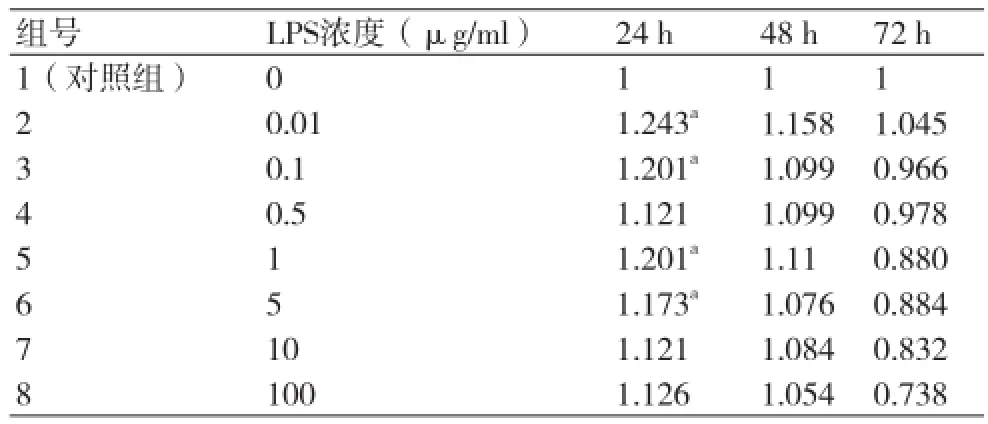
表4 不同浓度LPS作用不同时间对HCASMC细胞活力的影响
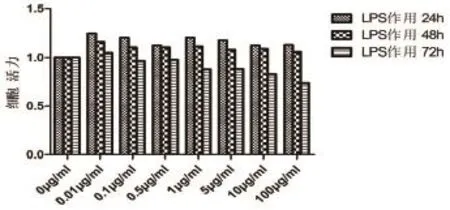
图4 不同浓度LPS作用不同时间对HCASMC活力的影响
模式识别受体是一种经过广泛选择的种系编码受体,它们通过分子模式来感知侵入机体的危险信号,与其它免疫组分一起构成了机体的第一道防线[11,12],其中Toll样受体(toll 1ike receptors,TLRs)是研究较多的参与炎症反应且与先天免疫有关的模式识别受体家族。TLRs(包括TLR2和TLR4)能识别病原体,在病原体入侵机体的早期即可启动先天免疫,TLR4介导的髓样分化蛋白MyD88(myeloid differentiation protein 88,MyD88)信号转导通路在抗感染中发挥重要作用[11]。近年来研究发现,TLR4能识别组织细胞损伤后释放的内源性配基和一些危险信号,从而介导炎症性反应和细胞增殖与分化等[4,12]。TLR4被激活后引起自身的二聚化与MyD88结合,MyD88通过其死域与白细胞介素-1受体相关激酶(IL-1 receptor-associated kinase,IRAK)结合,导致IRAK的自身磷酸化,从而激活肿瘤坏死因子受体相关因子-6(tumor necrosis factor receptor-associated factor 6,TRAF6),促使有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)家族活化,其中核转录因子-κB(nuclear factor-κB,NF-κB)诱导激酶激活I-κB家族α、β激酶,导致I-κB磷酸化而降解,使NF-κB移位到细胞核,启动TNF-α、IL-1、IL-6等炎症细胞因子的转录,这些炎症介质参与血管损伤反应,在HCASMC增殖、分化和凋亡的过程中起到重要的调节作用[12-14]。由此可见,成功建立TLRs-MyD88炎症激活状态下的HCASMC模型作为支架内再狭窄的研究载体将成为下一步研究的核心所在,而LPS作为TLRs-MyD88炎症信号通路的直接激活剂,成为本实验干预研究的主要制剂。
LPS是炎症相关研究的常用药物。体外培养的HCASMC识别革兰氏阴性细菌细胞壁成分LPS并释放多种细胞因子、趋化因子,促进动脉粥样斑块的形成。Toll-4受体作为LPS的主要受体,参与LPS信号的跨膜转导。TLR4转导通路中的信号蛋白及下游转录因子在数量、结构和功能上发生改变,可引起炎症因子释放、抗炎因子产生减少,并导致特定信号通路的激活[15],因此合理应用这一药物是后续建立HCASMC炎症细胞模型成败的关键。
MTT法[16-18]是一种检测细胞存活和生长的方法,其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为不溶于水的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能。二甲基亚砜能溶解细胞中的甲瓒,用酶标仪在490 nm波长处测定其吸光度值,可间接反映活细胞数量,在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。因本方法具有灵敏度高、经济实用的特点,故本研究选择MTT法作为检测LPS刺激细胞生长增殖情况的基本方法。
本研究发现,LPS不同浓度和不同作用时间对体外培养的HCASMC细胞生长有着直接影响。LPS<100μg/ml时,干预HCASMC时间小于48 h未出现明显细胞毒性,而干预时间大于48 h则显现出较为明显的细胞毒性,且细胞活力随LPS浓度的增大而减低;干预72 h后LPS浓度在0~0.01 μg/ml范围内有促增殖作用,0.01~1 μg/ml浓度产生轻微的细胞抑制作用,但细胞毒性不明显,在1~100 μg/ml浓度下HCASMC毒性反应逐渐出现。同一浓度水平的LPS作用下则随着时间延长,HCASMC的细胞活力逐步下降,且作用时间越长下降越明显。
由此可以推测,LPS在浓度1 μg/ml以下不会引起细胞毒性,0.01 μg/ml干预24 h条件下可最大程度刺激HCASMC增殖,可作为建立炎症诱导HCASMC活化模型的最佳条件。但本研究也存在一些不足,首先本研究是基于离体水平的实验探索,在体水平的研究有待进一步完善。其次,本研究只初步观察了LPS对HCASMC生长增殖的影响,摸索出的条件仅能够简单反映炎症条件下的HCASMC增殖状态,然而此条件下能否同时对细胞内TLRs-MyD88炎症信号通路产生最大程度的激活作用还需完善后续实验进行证实和摸索。
[1] Vecih Oduncu,Ayhan Erkol,Ibrahim Halil Tanboga,et al. Late bare metal stent thrombosis[J]. Turk Kardiyol Dern Ars-Arch Turk Soc Cardiol,2010,38(6):422-5.
[2] Gurvitch R,Lefkovits J,Warren RJ,et al. Clinical outcomes of drug-eluting stent use in patients with ST elevation myocardial infarction[J]. Int J Cardiol,2010,143(3):283-8.
[3] Liu N,Liu JT,Ji YY,et al. C-reactive protein triggers inflammatory responses partly via TLR4/IRF3/NF-κB signaling pathway in rat vascular smooth muscle cells[J]. Life Sci,2010,87(11-12):367-74.
[4] Park S,Yoon SJ,Tae HJ,et al. RAGE and cardiovascular disease[J]. Front Biosci, 2011,16:486-97.
[5] Carthy JM,Luo Z,McManus BM. WNT3A induces a contractile and secretory phenotype in cultured vascular smooth muscle cells that is associated with increased gap junction communication[J]. Lab Invest,2012,92(2):246-55.
[6] Figueroa XF,Isakson BE,Duling BR. Vascular gap junctions in hypertension[J]. Hypertension,2006,48(5):804-11.
[7] Figueroa XF,Duling BR. Gap junctions in the control of vascular function[J]. Antioxid Redox Signa,2009,11(2):251-66.
[8] Owens GK,Kkumar MS,Wamhoff BR. Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J]. Physiol Rev,2004,84(3):767-801.
[9] Costa MA,Simon DI. Molecular basis of restenosis and drug-eluting stents[J]. Circulation,2005,111(17):2257-73.
[10] Guildford AL,Stewart HJ,Morris C,et al. Substrate-induced phenotypic switches of human smooth muscle cells:an in vitro study of in-stent restenosisactivation pathways[J]. J R Soc Interface,2011,8(58):641-9.
[11] Liu N,Liu JT,Ji YY,et al. C-reactive protein triggers inflammatory responses partly via TLR4/IRF3/NF-κB signaling pathway in rat vascular smooth muscle cells[J]. Life Sci,2010,87(11-12):367-74.
[12] Cristofaro P,Opal SM. Role of Toll-ike receptors in infection and immunity: clinical implications[J]. Drugs,2006,66(1):15-29.
[13] Gogo PB Jr,Schneider DJ,Watkins MW,et a1. Systemic inflammation after drug-eluting stent placement[J]. Thromb Thrombolysis,2005,19 (2):87-92.
[14] KarinM. Inflammation-activated protein kinases as trgets for drug development[J]. Proc Am Thorac Soc,2005,2(4):386-90.
[15] Akira S,Hemmi H. Recognition of pathogen-associated molecular patterns by TLR family[J]. Immunol Let,2003,85(2):85-95.
[16] 司徒镇强,吴军正. 细胞培养[M]. 世界图书出版公司,1996:186-8.
[17] 门佳宝,潘雅琪,张克,等. 茶多酚对内毒素抑制人牙周膜成纤维细胞增殖的影响[J]. 中国医药,2013,8(9):1317-9.
[18] 江清林,张天英,李竹,等. 黄芪甲苷对大鼠海马源神经干细胞体外增殖的影响[J]. 中国医药,2013,8(2):179-81.
本文编辑:姚雪莉
Influence of lipopolysaccharide on growth of in vitro human coronary artery smooth muscle cells: an investigation on establishing in-stent restenosis inflammatory cell model
LI Hong-Mei*, WANG Xian.*Dongzhimen Hospital, Beijing University of Chinese Medicine, Beijing 100700, China.
WANG Xian, E-mail: wx650515@163.com
Objective To investigate the influence of lipopolysaccharide (LPS) in different doses on growth of in vitro human coronary artery smooth muscle cells (HCASMC) at different times, analyze non-toxic concentration range of LPS to HCASMC, and provide test data for establishing HCASMC inflammation activation model in studies related to restenosis after interventional therapy. Methods HCASMC was cultured in vitro for 3-5 generations, and seeded onto 96-well plates. The influences of LPS in different doses (0 μg/mL, 0.01 μg/mL, 0.1 μg/mL, 0.5 μg/ mL, 1 μg/mL, 5 μg/mL, 10 μg/mL and 100 μg/mL) on viability of HCASMC at different time points (24 h,46 h,72 h) were detected by using MTT assay. The value A was detected by using ELISA at point of 492 nm, and cell viability=(value A of test group- value A of zero hole)/value A of control group. Results When LPS dose was lower than 100 μg/mL and interventional time was shorter than 48 h, there was no cytotoxicity observed to HCASMC and there was promotion effect on proliferation. When interventional time was longer than 48 h, there was significant cytotoxicity observed and viability of HCASMC would decrease as LPS dose increased. After intervention for 72 h,LPS had promotion effect on proliferation in doses from 0 μg/mL to 0.01 μg/mL, and mild inhibitory effect in doses from 0.1 μg/mL to 0.5 μg/mL but cytotoxicity was not significant. The toxic reaction gradually appeared when LPS dose was from 1 μg/mL to 100 μg/mL, and viability of HCASMC decreased as LPS dose increased. When LPS doses were the same, viability of HCASMC gradually decreased as interventional time was prolonged, and the longer the interventional time was, the more significant the decrease of HCASMC was. Conclusion LPS had no significant cytotoxicity when its dose is 0.1 μg/mL, and when its dose is 0.01 μg/mL, the proliferation of HCASMC will be more significant after intervention for 24 h, which can be taken as the best condition for establishing HCASMC inflammation activation model.
Lipopolysaccharide; Human coronary artery smooth muscle cells; Cell viability; Cytotoxicity
R543.3
A
1674-4055(2016)01-0029-05
国家自然科学基金面上项目(81273913);北京中医药大学重点学科开放课题(2013-ZDXKKF-27)
1100700 北京,北京中医药大学东直门医院;2100700北京,北京中医药大学心血管病研究所
10.3969/j.issn.1674-4055.2016.01.07
王显,E-mail:wx650515@163.com
