补喂来曲唑对速步马运动性能、血浆抗氧化指标与激素水平及体重的影响
2016-08-18李晓斌邓海峰杨开伦
马 军 李晓斌 邓海峰 赵 芳 杨开伦
(新疆农业大学动物科学学院,新疆肉乳用草食动物营养重点实验室,乌鲁木齐830052)
补喂来曲唑对速步马运动性能、血浆抗氧化指标与激素水平及体重的影响
马军李晓斌邓海峰赵芳杨开伦*
(新疆农业大学动物科学学院,新疆肉乳用草食动物营养重点实验室,乌鲁木齐830052)
来曲唑;速步马;运动性能;抗氧化指标;激素;体重
来曲唑(letrozole,LE)是人工合成的非甾体高效选择性苄三唑类衍生物[1],属于非甾体芳香化酶抑制剂,可通过与亚铁血红蛋白中的铁原子结合,同内源性底物竞争芳香化酶的活性位点,可逆地抑制该酶的活性,从而选择性抑制雌激素的生物合成,有效地阻断雄烯二酮(AD)及睾酮(T)向雌激素的转化[2],从而间接提高肌肉组织中雄激素水平,改善机体肌肉原细胞的发育[3],促进肌肉的生长和力量的增加。研究证明,补喂来曲唑能够提高机体中雄激素水平和体重,较高的雄激素水平对运动能力的提高与维持也有积极的作用[4]。白双勇等[5]给肥胖男性少弱精症的治疗中喂服来曲唑2.5 mg/d,3个月后血浆T水平显著高于对照组。赵华等[6]以雄性成熟SD大鼠为试验动物进行试验,结果表明双氢睾酮可促进骨骼肌的肥大,使肌肉横断面、肌肉湿重和主要组织相容性复合体(MHC)含量显著增加。刘艳丽[7]研究表明,给大鼠每天灌胃来曲唑1 mg/kg BW,试验组体重比对照组高出32.69%。研究表明,长期运动训练会导致运动马体内T水平下降,低T水平减少机体的同化作用而造成肌肉量减少,使运动训练效果下降[8]。伊犁马是我国优秀的运动马品种,但部分处于运动训练状态的伊犁马体重存在负增长情况,特别是在速步训练过程中伊犁马存在易疲劳、运动持续性差、运动后恢复慢等问题,严重制约了伊犁马运动性能的提高。因此,本试验根据来曲唑的生物学作用,对速步训练的伊犁马补喂来曲唑,探究其对速步马运动性能、血浆抗氧化指标和激素水平及体重的影响,为进一步提高速步马的运动性能提供参考依据。
1 材料与方法
1.1试验时间及地点
本试验于2014年9月6日至2014年10月9日在新疆伊犁哈萨克自治州昭苏马场进行。
1.2试验动物选择及试验设计
本试验选取年龄、体重接近[平均年龄为2.5岁、平均体重为(398.16±25.34) kg],经过良好速步训练的伊犁马公马10匹,随机分为2组,分别为对照组和试验组,每组5匹。所有马匹每天饲喂混合牧草(苜蓿干草∶山草=1∶1)10 kg/匹、颗粒精料3 kg/匹,在此基础上试验组马匹每天每匹补喂来曲唑片剂2片(每片片剂含来曲唑2.5 mg,购自江苏恒瑞医药股份有限公司),进行30 d的补喂试验和训练试验。
1.3饲养管理
试验期间所有马匹单厩饲养管理,采用先粗后精的饲喂方法。每天每匹马饲喂混合牧草(苜蓿干草∶山草=1∶1)10 kg、颗粒精料3 kg。10 kg混合牧草于07:00、13:00、20:00分别饲喂3、4、3 kg,3 kg颗粒精料平均分为2份,分别于07:00及20:00饲喂,于07:00将2片来曲唑片剂加入颗粒精料中一同饲喂给试验组马匹。试验期间所有马匹自由饮水,待饲粮采食完后,将马匹牵入活动场,让其自由活动。马厩每天按时打扫,清除粪便和垫料,并换干燥柔软的垫料。
本试验使用的饲粮组成及营养水平见表1。
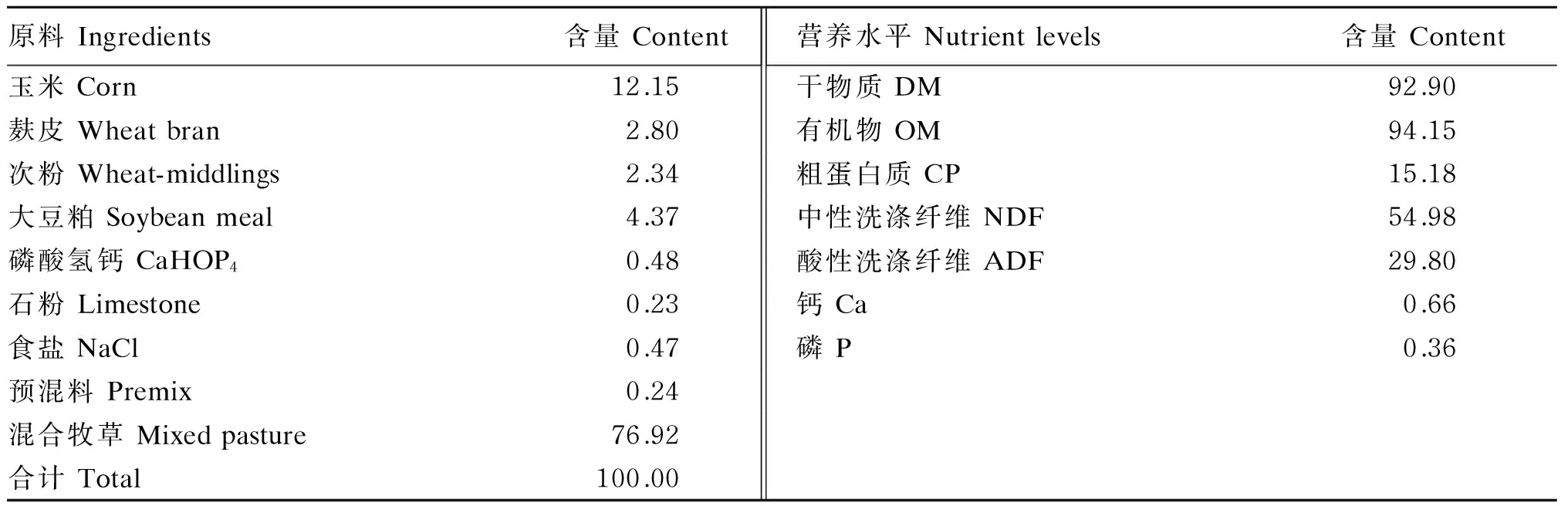
表1 饲粮组成及营养水平(干物质基础)
预混料为每千克饲粮提供The premix provided the following per kg of the diet:VA 480 IU,VB1816.32 mg,VB2333.2 mg,VB648.96 mg,VD 70.4 IU,VE 21 333.36 IU,泛酸 pantothenic acid 20.46 mg,烟酰胺 nicotinamide 484.85 mg,Cu (as copper sulfate) 10.58 mg,Fe (as ferrous sulfate) 35.56 mg,Mn (as manganese sulfate) 33.54 mg,Zn (as zinc sulfate) 30.92 mg,I (as potassium iodide) 2.46 mg,Se ( as sodium selenite) 5.93 mg,Co (as cobalt chloride) 1.11 mg。
1.4训练场地
试验马匹在昭苏马场西域赛马场进行训练。训练场地为西域赛马场赛道。赛道由椭圆形沙道和草道组成。沙道由细沙构成,深度40 cm,底部为土基,道宽21 m,周长为1 000 m;草道由天然的牧草形成,宽21 m,周长为1 100 m。
1.5训练方案
试验马匹每天训练时间为11:30—13:00,11:30将试验马匹备鞍后,由骑手牵至训练场首先在草道上慢走1圈,随后进入沙道,逐渐加快速度慢跑1圈,使马匹充分活动,随后进入正式训练,训练方案见表2。
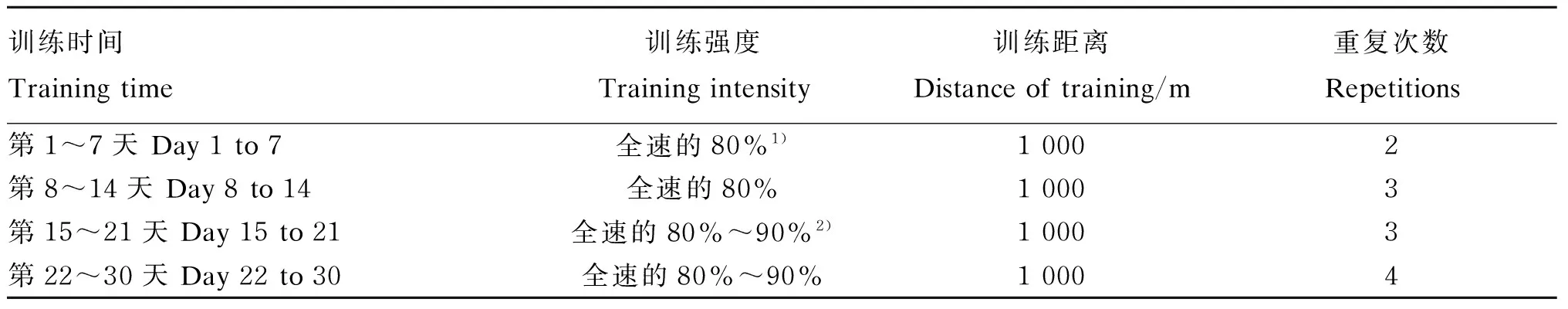
表2 训练方案
1)全速的80%是指骑手控制试验马匹进行1 000 m速步赛时的用时为200 s。80% of full speed mean tortters controlled by riders conduct 1 000 m trot training race using 200 s.
2)全速的80%~90%是指骑手控制试验马匹进行1 000 m速步赛时的用时为175 s。80% to 90% of full speed mean tortters controlled by riders conduct 1 000 m trot training race using 175 s.
1.6数据获得及样品采集
1.6.1体重数据的获得
分别在试验开始前(第0天)、第30天早晨将空腹马匹驱赶至地磅上,称取试验马匹体重。
1.6.2速步赛成绩的获得
分别在试验第0天、第30天进行1 000 m速步赛,并使用秒表测定1 000 m速步赛用时,计算1 000 m速步赛平均速度。
1.6.3血样的采集
分别于试验的第0天、第10天、第20天、第30天早晨空腹颈静脉采集血样5 mL至用肝素钠抗凝采血管中,1 500×g离心15 min,分离制得血浆并于-20 ℃冷冻保存备用;在试验的第30天,分别于速步赛赛前1 h、赛后即刻、赛后20 min和赛后2 h颈静脉采集血样分别至普通采血管和肝素钠抗凝采血管中,将肝素钠抗凝采血管采集的血样1 500×g离心15 min,分离制得血浆并于-20 ℃冷冻保存备用,普通采血管中的全血立即用于测定血液酸碱度相关指标。
1.7测定指标及方法
血浆中T、AD、雌酮(E1)、雌二醇(E2)、雌三醇(E3)、促性腺激素释放激素(GnRH)、卵泡刺激素(FSH)、促黄体生成激素(LH)水平由北京华英生物技术研究所检测。
血浆中谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活力,总抗氧化能力(T-AOC)及尿酸(UA)、丙二醛(MDA)含量由购自于北京华英生物技术研究所的试剂盒测定,具体测定方法参照试剂盒说明进行操作。
1.8数据统计与分析
数据采用Excel 2010进行初步整理,试验结果以平均值±标准差(mean±SD)表示。用SPSS 18.0软件进行统计学分析,并进行独立样本t检验。
2 结果与分析
2.1补喂来曲唑对速步马1 000 m速步赛成绩的影响
由表3可知,补喂来曲唑30 d后,试验组马匹的平均速度快于对照组,但差异不显著(P>0.05)。
2.2补喂来曲唑对速步马1 000 m速步赛赛前、赛后血浆抗氧化指标的影响
由表4可知,赛前1 h时,对照组、试验组马匹血浆中CAT、GSH-Px、SOD活力,T-AOC及UA、MDA含量差异不显著(P>0.05);赛后即刻,试验组马匹血浆中CAT、SOD活力,UA含量及T-AOC均高于对照组(P>0.05),而MDA含量则低于对照组(P>0.05);赛后20 min时,试验组马匹血浆中GSH-Px、SOD活力,UA含量及T-AOC均高于对照组(P>0.05),而MDA含量低于对照组(P>0.05);赛后2 h时,试验组马匹血浆中CAT、SOD活力及UA含量均高于对照组(P>0.05),同时试验组马匹血浆中GSH-Px活力、T-AOC分别极显著(P<0.01)和显著(P<0.05)高于对照组,而MDA含量则显著低于对照组(P<0.05)。

表3 补喂来曲唑对速步马1 000 m速步赛成绩的影响
同一项目同列数据肩标不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),相同字母或无字母表示差异不显著(P>0.05)。下表同。
In the same column, values of the same item with different capital letter superscripts mean extremely significant difference (P<0.01), and with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
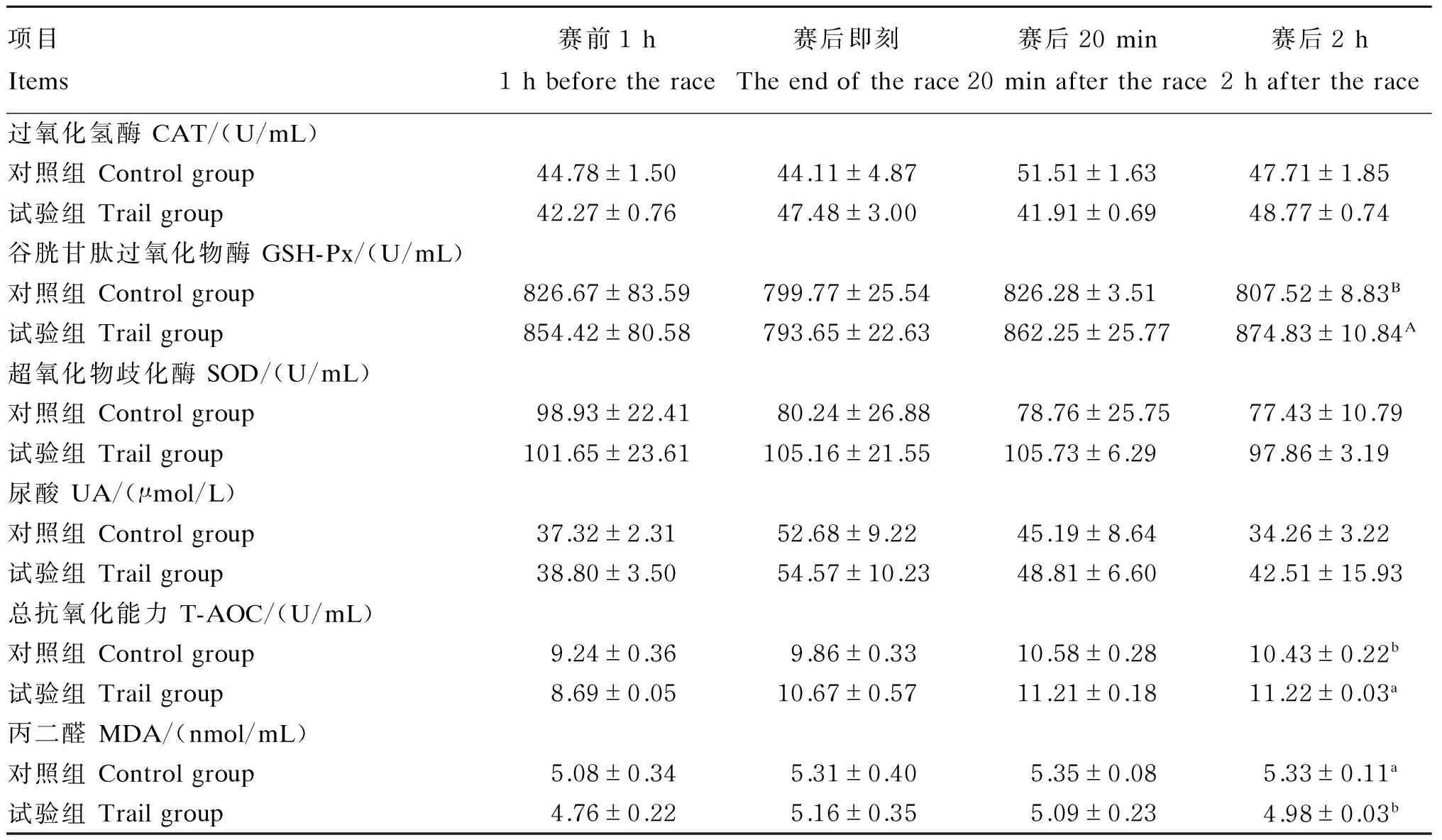
表4 补喂来曲唑对速步马1 000 m速步赛赛前、赛后血浆抗氧化指标的影响
2.3补喂来曲唑对速步马1 000 m速步赛前、赛后血液酸碱度相关指标的影响
2.4补喂来曲唑对速步马血浆激素水平的影响
由表6可知,试验第10天、第20天、第30天时试验组马匹血浆中T、AD水平均高于对照组,而E1、E2水平均低于对照组,但差异均不显著(P>0.05)。试验第10天、第20天、第30天时试验组马匹血浆中GnRH、FSH、LH、E3水平与对照组相比均差异不显著(P>0.05)。

表5 补喂来曲唑对速步马1 000 m速步赛赛前、赛后血液酸碱度相关指标的影响
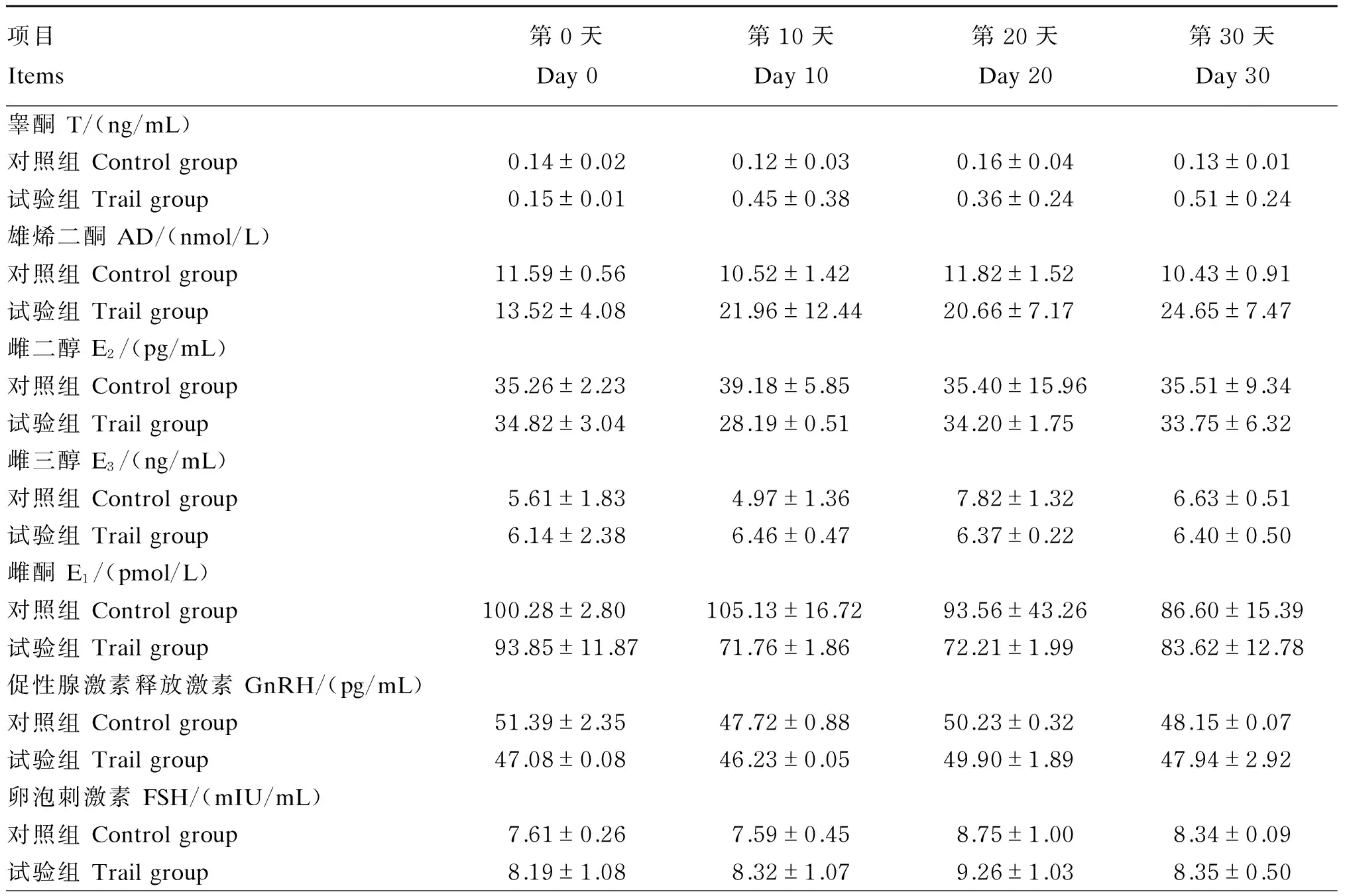
表6 补喂来曲唑对速步马血浆激素水平的影响
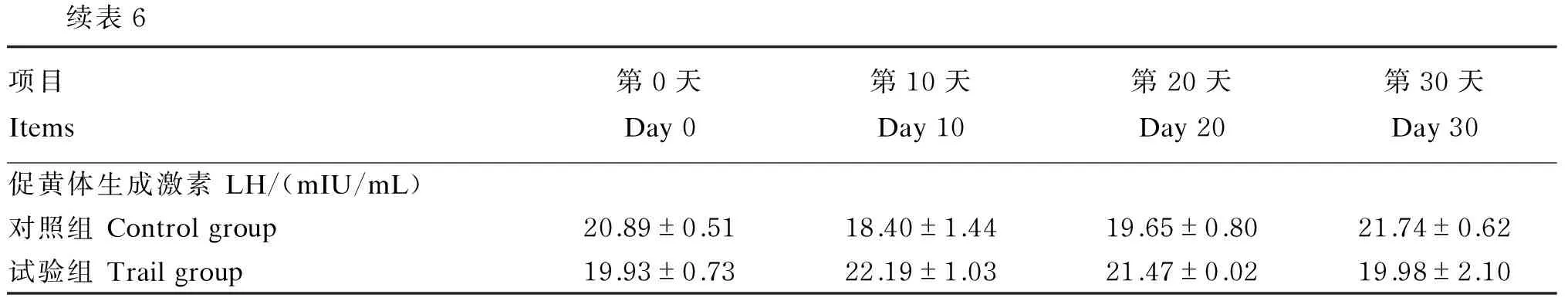
续表6项目Items第0天Day0第10天Day10第20天Day20第30天Day30促黄体生成激素LH/(mIU/mL)对照组Controlgroup20.89±0.5118.40±1.4419.65±0.8021.74±0.62试验组Trailgroup19.93±0.7322.19±1.0321.47±0.0219.98±2.10
2.5补喂来曲唑对速步马体重的影响
由表7可知,试验组与对照组在试验期间体重均呈增加趋势,从增长率上来看试验组马匹比对照组马匹提高59.49%(P>0.05)。
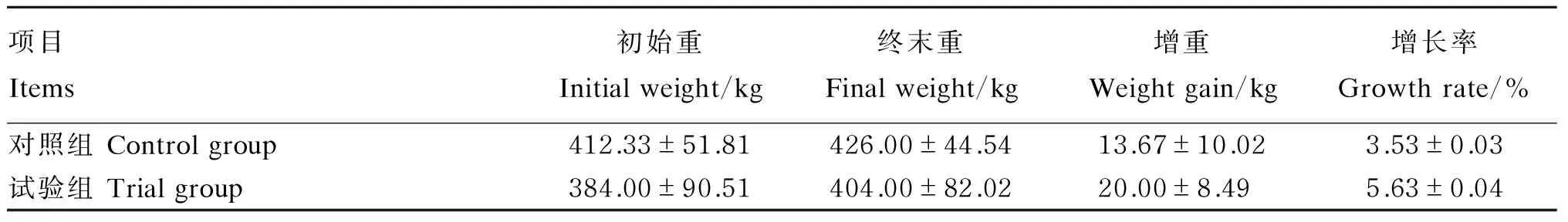
表7 补喂来曲唑对速步马体重的影响
3 讨 论
3.1补喂来曲唑对速步马1 000 m速步赛运动性能的影响
运动马的运动性能不仅与马的品种、训练方法(方案)、饲粮中的营养物质有关,机体内中肌肉的多少及肌肉力量的大小也是重要的影响因素。运动马肌肉做功能力的强弱是衡量运动性能的重要指标。因此,促进肌肉生长和增加肌肉力量是提高运动马运动性能的必要条件。研究表明,肌肉的形成及其力量的增加受到饲粮中蛋白质水平、训练强度[9]、机体内激素水平以及Na+、K+含量等因素的影响[10]。Griggs等[11]的研究表明,雄激素可刺激肌原纤维中新肌丝的形成,引起肌原纤维增大并分裂,从而促进蛋白质合成,使肌肉发达,力量增强,最终促进肌肉的生长、增大,并减少脂肪的积累。
本试验结果显示,补喂来曲唑30 d后可以提高试验组速步马1 000 m速步赛时的速度,这可能与来曲唑可调节速步马雄激素代谢有关。来曲唑可与亚铁血红蛋白中的铁原子结合,与内源性底物竞争芳香化酶的活性位点,可逆性的抑制芳香化酶的活性,从而选择性的抑制雌激素的生物合成,有效抑制体内雄激素向雌激素转化[12],使雄激素在机体内造成短暂的增加,雄激素的增加可进一步作用于肌原细胞,促进肌肉的生长和力量的增加。研究表明,长期运动训练会导致运动马体内睾酮水平下降,低睾酮水平减少机体的同化作用而造成肌肉量减少,使运动训练效果下降[8]。本试验的结果显示,补喂来曲唑可提高速步马血浆中T、AD水平,这对维持速步马比赛过程中体内雄激素水平、提高运动性能有一定的帮助。来曲唑作为一种芳香化酶抑制剂,在人体使用后会出现一些副作用,如头痛、潮热、恶心、骨痛和体重增加等[13],而目前关于来曲唑应用于动物所产生的副作用的报道较少,有待进一步研究。
3.2补喂来曲唑对速步马1 000 m速步赛赛前、赛后血浆抗氧化指标的影响
高强度的运动或长时间的耐力运动,会使运动马体内的血液分布发生变化,为了保证机体维持正常的运动能力,血液将流向运动强的器官,运动弱的器官可能出现暂时性缺血,缺血组织中辅酶Q脱离了电子传递链,发生了自动氧化,导致了氧自由基的产生。另外,脱离电子传递链的泛半醌自由基(QH·)也可以从邻近的多不饱和脂肪酸分子中夺取氢形成脂质自由基(LO·),引发脂质过氧化反应,导致产生大量的自由基,引起机体的抗氧化系统发生变化[14]。因此,在运动马的训练与比赛中消除自由基、提高机体的抗氧化能力是亟需解决的问题。研究证明,雄激素对机体氧化应激的消除有一定的作用[15]。任国庆等[16]研究了T对试验兔的抗氧化作用,发现T可以提高机体的抗氧化能力,降低血浆中MDA含量。马海田等[17]研究发现,给大鼠灌胃脱氢表雄酮能够降低血清和肝脏中MDA的含量,提高肝脏中SOD的活力。Keymel等[18]研究发现,接受雄激素去势治疗患者机体出现氧化应激失衡,推测雄激素是抑制氧化应激的重要物质。
在本试验中,补喂来曲唑可提高速步马1 000 m速步赛赛后血浆中CAT、SOD、GSH-Px活力,UA含量及T-AOC,降低血浆中MDA含量,可能是由于补喂的来曲唑提高了速步马血浆中T、AD水平,增加的T、AD在速步马体内发挥抗氧化的作用,使血浆中GSH-Px活力增加,T-AOC提高,同时抑制机体内的脂质过氧化,使MDA含量降低。由此表明,来曲唑可提高速步马体内抗氧化酶活力,清除自由基,提高速步马机体的抗氧化能力。因此,补喂来曲唑能够在提高速步马成绩的同时减少运动氧化应激,并对速步马运动后机体机能的快速恢复具有积极的作用。但由于试验条件的限制,本试验选用的试验动物数量较少,因此后期有必要对来曲唑可提高速步马运动性能、机体抗氧化能力这一试验结果进行大群验证。
3.3补喂来曲唑对速步马1 000 m速步赛赛前、赛后血液酸碱度相关指标的影响
3.4补喂来曲唑对速步马血浆激素水平的影响
动物体内激素的调节是一个复杂的过程。在激素的调节过程中,GnRH经垂体门脉系统到达垂体前叶,促进FSH、LH分泌。LH、FSH则可刺激卵泡膜细胞和睾丸间质细胞分泌性激素,FSH能够促进粒层细胞芳香化酶的活化,使AD和T向E1和E2转化[4],同时过量生成的性激素对LH、FSH和GnRH的分泌又有负反馈机制,生成的T在芳香化酶的催化下转化成E2,使血液中雌激素水平升高[22]。当体内E2、T水平升高后又抑制GnRH释放,从而减少LH、FSH的分泌量,最终减少E2、T的分泌量,使机体内性激素水平达到一个平衡状态。
来曲唑能够与亚铁血红蛋白中的铁原子结合,与内源性底物竞争芳香化酶的活性位点从而可逆性的抑制该酶的活性,选择性的抑制雌激素的生物合成,从而有效抑制体内雄激素向雌激素转化,并在体内短暂增加雄激素的水平[2]。刘芸等[23]报道卵巢低反应者口服2.5 mg/d来曲唑能够显著提高患者血浆内T水平。陶月红等[24]给青春期男童补喂来曲唑2.5 mg/d,结果发现试验组血浆中T水平变化率相对于服用之前增加61.6%,且与对照组相比增长有显著性差异。在本试验中,补喂来曲唑使试验马匹血浆中T、AD水平增加,同时血浆中E1、E2、E3水平有降低的趋势;此外,补喂来曲唑并未影响马匹血浆中的GnRH、FSH、LH水平,进一步证实来曲唑的作用发生在外周组织,并没有干扰下丘脑-垂体轴。
3.5补喂来曲唑对速步马体重的影响
雄激素是体内重要的合成类激素,在动物机体内除了具有激素样作用之外,还可促进机体内蛋白质的合成,调节肌肉的生长和骨骼的增长[3]。T和AD是机体内主要的雄激素,可促进机体内的合成代谢,具有刺激组织摄取氨基酸、促进核酸与蛋白质合成、促进肌纤维和骨骼生长的作用[7]。来曲唑可通过抑制芳香化酶活性,在机体内部阻止雄激素向雌激素转化,其中主要是抑制T和AD向雌激素转化,从而使得雄激素在体内短暂积聚,蓄积的雄激素又可刺激胰岛素样生长因子Ⅰ[3],使胰岛素样生长因子Ⅰ通过调节RNA和DNA合成来促进不同类型细胞的增殖和分化,从而促进细胞的有丝分裂,最终促进蛋白质的合成,抑制蛋白质的降解,增加机体蛋白质的沉积[9]。刘艳丽[7]研究表明,给大鼠每天灌胃来曲唑1 mg/kg BW,试验组体重比对照组高出32.69%。王芳等[25]研究也发现,给大鼠补喂硫酸脱氢表雄酮6 mg/d后,大鼠体重明显增加。
在本试验中,补喂来曲唑可增加速步马体重。结合激素对蛋白质合成的调节作用来看,试验组体重的增加可能与机体内雄激素T、AD水平的升高有直接关系。来曲唑被速步马吸收后经血液循环参与到机体代谢中,通过抑制雄激素向雌激素转化,从而增加了机体内T、AD水平,T、AD水平的增加可促进机体内的合成代谢,刺激组织摄取氨基酸、促进核酸与蛋白质合成、促进肌纤维和骨骼生长,从而导致速步马体重的增加。
4 结 论
给速步马补喂5 mg/(匹·d)来曲唑可缩短1 000 m速步赛比赛用时,提高机体的抗氧化能力和酸碱缓冲能力,并使血浆中T和AD水平上升,同时增加速步马的体重。
[1]PROUS J,GRAUL J.Letrozole[J].Drugs of the Future,1994,19(4):335-337.
[2]PAUL E G,JAMES N I,SLIAVANA R,et al.A randomized trial of letrozole in postmenopausal women after five years of tamoxifen therapy for early-stage breast cancer[J].The New England Journal of Medicine,2003,349(19):1793-1802.
[3]WEIL S J,VENDOLA K,ZOU J,et al.Androgen and follicle-stimu-lating hormone interactions in primate follicle development[J].The Journal of Clinical Endocrinology and Metabolism,1999,83(7):2951-2956.
[4]MICHEL G,BAULIEU E.Androgen receptor in rat skeletal muscle:characterization and physiological variations[J].Endocrinology,1980,107(6):2088-2098.
[5]白双勇,王剑松,赵庆华.重组人生长激素联合来曲唑治疗肥胖男性少弱精子症疗效分析[J].中华男科学杂志,2015,03:280-282.
[6]赵华,曾凡星.雄性素对运动骨骼肌MAPK和mTOR信号的作用研究[J].北京体育大学学报,2012,35(11):46-53.
[7]刘艳丽.来曲唑法和脱氢表雄酮法诱导PCOS大鼠模型的比较研究[D].硕士学位论文.郑州:郑州大学,2011.
[8]RICHARDSON A B,JOBE F W,COLLINS H R.The shoulder in competitive swimming[J].American Journal of Sports Medicine,1980,8(3):159-163.
[9]王宁,王建文,孟军,等.间歇训练法对速步马血液生化指标影响的研究[J].新疆农业科学,2014,51(12):2308-2314.
[10]姜红润,王留东.决定和影响肌肉力量的因素[J].河北体育学院学报,2003,17(3):54-57.
[11]GRIGGS R C,KINGSTON W,JOZEFOWICZ R F,et al.Effect of testosterone on muscle mass and muscle protein synthesis[J].Journal of Applied Physiology,1989,66(1):498-503.
[12]涂晓贤.不同剂量来曲唑促排卵效果的系统评价[D].硕士学位论文.福州:福建医科大学,2013.
[13]HOLZER H,CASPER R,TULANDI A.A new era in ovulation induction[J].Fertility and Sterility,2006,85(2):277-784.
[14]SOUZA-SILVA A A,MOREIRA E,DE M D,et al. High intensity interval training in the heat enhances exercise-induced lipid peroxidation,but prevents protein oxidation in physically active men[J].Temperature,2015,3(1)167-175.
[15]李霖.雄激素受体在波动性高糖致人脐静脉内皮细胞损伤中的作用及其机制研究[D].硕士学位论文.杭州:浙江大学,2012.
[16]任国庆,孙广辉.睾酮对实验兔血脂和抗氧化作用的影响[J].江苏医药,2001,27(10):785.
[17]马海田,田朝阳,邹思湘,等.脱氮表雄酮对大鼠脂类代谢和抗氧化作用的影响[J].中国应用生理学杂志,2009,25(1):95-96.
[18]KEYMEL S,KALLKA C,RASSAF T,et al.Impaired endothelial progenitor cell function predicts age-dependent carotid intimal thickening[J].Archiv Für Kreislaufforschung,2008,103(6):582-586.
[19]MARIK P E.Handbook of evidence-based critical care[M].Switzerland:Springer International Publishing,2015:329-347.
[20]孟军,刘志安,文立,等.伊犁马1000 m速步训练赛各阶段静脉血中血气指标变化研究[J].中国畜牧兽医,2014,11:139-143.
[21]何伟,王绵珍,王治.两种强度运动后的血气指标变化及其与血浆K+浓度和pH值的关系[J].四川大学学报:医学版,2005,36(5):747-748.
[22]ROSA S,ADELE C,ROCCO M,et al.Insulin-like growth factor-Ⅰ,regulating aromatase expression through steroidogenic factor 1,supports estrogen-dependent tumor Leydig cell proliferation.[J].Cancer Research,2007,67(17):8368-8377.
[23]刘芸,邢福祺,何凌云,等.芳香化酶抑制剂在卵巢低反应者超促排卵中的作用[J].南方医科大学学报,2009,03:559-561.
[24]陶月红,经纬,沈涛.来曲唑治疗男童青春早期乳房发育症的疗效分析[J].中华临床医师杂志,2013,20:9174-9177.
[25]王芳,杨文静,李英勇.孕期高雄激素环境对SD大鼠仔代体重及OGTT的影响[J].现代妇产科进展,2009,11:813-815.
(责任编辑菅景颖)
, professor, E-mail: yangkailun2002@aliyun.com
Effects of Supplemental Feeding Letrozole on Athletic Performance,Plasma Antioxidant Indices and Hormone Levels, and Body Weight of Trotters
MA JunLI XiaobinDENG HaifengZHAO FangYANG Kailun*
(Xinjiang Key Laboratory of Meat & Milk Production Herbivore Nutrition, College of Animal Science,Xinjiang Agricultural University, Urumqi 830052, China)
letrozole; trotters; athletic performance; antioxidant indices; hormone; body weight
10.3969/j.issn.1006-267x.2016.08.036
2016-03-09
新疆维吾尔自治区重大科技专项(201130101);新疆维吾尔自治区研究生科研创新项目(XJGRI2015095)
马军(1990—),男,新疆伊犁人,硕士研究生,研究方向为马匹运动学。E-mail: Jun_works@163.com
杨开伦,教授,博士生导师,E-mail: yangkailun2002@aliyun.com
S816
A
1006-267X(2016)08-2630-09
