一株富油微藻的鉴定及其脂肪酸成分分析
2016-08-16薛智权吕蕊李宏吕建华
薛智权++吕蕊++李宏++吕建华
摘 要:富油微藻在生物柴油应用方面具有良好的应用前景,分析其脂肪酸的含量和成分对其有效利用具有理论指导意义。采用扩增18S rRNA片段对本试验所分离得到的一株富油微藻进行分子生物学鉴定,并分别用50%,65%和80%三种不同浓度的甲醇、乙醇和丙酮溶液作为溶剂,采用索式提取法抽提藻油,然后采用气相色谱-质谱联用(GC-MS)分析藻油中脂肪酸的含量及成分,并确定最佳的提取方案。结果表明,18S rRNA序列显示,该微藻属于角毛藻Chaetoceros dichaeta。有机溶剂抽提藻油时,50%甲醇的抽提效果最佳,提取效果随甲醇浓度增加而降低。乙醇的提取效果跟甲醇类似,而丙酮的提取效果随浓度提高有所改善,但总体效率不高。在最佳提取条件下,藻油产率达到了451.6 mg·g-1干藻。该角毛藻油中脂肪酸主要为饱和的14碳和16碳长链脂肪酸,含量分别为23.96%和68.58%。研究认为:该微藻属于角毛藻类,甲醇为比较适合的提取该微藻藻油的溶剂;该角毛藻富含长链脂肪酸,在生物柴油等绿色能源行业具有良好的应用价值。
关键词:角毛藻;索式提取; 藻油;气质联用色谱分析(GC-MS)
中图分类号:S968.4 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.08.001
Abstract: In order to analyze the content and composition of fatty acids in an oil-riching microalgae with good application prospect, the 18S rRNA gene of the isolated oil-rich microalgae was amplified for molecular biology identification. 50%, 65% and 80% of methanol, ethanol and acetone solution, respectively, was used as solvent for soxhlet extraction algal oil. Gas chromatography - mass spectrometry (GC-MS) was combined to analysis the content and composition of fatty acids in algae oil, and to determine the best extraction scheme. The results showed that 18S rRNA sequences showed that the microalgae belonged to Chaetoceros dichaeta. When the algae oil was extracted with organic solvent, the extraction efficiency of 50% methanol was the best, and the extraction efficiency decreased with the increase of methanol concentration. The extraction effect of ethanol was similar to that of methanol, and the extraction effect of acetone was improved with the increase of concentration, but the overall efficiency was not high. Under the optimum extraction conditions, the algae oil yield reached 451.6 mg·g-1 dry weight. The main fatty acids were 14 and 16 carbon saturated long chain fatty acids, with the ratio of 23.96% and 68.58%, respectively. The microalgae belongs to Chaetoceros dichaeta. Methanol is more suitable for the extraction of the microalgae oil. This microalgae has good application value in biodiesel because of its rich in long chain fatty acids.
Key words:Chaetoceros; soxhlet extraction; algae oil; gas chromatography-mass spectrometry (GC-MS)
近年来,随着化石燃料日益减少,可再生的生物柴油备受关注。生物柴油的基本成分为脂肪酸酯,主要是通过转酯反应将甘油三酯或游离脂肪酸跟低级醇类反应而得。早期用于合成生物柴油的原料为大豆、油菜、葵花籽、玉米等油料作物[1-4],但是这些可食用油成本太高。后来也有采用废弃食用油如动物油脂或烹饪后的植物油为原料的[5-9],然而受限于供应量,不能大规模应用。目前,各国普遍采用棕榈树、麻风树、可可树、棉籽、亚麻荠等非食用油料作物[10-15],我国境内富含油脂的黄连木[16]、冠果[17]、毛梾树[18]等大型木本作物也广受关注。然而,木本作物生长缓慢,生物转化效率低,导致目前生物柴油的价格居高不下,难以普及应用。因此,含油量高、生物量大、易于培养且生物转化效率高的富油微藻成为研究者的新宠,也被看成是最有可能替代化石燃料的可再生油料资源,目前在藻类种质资源发掘、培养条件优化、成熟藻回收及生物柴油转化等环节均成为了研究热点[19-21]。
微藻为单细胞的浮游藻类,能在淡水或咸水里生长,具有良好的抗逆性,目前通常在边际土上培养,不会占用产粮耕地。微藻的生长非常迅速,每天可提升一倍的生物量,在指数生长期时的倍增时间会缩短到不到4 h,单位面积下微藻年产量比目前产量最高的油料作物还要高7~23倍[22-23]。早期人们关注微藻是因为多种微藻含有大量的多不饱和脂肪酸,包括二十二碳六烯酸(Docosahexaenoic acid,DHA)和二十碳五烯酸(Eicosapentaenoic acid,EPA),均具有极高的经济价值[24-25]。后来发现有些微藻所合成的长链饱和脂肪酸占据绝大比例,为合成生物柴油的绝佳原料,在生物能源方面也具有良好的应用前景[26]。
本试验组在前期的工作中,从深圳湾红树林的沉积土壤中分离得到了一株生长迅速的富油微藻SXAU-SK-M04,经鉴定为角毛藻Chaetoceros sp.。本试验拟采用不同的有机溶剂(甲醇、乙醇和丙酮),用索式提取的方法提取其中的油脂,然后采用气相色谱-质谱联用法(GC-MS)检测藻油中脂肪酸的成分及含量,测定该角毛藻所含脂肪酸的种类及含量,并确定适宜的提取方法,可为阐明该品种角毛藻的经济价值,进一步大规模培养和应用奠定理论基础。
1 材料和方法
1.1 材 料
1.1.1 藻 种 富油微藻藻种,由本研究组前期从深圳湾红树林海水中分离培养获得,保存于本实验室。
1.1.2 培养基组成 海水培养基:葡萄糖10 g,蛋白胨1.5 g,酵母提取物0.5 g,海水盐精15个,用蒸馏水溶解并定容到1 000 mL,115 ℃灭菌20 min。
1.1.3 扩增引物 利用真核生物18S rRNA通用引物18SF:5-AACCTGGTTGATCCTGCCAGTA-3和18SR:5-CCTTGTTACGACTTCACCTTCCTCT-3,由北京华大基因研究中心合成。
1.1.4 主要试剂 甲醇、乙醇、丙酮、异丙醇均为国产分析纯,土壤微生物基因组提取试剂盒和2×Pfu MasterMix PCR反应试剂盒均购自北京康为世纪生物技术有限公司。
1.2 方 法
1.2.1 分子鉴定 取保存的藻种,接种于5 mL海水培养基中,28 ℃,180 r·min-1振荡培养3 d,吸取1 mL菌液,按照DNA提取试剂盒的说明操作。所提取的基因组DNA溶解于30 μL蒸馏水中,取3 μL用1%琼脂糖凝胶电泳鉴定所提取基因组DNA的浓度和完整性。然后用基因组DNA为模板,18SF和18SR为引物进行PCR扩增。50 μL反应体系含有2×Pfu MasterMix 25 μL,基因组DNA 2 μL,18SF 1 μL,18SR 1 μL,灭菌双蒸水21 μL。PCR反应条件为94 ℃预变性4 min;94 ℃ 45 s,55 ℃ 30 s,72 ℃ 1 min,共30个循环,接着72 ℃延伸10 min。取PCR产物3 μL用1%琼脂糖电泳鉴定后,直接将PCR产物送到华大基因研究中心进行测序分析。将返回的测序结果登入GenBank进行比对,以确定微藻的种属。
1.2.2 微藻大量扩增 将前面的微藻发酵液按照5%接种量接种于大体积培养瓶中进行放大培养,总体积达到1 L。28 ℃ 180 r·min-1振荡培养7 d,将发酵液6 000 r·min-1离心10 min,收集藻泥,用蒸馏水清洗两次,然后将所得藻泥置于65 ℃烤箱中干燥至恒质量。
1.2.3 藻油提取 准确称取干藻粉5.00 g,用滤纸包好,放入索氏提取器中,分别用50%,65%,80%(V/V)的甲醇、乙醇和丙酮水溶液进行抽提,水浴加热的温度为60 ℃。直至回流的液体呈无色为止,每个样品抽提时间大约3 h。然后将提取液置于圆底烧瓶中,65 ℃旋转蒸发进行浓缩,待溶液体积到5 mL左右,收集浓缩液,用异丙醇稀释定容到50 mL。采用0.22 μm超滤膜过滤后,准备用于下一步试验。
1.2.4 藻油成分及含量检测 取1 mL过滤后的藻油,置于气相色谱样品管中,采用气相色谱-质谱联合分析仪(气相色谱仪为Trace1300,质谱仪为Trace ISQ,Thermo Fisher,USA)进行分析。色谱柱为DB-5ms毛细管柱(35 m×250 μm×0.25 μm),扫描荷质比范围为40~500。载气为He,流速1 mL·min-1,进样量1 μL;进样口温度280 ℃。升温条件为:初始温度70 ℃ 2 min,然后以10 ℃·min-1升温到220 ℃,接着以3 ℃·min-1升温到260 ℃,然后以10 ℃·min-1升温到280 ℃,保持5 min。以37种混合脂肪酸甲酯标准品(NU-CHEK-PREP,INC.,USA)为参照。通过比对标准样品并计算峰面积,确定各组分的含量。
2 结果与分析
2.1 微藻的鉴定
采用试剂盒提取基因组DNA和扩增微藻的18S rRNA片段,琼脂糖电泳结果见图1。图1-A为基因组DNA的电泳图,可以看出所提取的基因组DNA浓度和完整性均比较好,可用于进行基因片段的扩增。图1-B为18S rRNA片段扩增结果,可以看到有一条大约2 000 bp大小的DNA扩增片段,产物单一,纯度很好。
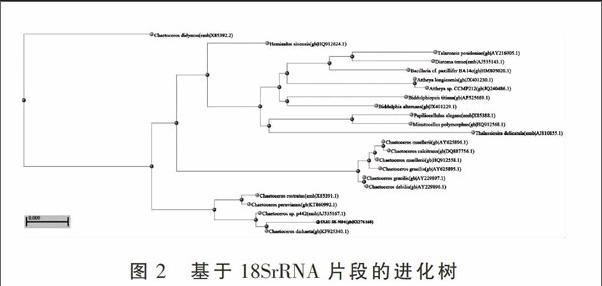
对PCR产物测序,得到一条长度为1 884 bp的序列结果。将该序列上传到GenBank,序列号为KX276168。在GenBank数据库进行比对,并选取近似的物种序列,构建Neighbor-Joining Tree进化树,结果见图2。
从进化树分析可知,该微藻跟Chaetoceros dichaeta的18S rRNA(GenBank ID:KF925340.1)有99%的相似性,故将该微藻命名为Chaetoceros dichaeta SXAU-SK-M04。
2.2 微藻大量培养
在配制的海水培养基中,按照5%接种量,28 ℃ 180 r·min-1振荡培养7 d,收集藻泥并烘干,1 L发酵液得到的干藻粉平均为12.8 g。在该培养条件下,该微藻的生物量日积累速度达到了1.8 g·L-1,远远高于文献报道的纤细角毛藻的0.86 g·L-1生物量和牟氏角毛藻的不到0.7 g·L-1 [27-29]。
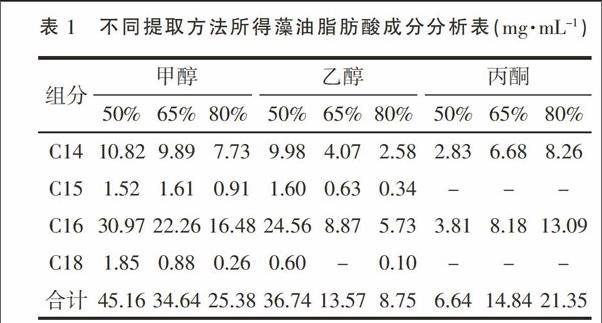
2.3 藻油成分及含量分析
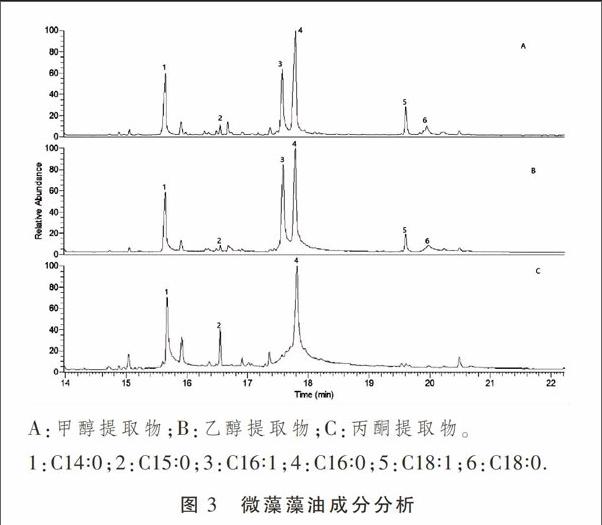
采用不同浓度的甲醇、乙醇和丙酮为溶剂,提取微藻藻油,然后经GC-MS分析,将质谱图跟脂肪酸甲酯标准品比较,确定藻油中所含脂肪酸的成分。3种溶剂提取的藻油气相图谱比较见图3。结果显示,藻油中脂肪酸种类主要为14~18个碳原子的长链脂肪酸,出峰时间集中在第15分钟到20分钟之间。以37中脂肪酸甲酯混合标准品为参照,并经质谱库比对,确定图中的峰1~6分别为C14∶0、C15∶0、C16∶1、C16∶0、C18∶1和C18∶0。
以标准品的峰面积为参照,计算藻油各成分的含量,结果见表1。
结合图3和表1 的数据,很容易看出,甲醇和乙醇的提取物脂肪酸成分很类似,提取效果均是随醇浓度增加而降低,其中以50%甲醇溶液所提取的藻油量最大,达到了45.16 mg·mL-1,折合藻油含量为451.6 mg·g-1干藻粉。而采用丙酮溶液提取的效果则差了很多,虽然随丙酮浓度增加藻油产率有所增加,但远远不能跟甲醇的提取效果相比较。丙酮提取物中18个碳原子的脂肪酸含量很少,基本上不能检出,而更短链的脂肪酸含量也显著低于甲醇和乙醇提取液中的含量。分析其原因可能是醇类的极性要比酮类大,比较容易进入到细胞内部,导致微藻细胞内的脂类释放量更加完全。根据相同的理由,推断甲醇的提取效果会好于乙醇,跟试验结果相吻合。综合比较,50%甲醇溶液的提取效果为最佳。
通过对该角毛藻的藻油成分分析可知,藻油中主要成分为C14∶0和C16两大类中短链脂肪酸,含量分别占到了总量的23.96%和68.58%。这种脂肪酸构成比,使这类藻油非常适合于生产生物柴油。干粉中含油量45%虽然不是最高,考虑到该种角毛藻生长迅速,培养条件适应性广,且培养成本低廉,提示该种微藻在生物柴油生产方面具有非常重要的应用前景。
3 结 论
本研究采用18S rRNA片段对前期分离得到的富油微藻进行分子鉴定,确定其为Chaetoceros dichaeta SXAU-SK-M04。通过有机溶剂索氏提取角毛藻藻油,并采用GC-MS分析所得藻油的含量及成分,一方面确定了最佳提取试剂为50%甲醇溶液,另一方面也明确了该种角毛藻中脂肪酸的构成比,为进一步大规模利用藻油提供了理论依据。
参考文献:
[1]KOUZU M,HIDAKA J S. Transesterification of vegetable oil into biodiesel catalyzed by CaO: A review[J].Fuel,2012,93(1):1-12.
[2]WANG J X,CHEN K T,HUANG S T, et al. Biodiesel production from soybean oil catalyzed by Li2CO3[J].Journal of the American Oil Chemists' Society,2012,89(9):1619-1625.
[3]UMDU E S,SEKER E.Transesterification of sunflower oil on single step sol-gel made Al2O3 supported CaO catalysts: effect of basic strength and basicity on turnover frequency[J].Bioresource Technology,2012,106:178-181.
[4]成拴狮,杜春芳,李建勋.对发展山西省油菜生产的思考[J].山西农业科学,2009,37(5):11-13.
[5]NOSHADI I,AMIN N ,PARNAS R S.Continuous production of biodiesel from waste cooking oil in a reactive distillation column catalyzed by solid heteropolyacid: optimization using response surface methodology (RSM)[J].Fuel,2012,94(1):156-164.
[6]NAIR P,SINGH B,UPADHYAY S N,et al.Synthesis of biodiesel from low FFA waste frying oil using Calcium oxide derived from Mereterix mereterix as a heterogeneous catalyst[J].Journal of Cleaner Production,2012,29-30(29/30):82-90.
[7]DEHKORDI A M,GHASEMI M.Transesterification of waste cooking oil to biodiesel using Ca and Zr mixed oxides as heterogeneous base catalysts[J].Fuel Processing Technology,2012,97:45-51.
[8]YAN J,LI A,XU Y,et al.Efficient production of biodiesel from waste grease: one-pot esterification and transesterification with tandem lipases[J].Bioresource Technology,2012,123:332-337.
[9]AWALUDDIN A. Transesterification of waste chicken fats for synthesizing biodiesel by CaO as heterogeneous base catalyst[C]//Proceedings of the international conference on energy and sustainable development: issues and strategies (ESD 2010). Chiang Mai, Thailand:IEEE, 2010: 4.
[10]SAWANGKEAW R,TEJVIRAT P,NGAMCHARASSRIVICHAI C,et al.Supercritical transesterification of palm oil and hydrated ethanol in a fixed bed reactor with a CaO/Al2O3 catalyst[J].Energies,2012,5(4):1062-1080.
[11]SALVI B L,PANWAR N L.Biodiesel resources and production technologies - A review[J].Renewable & Sustainable Energy Reviews,2012,16(6):3680-3689.
[12]BANKOVIC I B.STARNENKOVIC O S,VELJKOVIC V B.Biodiesel production from non-edible plant oils[J].Renewable & Sustainable Energy Reviews,2012,16(6):3621-3647.
[13]TAUFIQ-YAP Y H,LEE H V,YUNUS R,et al.Transesterification of non-edible Jatropha curcas oil to biodiesel using binary Ca-Mg mixed oxide catalyst: effect of stoichiometric composition[J].Chemical Engineering Journal,2011,178:342-347.
[14]苑丽霞,郝敬云,周广航,等.新型能源作物亚麻荠及种子油脂合成调控研究进展[J].山西农业科学,2015 (5):634-638, 642.
[15]THOMAS T P,BIRNEY D M,AULD D L.Optimizing esterification of safflower, cottonseed, castor and used cottonseed oils[J].Industrial Crops and Products,2013,41:102-106.
[16]李广会.黄连木的种质资源与开发利用[J].天津农业科学,2009,15(6):68-70.
[17]于莜涵.文冠果--优良的铁杆油料树种[J].天津农业科学,2010,16(4):93-95.
[18]丁鑫,沈植国,谭运德,等.河南不同分布区毛梾果实形态及脂肪油差异性分析[J].山西农业科学,2012,40(2):101-104.
[19]SOYDEMIR G,KERIS-SEN U D,SEN U,et al.Biodiesel production potential of mixed microalgal culture grown in domestic wastewater[J].Bioprocess and Biosystems Engineering,2016,39(1):45-51.
[20]KWON M H,YEOM S H.Biodiesel production from wet Marine microalgae via a one-step direct process in the presence of an adsorbent[J].Biotechnology and Bioprocess Engineering,2015,20(3):593-598.
[21]HUANG G H,CHEN F,WEI D,et al.Biodiesel production by microalgal biotechnology[J].Applied Energy,2010,87(1):38-46.
[22]HU Q,SOMMERFELD M,JARVIS E,et al.Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances[J].The Plant journal : for cell and molecular biology,2008,54(4):621-639.
[23]刘文卓.微藻油脂生产的现状和发展[J]. 生物技术世界, 2016(3): 84-86.
[24]李晶晶,刘瑛,马炯.破囊壶菌生产DHA的应用前景[J].食品工业科技,2013,34(16):367-371.
[25]KOBAYASHI T,SAKAGUCHI K,MATSUDA T,et al.Increase of eicosapentaenoic acid in thraustochytrids through thraustochytrid ubiquitin promoter-driven expression of a fatty acid {delta}5 desaturase gene[J].Applied and Environmental Microbiology,2011,77(11):3870-3876.
[26]李晶晶,刘瑛,成家杨,等.深圳海域6株破囊壶菌的生长特性及油脂成分分析[J].微生物学通报,2015,42(1):17-23.
[27]田治立,王长海,于贞,等.纤细角毛藻培养条件优化[J].海洋科学,2005,29(2):5-7, 36.
[28]梁妍,邹宁,潘曰磊,等.角毛藻培养研究进展[J].生命科学仪器,2008,6(7):25-27.
[29]郑忠明,金春华,冯坚.牟氏角毛藻的生产性培养技术[J].水产科学,2002,21(6):20-21.
