珂字棉312组织培养体系的建立
2016-08-15邹甜郑顺利匡琛周仲华
邹甜 郑顺利 匡琛 周仲华

摘要:以珂字棉312为试验材料,以无菌苗的下胚轴为外植体诱导愈伤,并将愈伤组织置于不同培养基下诱导分化,初步建立棉花组织培养体系。结果表明:一是对珂字棉312组织培养体系建立较好的各阶段培养基分别是愈伤组织诱导培养基为MS+0.1 mg/L 2,4-D+0.5 mg/L KT+30 g/L 葡萄糖+8 g/L琼脂,胚性愈伤组织的诱导培养基为MS +30 g/L葡萄糖+2.5 g/L phytagell,分化培养基为MS+0.1 mg/L IAA +30 g/L葡萄糖+2.5 g/L phytagell,生根培养基为MSB5 (双倍KNO3,无NH4NO3)+0.1 mg/L GA3 +30 g/L葡萄糖+2.5 g/L phytagell;二是各培养基调节pH值为5.8,培养温度为28℃时能够获得植株再生体系。
关键词:棉花;珂字棉312;组织培养
中图分类号: S562. 文献标识码: A 文章编号:2095-3143(2016)04-0003-05
Abstract: Using the Coker 312 cotton cultivar as experimental material, We took its aseptic seedlings hypocotyl as explant for callus induction, then took the callus into different culture medium for inducing differentiation and preliminarily built cotton tissue culture system. The results showed: first, the better culture mediums for the estabishment of the tissue culture system of Coker 312 in each stage were respectively that the callus-inducing medium was MS+0.1 mg/L 2,4-D+0.5 mg/L KT+30 g/L glucose+8 g/L agar, Induction medium of embryogenic callus was MS+30 g/L glucose +2.5 g/L phytagel, differential medium was MS+0.1 mg/L IAA +30 g/L glucose +2.5 g/L phytagel, rooting medium was MSB5 (double KNO3, without NH4NO3)+0.1 mg/L GA3 +30 g/L glucose +2.5 g/L phytagel; second, the suitable pH value and culture temperature of culture medium for obtaining plant regeneration system were respectively 5.8 and 28 ℃.
Key words: Cotton; Coker 312; Tissue culture
0 引言
棉花组织培养技术自Price和Smith在1979年第一次报道以来发展较快,目前已经建立了多个不同棉花品种的再生培养体系,例如谢德意,等[1]在2007年建立了鄂抗棉3号、鄂抗棉5号、鄂棉20、鄂棉23、豫棉9号、豫早73、豫棉12、豫棉1221等8个品种植株再生体系;孙京燕,等[2]在2009年建立了一套简便高效的低酚陆地棉直接体细胞胚胎发生和植株再生组织培养体系;罗晓丽,等[3]建立了晋棉5号、中棉所27和辽棉10号等3个早熟棉品种的再生组织培养体系;周晶,等[4]建立了新陆早19号和新陆早23号的再生组织培养体系;刘丽,等[5]通过对新陆早32号和新陆早33号的诱导研究,建立了它们的再生组织培养体系。棉花是被公认的较难分化的一种材料[6],到目前为止还有较多的棉花品种没有建立一套有效的组织培养再生体系,而棉花组织培养技术是棉花转基因技术的一个平台,因此,研究棉花组织培养可以促进棉花转基因技术的发展。
1 材料与方法
1.1 试验材料
供试材料为珂字棉312,由国家棉花种质资源中期库提供。
1.2 培养基的配制 基本培养基采用MS培养基和MSB5培养基,先将其配制成母液,保存于4℃冰箱中备用。
1.2.1基本培养基的配制 ①大量元素母液的配制:称取19 g KNO3、16.5 g NH4NO3、3.7 g MgSO4·7H2O、1.7 g KH2PO4依次溶解,将4.4 g CaC12·2H2O单独溶解后再跟上述溶液混匀,最后定容至0.5 L,冷藏保存备用。如配制1 L MS,只需吸取该母液50 mL。②微量元素母液的配制:称取3.38 g MnSO4·H2O、1.72 g ZnSO4·7H2O、1.24 g H3BO3、0.16 g KI、0.05 g Na2MnO4·2H2O、0.005 g CuSO4·5H2O、0.005 g CoC12·6H2O,逐一溶解,因为CuSO4·5H2O和CoC12·6H2O的用量较少,所以可以将这两种药品先配成0.01 g/mL的母液,再分别取500 ul混入微量元素母液中,这样可以减少误差。最后将微量元素母液定容至1 L,冷藏保存备用。如配制1 L MS,只需吸取该母液5 mL。③铁盐母液的配制:称取2.785 g FeSO4·7H2O和3.737 g Na2EDTA,逐一溶解,混合后加热,避光放置至室温,定容至1 L,冷藏保存备用,如配制1 L MS,只需吸取该母液10 mL。④BS维生素母液的配制:称取0.50 g VB1、0.05 g VB6、0.05 g烟酸、5.0 g肌醇,逐一溶解,烟酸先用少量l mol/L HCl溶解,然后再与其他药品混合,定容至0.5 L,冷藏保存备用,如配制1 L MS,只需吸取该母液10 mL。
1.2.2激素的配制 ①KT母液(lmg/L):取10 mg KT,先用少量l mol/L HCI滴溶,然后定容至10 mL,用0.22μm的滤膜过滤除菌,冷藏保存。②2,4-D母液(lmg/L):取10 mg 2,4-D,先溶于少量95%乙醇中,然后加热水溶解,定容至10 mL,用0.22 um的滤膜过滤除菌,冷藏保存。③IAA母液(lmg/L):取10 mg IAA,先溶于少量95%乙醇中,然后定容至10 mL,用0.22 μm的滤膜过滤除菌,冷藏保存。④IBA母液(lmg/L):取l mg IBA,先溶于少量l mol/L NaOH中,然后定容至10 mL,用0.22 μm的滤膜过滤除菌,冷藏保存。⑤ZT母液(0.5mg/L):取25 mg ZT,先溶于少量95%乙醇中,然后加热水溶解,定容至50 mL,用0.22 μm的滤膜过滤除菌,冷藏保存。
1.3无菌苗的获得
将珂字棉312的种子脱绒后用75%乙醇消毒30 s,0.1% HgCl2消毒30 min,用无菌水冲洗5~6次,然后浸泡于无菌水中至露白,再将露白的种子接入1/2 MS培养基中(7粒/瓶),置于28℃下黑暗培养。无菌苗的获得也可以先将棉花种子去壳,蒸馏水浸泡1 h,再用0.1% HgCl2消毒8~10 min,然后直接种于1/2 MS培养基上,置于28℃下黑暗培养。
1.4愈伤组织诱导
4天后,将下胚轴切成1cm的片段转入诱导培养基中,待愈伤组织形成后,将之转接于愈伤继代培养基。
愈伤诱导培养基:
A. MS+0.1mg/L 2,4-D+0.5mg/L KT+30 g/L蔗糖+8g/L琼脂
B. MS+0.1mg/L 2,4-D+0.5mg/L KT+30 g/L 葡萄糖+8g/L琼脂
C. MSB5+1mg/L IBA+0.5 mg/L KT+ 3%葡萄糖+8g/L琼脂
愈伤继代培养基:
D. MSB5+0.05 mg/L 2,4-D +0.1mg/L KT +30g/L葡萄糖+8g/L琼脂
E. MSB5+0.05 mg/L 2,4-D +0.1mg/L KT +30g/L葡萄糖+2.5g/L phytagel
1.5胚性愈伤组织的诱导
从继代培养基上将愈伤组织转入胚性愈伤诱导培养基中。
胚性愈伤诱导培养基:
a. MS +30 g/L葡萄糖+2.5 g/L phytagel
b. MSB5(双倍 KNO3,无NH4NO3)+0.1mg/L ZT+0.5g/L 活性炭+30g/L葡萄糖+2.5g/L phytagel
c. MSB5(双倍 KNO3,无NH4NO3)+0.2mg/L ZT +0.1mg/L IAA +30g/L葡萄糖+2.5g/L phytagel
d. MSB5(双倍 KNO3,无NH4NO3)+0.15mg/L KT +0.5mg/L IBA +0.75g/L MgCl2+30g/L葡萄糖+2.5g/L phytagel
e. MSB5+0.1 mg/L KT+0.01 mg/L 2,4-D +30g/L葡萄糖+2.5g/L phytagel
f. MSB5(双倍 KNO3,无NH4NO3)+0.1mg/L KT +0.05mg/L 2,4-D +1.0 g/L Gln+0.5 g/L Asn +30g/L葡萄糖+2.5g/L phytagel
g.MSB5+0.01 mg/L 2,4-D +0.5 mg/L Zip+30g/L葡萄糖+2.5g/L phytagel
当呈粒状疏松的胚性愈伤组织诱导出来后,再转入胚性愈伤增殖培养基[MSB5(双倍 KNO3,无NH4NO3)+0.5mg/L IBA+0.15mg/L KT+1.0 g/L Gln+0.5 g/L Asn +30g/L葡萄糖+2.5g/L phytagel]。
1.6分化
将胚性愈伤组织转入分化培养基中,胚性愈伤分化成苗后,将其转入生根培养基[MSB5(双倍 KNO3,无NH4NO3)+0.1mg/L GA3 +30g/L葡萄糖+2.5g/L phytagel] [MS+0.1 mg/L IAA +30g/L葡萄糖+2.5g/L phytagel]。
2结果与分析
2.1愈伤组织诱导
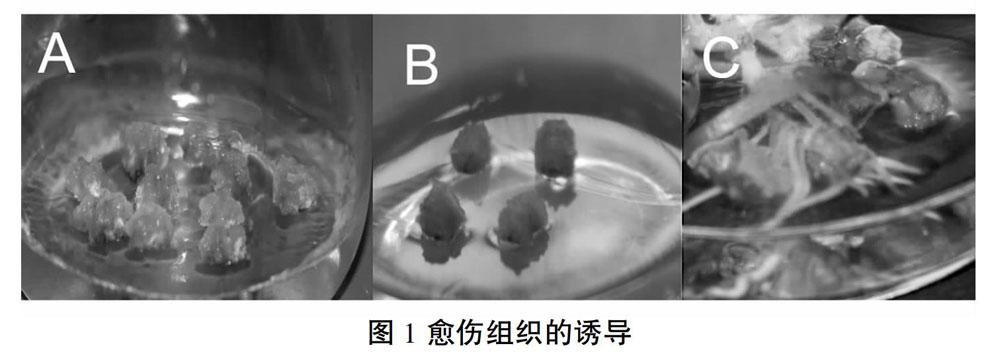
用3种不同愈伤组织诱导培养基培养棉花下胚轴,大约4天后,即可看见下胚轴片段的一端有膨大现象。诱导培养半个月后,在A培养基上会出现很多种状态的愈伤组织,大多数是呈泥状的灰白色愈伤,但是有轻微褐化,少部分白色、绿色(图1-A)。在B培养基上长有较多的灰白色的愈伤,少数淡黄色(图1-B)。在C培养基上有较少的愈伤却有较多的根(图1-C)。从图中可以看出,在A、B、C三种愈伤组织诱导培养基中,B培养基诱导愈伤组织效果较好。因此,对愈伤组织进行继代培养时,一般选择B培养基上的愈伤组织。
将B培养基上形成的愈伤组织转移到D、E两种继代培养基上进行继代培养,发现在D培养基上形成的愈伤组织极易褐化,而在E培养基上形成的愈伤生长良好。经分析,出现这种结果,很可能是跟这两种继代培养基使用不同碳源有关。通过在E培养基上继代两次后,愈伤组织大多变成淡黄色和淡白色。
2.2胚性愈伤组织的诱导
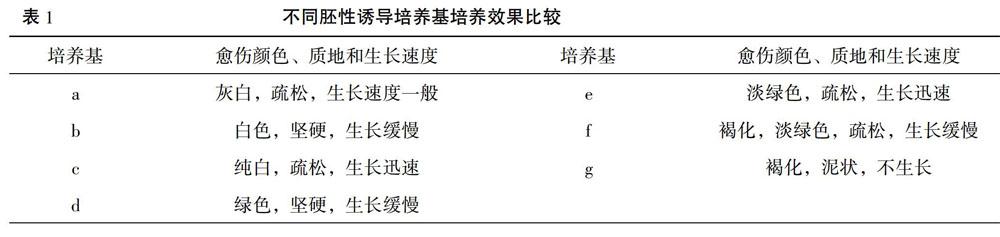
将E继代培养基上形成的淡黄色和白色的愈伤组织转移到7种不同胚性诱导培养基上,大约培养1周后,观察发现,g培养基中的愈伤组织出现褐化,生长基本停止。c、e培养基上的愈伤组织生长迅速,均为浅色、疏松的愈伤组织。b、d、f三种培养基上的愈伤组织均生长缓慢,b、d两种培养基上的愈伤组织质地坚硬,而f培养基上的愈伤组织虽然为疏松状,但出现褐化。a培养基为实验对照,不含任何激素,尽管愈伤组织生长速度一般,但质地疏松,为灰白色(表1)。
2.3分化
将a胚诱导培养基上形成的胚性愈伤组织,转移到分化培养基上,大约15天后,在分化培养基上可以看到有部分愈伤变成了体细胞胚。继续培养一周后,体细胞胚萌发,长出子叶胚。然后,将子叶胚转入生根培养基中,进行生根培养,结果发现可以诱导产生根。
3 结论与讨论
培养基是影响棉花组织培养及植株再生的一个重要原因。本研究经过多次尝试,初步建立了珂字棉312的组织培养体系。在无菌苗获得阶段,选择的是经典的1/2 MS培养基,在愈伤组织的诱导和胚性愈伤组织的诱导阶段选择了MS培养基,而在愈伤组织增殖阶段选择了MSB5培养基,在胚性愈伤组织增殖和根诱导阶段选择的是含有双倍 KNO3、不含NH4NO3的MSB5培养基。在培养基的碳源选择上,除了最初诱导愈伤时使用的是蔗糖外,在后面的培养基中都使用了葡萄糖。在凝固剂的选择上,除了第一次诱导愈伤时使用的是琼脂外,后面都使用了Phytagell。Phytagell是一类新的凝固剂,在植物组织培养中具有通气性好、凝固温度低、含杂质少等优点,而且不易发生水化现象[7]。选用Phytagell作为凝固剂有利于体细胞胚形成。本研究选择的外植体是下胚轴,有利于下胚轴诱导获得愈伤组织。
植物激素是影响棉花组织培养及植株再生的另一个重要因素。0.1mg/L 2,4-D和0.5mg/L KT可以诱导出灰白色的愈伤组织;采用低浓度的2,4-D 和KT即0.05 mg/L 2,4-D和0.1mg/L KT,有利于愈伤组织的增殖;在不含任何激素的MS培养基上可以诱导出胚性愈伤组织;0.5 mg/L IBA和0.15 mg/L KT,另外再添加1.0 g/L Gln和0.5 g/L Asn,可以使胚性愈伤组织大量增殖;0.1 mg/L IAA有利于胚性愈伤的分化;0.1 mg/L GA3有利于根的分化。
能否诱导出胚性愈伤组织是棉花组织培养成败的关键,在本研究中,选择了7种诱导胚性愈伤组织的培养基,结果只有在不含任何激素的MS培养基上可以诱导出胚性愈伤组织,研究结果跟前人研究结果差异比较大。经分析认为,这可能跟愈伤继代培养基中含有2,4-D 和KT有关,而这两种激素中的1种或两种存在滞后作用,从而使得胚性愈伤组织得以诱导成功。同时,在胚诱导培养基e、f中。尽管也含有2,4-D 和KT这两种激素,不同的是f培养基中2,4-D的浓度更高,而e培养基中形成的愈伤组织生长很快,f培养基中形成的愈伤组织反而出现褐化。因此,作者认为,2,4-D在胚性愈伤组织诱导中可能起关键作用,但是浓度不需要太高,太高容易引起褐化。至于2,4-D是否跟KT存在协同效应,诱导胚性愈伤组织的最适合浓度是多少,这些都有待实验进一步验证。
参考文献
[1] 谢德意,金双侠,郭小平,等. 长江和黄河流域棉区棉花品种体细胞胚胎发生和植株再生比较研究[J]. 作物学报,2007, 33(3):394-400.
[2] 孙京燕,李伟明,张寒霜,等. 低酚陆地棉直接体细胞胚胎发生和植株再生[J]. 华北农学报,2009(24):81-84.
[3] 罗晓丽,姜艳丽,肖娟丽,等. 早熟棉体细胞胚胎发生和植株再生体系的建立[J]. 西北植物学报,2011, 31(3): 0609-0615.
[4] 周晶,张芳转,王静,等. 新疆棉花体细胞胚胎发生及植株再生[J]. 种子,2011, 30(4):1-7.
[5] 刘丽,王娟,王旭文,等. 新陆早32 号、33 号的体细胞胚胎发生和植株再生比较研究[J]. 棉花学报,2011, 23(3):259-264.
[6] 朱华国. 棉花体细胞胚胎发生形态、遗传分析及初始脱分化相关基因的克隆与表达分析[D]. 武汉:华中农业大学博士学位论文,2009.
[7] 张巧,汪静儿,林君,等. 不同凝固剂对陆地棉体细胞胚胎发生和植株再生的影响[J]. 棉花学报,2010,22(1):3-9.
