山楂叶总黄酮对急性酒精性肝损伤小鼠肝细胞凋亡及Bcl-2、Bax蛋白表达的影响
2016-08-15李素婷
李素婷 王 琳 许 倩 杜 超
(承德医学院,河北 承德 067000)
山楂叶总黄酮对急性酒精性肝损伤小鼠肝细胞凋亡及Bcl-2、Bax蛋白表达的影响
李素婷王琳1许倩杜超
(承德医学院,河北承德067000)
目的研究山楂叶总黄酮(FMCL)对急性酒精性肝损伤小鼠肝细胞凋亡及Bcl-2、Bax蛋白表达的影响。方法60只昆明种小鼠随机分为正常组、模型组、FMCL大、小剂量组。采用56%(V/V)北京二锅头白酒灌胃制备急性肝损伤模型,同时按剂量每天给予FMCL(80、40 mg/kg)干预,连续灌胃14 d后处死小鼠缺口末端标记(TUNEL)法检测肝细胞凋亡情况,Western印迹法定量检测肝细胞Bcl-2、Bax蛋白表达情况。结果与模型组比较,FMCL明显降低酒精性肝损伤小鼠肝细胞凋亡指数,TUNEL染色阳性细胞数明显下降(P<0.01);与正常组比较,模型组小鼠肝组织Bcl-2蛋白表达明显降低,Bax蛋白表达明显升高(P<0.01),给予FMCL保护后,Bcl-2蛋白表达升高,Bax蛋白表达明显降低,Bcl-2/Bax比值高于模型组(P<0.01)。结论FMCL通过上调抗凋亡基因Bcl-2的表达、下调促凋亡基因Bax的表达,抑制酒精诱导的肝细胞凋亡,对急性酒精性肝损伤起到保护作用。
山楂叶总黄酮;酒精性肝损伤;肝细胞凋亡;Bcl-2;Bax
肝细胞异常凋亡在酒精性肝损伤的发生发展中具有重要作用〔1〕。抑制肝细胞凋亡有利于酒精性肝损伤的防治,也是保证肝脏正常功能的关键因素。研究表明,Bcl-2家族相关基因的表达和调控是影响细胞凋亡的关键因素之一,Bcl-2和Bax分别作为Bcl-2家族中抗凋亡和促凋亡的代表基因,在肝细胞凋亡的基因调控中起着中心作用〔2〕。山楂叶总黄酮(FMCL)是从蔷薇科植物山楂的干燥叶中提取的黄酮类化合物,具有抗心肌缺血、抗动脉硬化、抗氧化等多种药理作用〔3〕。对大鼠脑缺血再灌注后细胞凋亡具有明显保护作用〔4〕。本研究观察 FMCL对酒精引起肝细胞凋亡的抑制作用及对凋亡相关基因Bcl-2、Bax蛋白表达的影响。
1 材料与方法
1.1动物、药品及仪器昆明种小鼠,雄性,清洁级,体重(22±2)g,石家庄实验动物管理中心提供。FMCL(纯度80%):北京中医药大学馈赠,临用前以蒸馏水配置,4℃保存;56°红星二锅头白酒:北京红星酿酒厂生产;TUNEL细胞凋亡原位检测试剂盒,β-actin、Bcl-2、Bax 兔抗鼠多克隆抗体,辣根过氧化物酶标记羊抗兔IgG,均由南京凯基生物科技发展有限公司提供;BCA蛋白定量试剂盒:上海生物工程有限公司提供;ECL超敏发光液:北京普利莱公司提供;Olympus显微镜和组织切片机:德国Leica公司。
1.2方法
1.2.1动物造模与药物处理〔5〕将60只昆明种小鼠随机分为4组,分别为正常组、模型组、FMCL小剂量(40 mg/kg)组、FMCL大剂量(80 mg/kg)组。正常组每天给予蒸馏水0.4 ml灌胃,模型组和FMCL给药组按8 ml·kg-1·次-1灌胃给予56°二锅头白酒,2次/d,连续14 d造模结束。自造模第1天起,FMCL组在每天下午1点灌胃给药1次,正常组和模型组同时灌服等体积蒸馏水,实验期间各组小鼠自由饮水、进食。最后一次灌胃结束,禁食不禁水14 h,断头处死小鼠。
1.2.2TUNEL法检测肝细胞凋亡情况采用TUNEL对肝脏凋亡细胞进行检测,按试剂盒说明书操作。凋亡的肝细胞多表现为胞膜完整、核改变,细胞核呈棕黄色染色或细胞质因核DNA逸出而呈阳性染色者为凋亡细胞,肝细胞凋亡小体也呈阳性着色。每例选5个高倍视野(400倍)观察凋亡细胞,计数不少于500个细胞,计数阳性肝凋亡细胞核数占该视野肝细胞核总数的比例,取均值以百分数表示,以凋亡指数(AI)反映肝细胞凋亡情况。
1.2.3Western印迹检测Bcl-2、Bax蛋白表达肝脏组织蛋白提取,取肝脏组织约100 mg加入冰预冷适量细胞裂解液,制成肝细胞匀浆。冰上裂解40 min,4℃,12 000 r/min离心2 min,收集上清液,按照BCA蛋白定量试剂盒说明进行蛋白定量测定。Western印迹技术检测Bcl-2、Bax蛋白的表达,每份样品取50 μg蛋白质,与5×SDS加样缓冲液混合,100℃变性5 min,8%SDS-聚丙烯凝胶电泳分离,电转移至PVDF膜上;该膜经5%脱脂奶粉封闭后,室温下与一抗(1∶200稀释)共同孵育,再与羊抗兔IgG/HRP二抗(1∶3 000稀释)室温孵育1.5 h,按照ECL免疫检测试剂盒进行曝光、显影、洗片。以β-actin(1∶200稀释)杂交作为内参照,胶片经扫描仪扫描后获得图像。用Quantity One分析软件测定条带灰度值(Bcl-2、Bax蛋白条带灰度值/内参照β-actin蛋白条带灰度值),计算Bcl-2、Bax蛋白的的相对表达水平。
1.3统计学方法采用SPSS13.0软件行方差分析及q检验。
2 结 果
2.1FMCL对酒精引起小鼠肝细胞凋亡的保护作用TUNEL结果显示,正常组小鼠肝组织无或偶见肝细胞凋亡〔(2.92±0.88)%〕;模型组小鼠肝组织中可见大量棕黄色、棕褐色凋亡细胞核,散在分布于肝小叶内,肝细胞AI〔(11.41±1.13)%〕比正常组明显升高(P<0.01);和模型组比较,FMCL大、小剂量组肝细胞凋亡阳性细胞数目明显减少,染色强度减弱,AI明显降低〔(7.96±1.84)%、(9.78±2.43)%,P<0.01,P<0.05〕,并呈现剂量依赖关系。表明FMCL能明显抑制酒精诱发的肝细胞凋亡,见图1。
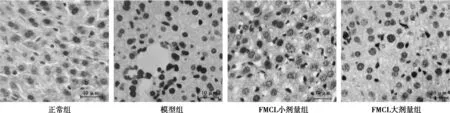
图1 FMCL对酒精性肝损伤小鼠肝细胞凋亡的影响(TUNEL,×400)
2.2FMCL对凋亡相关基因Bcl-2、Bax蛋白表达的影响表1、图2所示,与正常组比较,模型组肝组织中Bcl-2表达明显降低,Bax表达明显升高,Bcl-2/Bax比值明显低于正常组(P<0.01),表明酒精通过下调抑凋亡基因Bcl-2的表达,上调促凋亡基因Bax的表达,使线粒体膜通透性改变,引起肝细胞异常凋亡;给予FMCL保护后,肝组织Bcl-2表达明显升高,Bax表达明显降低,Bcl-2/Bax比值明显高于模型组(P<0.01,P<0.05)。表明FMCL通过调节凋亡相关基因Bcl-2、Bax蛋白的表达,保护线粒体的结构与功能,抑制肝细胞异常凋亡进而起到保肝作用。
表1 FMCL对凋亡相关基因Bcl-2、Bax蛋白表达的影响
与正常组比较:1)P<0.01;与模型组比较:2)P<0.05,3)P<0.01

1.正常组;2.模型组;3.FMCL小剂量组;4.FMCL大剂量组图2 FMCL对酒精性肝损伤小鼠肝细胞凋亡相关基因Bcl-2、Bax蛋白表达的影响
3 讨 论
凋亡与增殖的动态平衡是维持组织自稳态所必需的最基本过程。但过度凋亡则会引起组织损伤,进而导致功能障碍。近年研究表明,肝细胞异常凋亡与许多肝脏疾病的发生密切相关,病毒感染、毒性物质、酒精等均可诱发肝细胞凋亡,引起各种急慢性肝损伤〔6〕。酒精作为肝细胞的一种凋亡诱导剂,介导的肝细胞凋亡在酒精性肝病的发生与发展中发挥重要的促进作用〔7〕。
肝细胞凋亡的发生是受多种相关基因调控的。在众多凋亡调控基因中,Bcl-2基因家族是最有效的调控物质,它们通过激活一系列下游基因发挥调节细胞凋亡的作用,在凋亡基因调控中起着中心作用〔8〕。Bcl-2家族是一个多基因家族,目前被认为和凋亡关系最密切的是Bcl-2和Bax。Bcl-2是公认的凋亡抑制基因,它编码的蛋白位于线粒体膜、内质网膜和核膜上,其抗凋亡作用机制是抗氧化、调节线粒体的通透性、防止细胞色素C及凋亡诱导因子的释放,使凋亡效应蛋白酶链Caspase-3不能激活而发挥抗凋亡作用〔9〕。而Bax是目前Bcl-2家族中研究最广泛的促凋亡基因,正常细胞中Bax定位于细胞质,当受到损伤或刺激后,激活的Bax结合在线粒体膜上,建立线粒体膜通道,介导细胞色素C的释放,从而诱导细胞凋亡〔10〕。当Bcl-2过量表达时,可形成Bcl-2同源二聚体,能有效抑制各种因素诱导的细胞凋亡。而Bax过度表达时,则形成Bax同源二聚体直接启动或诱导细胞凋亡,或与Bcl-2结合成异源二聚体,抑制Bcl-2的抗凋亡作用的发挥〔11〕。因此,Bcl-2与Bax表达水平的平衡结果决定了凋亡信号刺激后细胞的存活或凋亡,Bcl-2/Bax比值是肝细胞凋亡的决定性因素之一。一切干预细胞凋亡的因素都可最终归结为对Bcl-2/Bax比值的改变,发挥促进或抑制细胞凋亡的作用〔12〕。
本研究表明酒精介导肝细胞凋亡是导致肝损伤的主要原因,FMCL通过抑制肝细胞凋亡进而起到保肝作用。酒精诱导肝细胞毒性损伤造成Bax高水平表达,过度表达的Bax形成Bax同源二聚体或与Bcl-2结合成异源二聚体,致使Bcl-2/Bax明显下降,造成线粒体膜通透性增加,膜通道开放,细胞色素C大量释放,加速肝细胞凋亡,促进肝细胞损伤。FMCL通过上调肝组织抑凋亡基因Bcl-2的表达、下调促凋亡基因Bax的表达,提高Bcl-2/Bax比值,发挥抗凋亡进而保肝的功效,这可能是FMCL对酒精性肝损伤具有保护作用的重要机制之一。
1朱传龙,高人焘,李宜.凋亡及其调控基因bcl-2家族在肝脏损伤中的作用〔J〕.实用肝脏杂志,2008;11(6):206-9.
2靳雅玲,欧士钰.bcl-2、bax与肝纤维化关系的研究进展〔J〕.临床医学工程,2013;20(1):124-6.
3于栋华,包顺茹,于纯淼,等 山楂叶总黄酮药理作用研究进展〔J〕.辽宁中医药大学学报,2013;15(3):174-7.
4纪影实,曲极冰,李红,等.山楂叶总黄酮对大鼠脑缺血再灌注后细胞凋亡的保护作用〔J〕.吉林大学学报,2008;34(4):590-3.
5赵敏,迟丽萍,王凤岩,等.小鼠急性酒精性肝损伤模型的建立及应用〔J〕.华南预防医学,2005;3(1):14-7.
6肖卫东.细胞凋亡及其相关因素在酒精性肝病中的作用〔J〕.国外医学临床生物化学与检验学分册,2002;23(3):161-3.
7安红姬,金武丕.乙醇诱发肝细胞凋亡的发病机制〔J〕.吉林医学,2007;28(8):1155-7.
8郭晨,李丹,林纳,等.表达HBVX基因的小鼠模型的建立及对肝细胞凋亡因子的影响〔J〕.世界华人消化杂志,2011;19(12):1225-30.
9朱玉山,卢铁元,王蕊,等.Bcl-2家族蛋白调控线粒体膜通透性和细胞色素C释放的新机制〔J〕.生命科学,2011;23(11):1076-80.
10Dorota S,Julita CB,Matylda M,etal.Bcl-2 and Bax protein are increased in neocortical but not in thalamic apoptosis following devascularizing lesion of the cerebral cortex in the rat:an immunohistochemical study〔J〕.Brain Res,2004;15(1):133.
11Klemm K,Eipel C,Cantre D,etal.Multiple doses of erythropoietin impair liver regeneration by increasing TNF-alpha,the Bax to Bcl-xL ratio and apoptotic cell death〔J〕.PLoS One,2008;3(12):3924.
12叶立红,王翀奎,刘莲,等.软肝化坚颗粒对肝纤维化模型C57小鼠肝组织Bcl-2及Bax表达的调节作用〔J〕.天津医药,2013;41(6):583-6.
〔2015-01-16修回〕
(编辑赵慧玲/曹梦园)
10.3969/j.issn.1005-9202.2016.14.011
河北省科学技术研究与发展计划项目(No.12276104D-93)
李素婷(1963-),女,硕士,教授,主要从事中药对肝损伤保护作用及其分子机制研究。
R575
A
1005-9202(2016)14-3375-03;
1新乐市医院
