白兰花萜类合成酶基因McHMGR保守区的克隆及其表达分析
2016-08-13姚雪倩陈桂信叶乃兴福建农林大学园艺学院福州茉莉花茶科技与全球重要农业文化遗产联合研究中心福建福州350002
林 浥,俞 滢,陈 丹,陈 静,姚雪倩,陈桂信,叶乃兴(福建农林大学园艺学院/福州茉莉花茶科技与全球重要农业文化遗产联合研究中心,福建福州 350002)
白兰花萜类合成酶基因McHMGR保守区的克隆及其表达分析
林浥,俞滢,陈丹,陈静,姚雪倩,陈桂信,叶乃兴*
(福建农林大学园艺学院/福州茉莉花茶科技与全球重要农业文化遗产联合研究中心,福建福州 350002)
以白兰(Michelia alba DC.)花瓣为材料,采用RT-PCR方法,克隆得到白兰花萜类代谢途径中3-羟基-3-甲基戊二酰辅酶A还原酶基因(McHMGR)的保守区,该cDNA保守区长为421bp,编码128个氨基酸。序列分析结果表明,该基因编码的氨基酸序列与同属植物乐昌含笑的HMGR具有99%的同源性。采用实时荧光定量PCR技术检测McHMGR在白兰开花过程中四个时期的的表达量变化,结果表明,表达量在盛花期最高,花芽期最低。
白兰;香气;3-羟基-3-甲基戊二酰辅酶A还原酶;实时荧光定量PCR
白兰(Michelia alba DC.)属木兰科(Magnoliaceae)含笑属(Miche原lia L.)常绿乔木,别称白玉兰、白兰花、白缅花、缅桂花,其花香浓郁持久。白兰花是茶用香花,可用于窨制白兰花茶,也可以作为配料加工茉莉花茶,以加重底香、增强鲜灵度[1]。前人已对白兰花香气成分进行了研究,表明白兰花挥发性成分中含量较高的有芳樟醇、甲基异丁子香酚、顺-罗勒烯、9,12,15-三烯十八醇、亚油酸甲醋、苯乙醇等化合物[2],其中主要为萜类物质,目前已从白兰花中共鉴定出31种萜类化合物[3]。白兰花具有止咳、化浊等药理功能,这可能与芳樟醇抗菌等功能有关[4]。萜类代谢途径包括甲羟戊酸途径(MVA)和2-甲基-D-赤藓糖醇-4-磷酸途径(MEP)。3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)是甲羟戊酸途径中第一个限速酶,对于白兰花香气物质的形成具有重要的作用[5]。已在巴西橡胶、马铃薯、铁皮石斛、茶树、茉莉花等植物中分离得到HMGR基因[6-10]。
目前从分子生物学角度对白兰花香气形成机理的研究尚未见报道,本研究采用RT-PCR技术成功克隆得到白兰花香气形成的萜类代谢途径上HMGR基因的保守区序列,命名为McHMGR,并采用实时荧光定量PCR技术分析McHMGR在白兰花不同开放时期的相对表达量变化。拟通过本研究,为McHMGR基因全长cDNA的获得及其功能验证奠定基础,阐明白兰花香气形成的分子机制,以期为生产上白兰花茶的窨制和白兰花打底窨制茉莉花茶时间的合理运用提供理论依据。
1 材料与方法
1.1材料与试剂
本实验以白兰花花瓣为供试材料,取自福建农林大学主干道旁白兰树。于2015年7月下旬起,根据花被片张开程度将分4个发育时期(花芽期:花蕾绿色,苞片未张开;大花蕾期:花蕾白色,苞片已脱落,花瓣与花柱夹角呈0°;初花期:花被片微微张开,花瓣与花柱夹角呈30°;盛花期:白兰花全面盛开,花瓣与花柱夹角呈90°,花被片遇触碰脱落)采摘花瓣,称取0.1g,用锡箔纸包裹后放入液氮速冻,于-80℃冰箱保存备用。
1.2白兰花花瓣总RNA的提取
采用多糖多酚植物总RNA提取试剂盒(北京天根生化科技有限公司)提取白兰花总RNA,并通过1%的琼脂糖凝胶电泳检测RNA质量。
1.3McHMGR保守区的克隆
参照郑鸿昌[11]合成和纯化cDNA第一链。从GenBank下载已登录的不同植物的HMGR基因序列,根据已报道的人参(Panax ginseng)、荔枝(Litchi chinensis)、茉莉花(Jasminum sambac(L.)Ait)等植物的HMGR基因序列,使用primer primer5软件根据比对序列的保守区设计引物McHMGR-F、McHMGR-R(表1)。PCR扩增采用TransTaq DNA Polymerase HiFi Fidelity(北京全式金生物技术有限公司)体系,参照试剂盒说明书;程序为95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10min。PCR产物纯化回收参照TIANgel Midi Purification Kit试剂盒(北京天根生化科技有限公司)说明书进行,连接克隆载体pMD18-T,16℃连接过夜,转化大肠杆菌T1感受态细胞,挑取单菌落进行验证,测序(上海铂尚生物技术有限公司)。
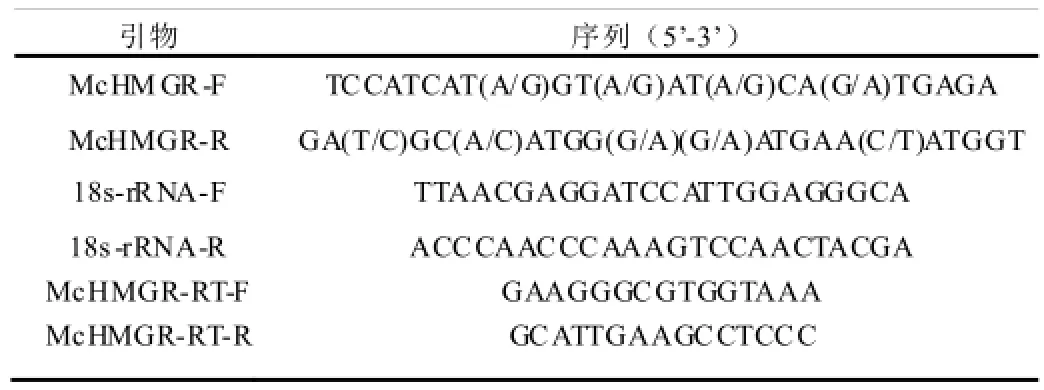
表1 引物序列
1.4McHMGR保守区的生物信息学分析
利用BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行氨基酸序列同源性比对;利用MEGA5.2软件构建NJ系统进化树。
1.5McHMGR实时荧光定量PCR表达分析
分别提取处于花芽期、大花蕾期、初花期、盛花期四个时期的白兰花瓣总RNA,按照TransScript Reverse Transcriptase试剂盒(北京全式金生物技术有限公司)说明书合成白兰花第一链cDNA。根据McHMGR保守区序列设计荧光定量 PCR引物McHMGR-RT-F,McHMGR-RT-R(表1),以白兰花18s-rRNA基因为内参,设置3个生物学重复,采用GoTaq® qPCR Master Mix(北京普洛麦格生物技术有限公司)进行McHMGR荧光定量PCR分析(BIO-RAD icycler realtime quantity PCR仪)。试验数据釆用2-△△Ct法进行定量分析。
2 结果与分析
2.1McHMGR保守区序列的克隆以及生物信息学分析
通过RT-PCR技术获得白兰花HMGR基因的保守区序列,该序列长为421bp,编码128个氨基酸。通过与NCBI数据库BLAST比对,结果表明,该序列推导出该基因编码的氨基酸序列与乐昌含笑(Michelia chapensis)相似性达99%,与野生大豆(G.sija Sleb.et Zucc.)、鱼腥草(Houttuynia cordata Thunb.)、小羊蒜(Paris fargesii)相似性分别为91%、89%、88%。初步判断该序列为白兰花HMGR基因的保守区片段,将该基因命名为McHMGR。
利用MEGA5.2软件对McHMGR氨基酸序列构建系统进化树(图1),构建方法为邻近连接法(Neighbor-Joining,NJ)。系统进化树结果显示,所获得到的McHMGR与同为木兰科含笑属乐昌含笑(Michelia chapensis)的HMGR基因属于同一分支,进一步确定该序列为白兰花的HMGR基因片段。
2.2McHMGR实时荧光定量PCR表达分析
采用实时荧光定量PCR技术,以白兰花的18s-rRNA为内参基因检测McHMGR在白兰花发育4个时期的表达量变化情况。结果表明(图1),该基因在花芽期表达量最低,随着白兰花的开放程度的增加呈上调趋势,在大花蕾期间表达量迅速上调,盛花期时达到最高水平。

图1 McHMGR核酸序列及其推导的氨基酸序列

图2 McHMGR氨基酸序列的NJ系统进化树
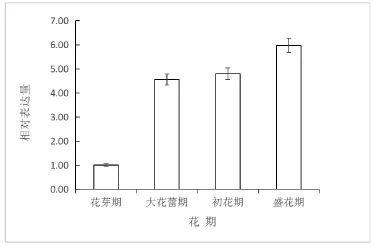
图3 白兰花开放过程中McHMGR基因表达分析
3 讨论
植物花朵的香气成分是一类具有较低分子量的挥发性分子,主要由萜类、苯类/苯丙素类、脂肪酸衍生物和一些含氮或硫化合物等组成[12,13]。植物类异戊二烯包括单萜、倍半萜、二萜等,是一组结构迥异的化合物家族[14]。HMGR是MAV途径中第一个关键限速酶。本实验从白兰花花瓣中克隆得到McHMGR保守区cDNA 421bp,编码128个氨基酸。McHMGR推导出的氨基酸序列与其同属植物乐昌含笑(Michelia chapensis)的相似度最高,达99%,与野生大豆(G.sija Sleb. et Zucc.)、鱼腥草(Houttuynia cordata Thunb.)、小羊蒜(Paris fargesii)相似性分别为91%、89%、88%。初步判定其为白兰花的HMGR基因。通过系统进化树分析表明,其与同属的植物乐昌含笑的HMGR属于同一分支,进一步证明该片段为白兰花HMGR基因的片段。
萜类物质的代谢和植物的生长发育以及形态发生存在一定的相关性。陈大华认为,特异的HMGR编码基因成员的表达参与花的发育[15]。白兰花为“体质花”,在开花前就已经积累了大量的香气前体物质,在整个开放过程中香气含量都很高且变化幅度很小[16],本实验通过实时荧光定量PCR技术对McHMGR基因在白兰花开放过程中的相对表达量动态进行分析,结果表明,该基因在花芽期表达量最低,盛花期表达量达到最高,随着白兰花的开放程度总体呈上调趋势,但花芽期与大花蕾期间上调最快,大花蕾期与初花期间基因表达量趋于稳定,初花期与盛花期间上调幅度较小。这与前人的研究结果一致,证明白兰花开放的过程中香气的释放和McHMGR表达量存在一定程度的关联。McHMGR的基因表达特异性为白兰花窨茶或打底熏制茉莉花茶不用“养花”提供了分子机制研究依据。郭素枝[17,18]等研究表明,白兰花初花期香气成分含量最高;而荧光定量结果显示,McHMGR在盛花期相对表达量最高,在大花蕾期之后持续高表达,这可能与下游的调控基因萜类合成酶基因的表达量有关,需进一步研究。
[1]骆少君,郭雯飞,濮娟荷.我国白兰花茶香气的化学组成[J].福建茶叶,1987(4):11-14.
[2]王建晖.几种茶用香花香气成分的分析研究[D].重庆:西南农业大学,2003.
[3]衣晓明,宋述芹,谷茂.白兰花挥发性物质GC/MS分析[J].深圳职业技术学院学报,2016(1):50-53.
[4]姜冬梅,朱源,余江南,等.芳樟醇药理作用及制剂研究进展[J].中国中药杂志,2015,40(18):3530-3533.
[5]王心宇,刘明春,杨迎,等.GC-MS法分析白兰花挥发油成分[J].重庆大学学报:自然科学版,2008,31(1):97-100.
[6]Chye M L,Tan C T,Chua N H.Three genes encode 3-hydroxy-3-methylglutaryl-coenzyme A reductase in Hevea brasiliensis:hmg1 and hmg3 are differentially expressed.[J].Plant Molecular Biology.1992,19(3):473-484.
[7]Korth K L,Stermer B A,Bhattacharyya M K,et al.HMG-CoA reductase gene families that differentially accumulate transcripts in potato tubers are developmentally expressed in floral tissues.[J].Plant Molecular Biology.1997,33(3):545-551.
[8]张琳,王继涛,张大为,等.珍稀濒危药用铁皮石斛HMGR基因的克隆和特征分析[J].药学学报,2014(3):411-418.
[9]韩兴杰,徐玲玲,廖亮,等.茶树HMG-CoA还原酶基因全长cDNA克隆及序列分析[J].广西植物.2015(2):231-238.
[10]孙君.茉莉花香气合成相关酶基因克隆与表达分析[D].福州:福建农林大学,2014.
[11]郑鸿昌.夜来香均一化全长cDNA文库的构建与花香相关基因的遗传转化[D].福州:福建农林大学,2012.
[12]缪旻珉,陈建春,张宗东.花朵香味的生理、遗传及调控[J].分子植物育种,2007(S1):67-74.
[13]孔滢,孙明,潘会堂,等.花香代谢与调控研究进展[J].北京林业大学学报,2012,34(2).
[14]Wildung M R,Croteau R B.Wildung,M.R.&Croteau,R.A cDNA clone for taxadiene synthase,the diterpene cyclase that catalyzes the committed step of taxol biosynthesis.J.Biol.Chem.271,9201-9204[J]. Journal of Biological Chemistry.1996,271.
[15]陈大华,叶和春,李国凤,等.植物类异戊二烯代谢途径的分子生物学研究进展[J].植物学报,2000,42(6):551-558.
[16]Watanabe N,Watanabe S,Nakajima R,et al.Formation of Flower Fragrance Compounds from Their Precursors by Enzymic Action during Flower Opening[J].Bioscience Biotechnology&Biochemistry.1993,57(7): 1101-1106.
[17]郭素枝,邱栋梁,张明辉.白兰开花过程中花被片结构的变化与释香机理[J].热带作物学报,2006,27(4):34-40.
[18]郭素枝,高华娟,邱栋梁,等.白兰花被片发育过程中香精油化学成分的GC-MS分析[J].热带亚热带植物学报,2010,18(1):87-92.
叶乃兴(1963-),男,教授,主要从事茶学与茉莉资源利用研究。E-mail:ynxtea@126.com。
福建省自然科学基金(2016J01110);福州市科技计划项目(2015-PT-93)
林浥(1996-),女,本科生,主要从事茶树遗传育种与生物技术研究。
