哮喘-慢性阻塞性肺疾病重叠综合征患者氧化应激水平及抗氧化治疗效果的研究
2016-08-13刘凌云曾勉左万里康丽玫
刘凌云曾勉左万里康丽玫
哮喘-慢性阻塞性肺疾病重叠综合征患者氧化应激水平及抗氧化治疗效果的研究
刘凌云①曾勉②左万里①康丽玫①
目的:本研究旨在探讨哮喘-慢性阻塞性肺疾病重叠综合征(ACOS)患者全身氧化应激水平及抗氧化治疗效果。方法:选择2012年6月-2014年6月本院诊治的稳定期ACOS患者60例(ACOS组),同期在本院体检中心体检的健康吸烟者60例(对照组);ACOS组按随机数字表法分为常规治疗组和抗氧化治疗组。常规治疗组接受单纯吸入糖皮质激素/长效β2受体激动剂(沙美特罗/氟替卡松粉吸入剂 50/500μg,早晚各1次吸入)治疗,抗氧化治疗组在常规治疗基础上加用N-乙酰半胱氨酸600 mg,2次/d,疗程3个月。所有测试者治疗前后进行肺通气功能检查、支气管舒张试验、动脉血气分析,并测定血清MDA、GSH含量、SOD活性。结果:ACOS组患者血清MDA较对照组明显升高,而血清GSH含量和SOD活性均较对照组明显下降(P<0.05);ACOS组患者血清MDA与FEV1显著负相关(r=-0.745 ,P<0.05),而血清GSH含量、SOD活性与FEV1呈显著正相关(r=0.779,P<0.05;r=0.698 ,P<0.05); 常规治疗组和抗氧化治疗组治疗前后血清MDA下降,而血清GSH含量、SOD活性及FEV1上升(P<0.05);抗氧化治疗组血清MDA、血清GSH含量、SOD活性及FEV1变化幅度较常规治疗组明显(P<0.05)。结论:ACOS患者体内存在全身性的氧化/抗氧化失衡,且与其肺功能下降有关。N-乙酰半胱氨酸抗氧化治疗能改善ACOS患者体内全身性氧化/抗氧化失衡,从而改善其肺功能。
哮喘-慢性阻塞性肺疾病重叠综合征; 氧化应激; 乙酰半胱氨酸片; 肺功能; 丙二醛; 超氧化物歧化酶; 还原型谷胱甘肽
First-author’s address:J iangmen Central Hospital,J iangmen 529000,China
哮喘-慢性阻塞性肺疾病重叠综合征(asthma chronic obstructive pulmonary disease overlap syndrome,ACOS)是以临床症状中包含一种以上哮喘与COPD共同的临床特征,表现为不完全可逆的气道阻塞与气流变异率增加共存的疾病[1]。两种疾病的共存增加了疾病的复杂性及治疗难度。ACOS已经被认为是一个特异的独立的临床疾病病种,但ACOS的临床特点、病理生理学特点、发病机制及治疗方面还未明确[2]。ACOS发病机制目前认为与气道和肺部慢性炎症、氧化应激、气道重塑及气道高反应有关,氧化应激不仅可以直接损伤气道和肺组织,且可导致蛋白酶-抗蛋白酶失衡,促进炎症反应,在ACOS的发生和发展中起重要作用[3]。本研究通过测定ACOS患者血清氧化应激指标及其与肺功能等的相关性,并观察N-乙酰半胱氨酸抗氧化治疗的效果,旨在氧化应激在ACOS发病机制中的作用及抗氧化治疗效果的研究,为ACOS的诊治提供依据,现报道如下。
1 资料与方法
1.1一般资料 受试者来源及分组:选择2012年6月-2014年6月本院(广东省江门市中心医院)诊治的稳定期ACOS患者60例(ACOS组),同期在本院体检中心体检的健康吸烟者60例(对照组);ACOS组按随机数字表法分为常规治疗组和抗氧化治疗组。ACOS入选标准:符合COPD诊断标准(2011版GOLD指南[4-5]),同时符合以下标准:(1)强的支气管舒张剂阳性反应(FEV1增加>15% 和FEV1超过基线值400 mL以上);(2)个人哮喘史(40岁前); (3)个人过敏史;(4)2次以上:支气管舒张剂阳性反应(FEV1增加>12%和FEV1超过基线值200 mL以上)。排除标准:合并感染或近3个月内存在急性加重。健康对照者中吸烟指数大于200年支者为吸烟者。所有符合条件的受试者均告之本研究的试验目的、试验方法及可能存在的风险。
1.2研究方法
1.2.1检测指标及方法 脂质过氧化产物丙二醛(MDA)含量采用硫代巴比妥法测定,非酶性抗氧化剂还原型谷胱甘肽(GSH)含量、酶性抗氧化剂超氧化物歧化酶(SOD)活性采用化学比色法测定,试剂盒购自南京建成生物工程研究所,步骤严格按试剂盒操作说明书进行测定。所有受试者均使用肺功能仪(Sensor Medics Ltd,USA)测定肺功能及支气管舒张试验。
1.2.2治疗方案 ACOS组按随机数字表法随机分为常规治疗组和抗氧化治疗组。常规治疗组接受单纯吸入糖皮质激素/长效β2受体激动剂(沙美特罗/氟替卡松粉吸入剂 50/500 μg,早晚各 1 次吸入)治疗,抗氧化治疗组在常规治疗基础上加用N-乙酰半胱氨酸600 mg,2次/d,疗程3个月。
1.3统计学处理 采用SPSS 13.0软件对所得数据进行统计分析,计量资料用(±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用 字2检验。P<0.05为差异有统计学意义。
2 结果
2.1一般资料 ACOS组:男46例,女14例,年龄58~80岁,平均(64.5±12.5)岁;对照组:男49例,女11例,年龄55~76岁,平均(63.5±11.2)岁;常规治疗组:男22例,女8例,年龄58~78岁,平均(65.6±11.6)岁;抗氧化治疗组:男24例,女6例,年龄55~80岁,平均(63.8±13.1)岁。ACOS组与对照组及常规治疗组与抗氧化治疗组年龄、性别、吸烟指数比较,差异均无统计学意义(P>0.05),肺功能、支气管舒张试验及血气分析比较,差异均有统计学意义(P<0.05)。常规治疗组与抗氧化治疗组治疗前肺功能、支气管舒张试验及血气分析结果比较,差异均无统计学意义(P>0.05)。见表1~2。
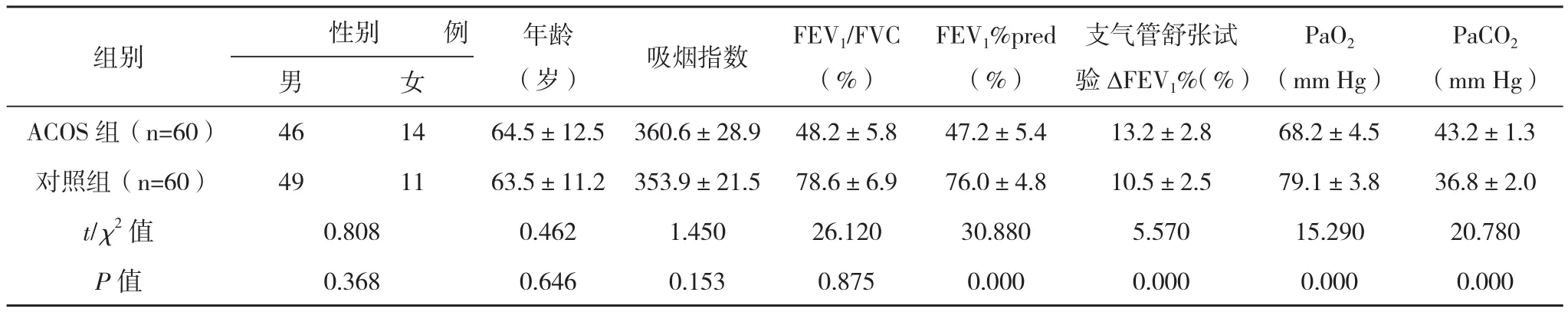
表1 ACOS组与对照组一般资料、肺功能及血气分析比较
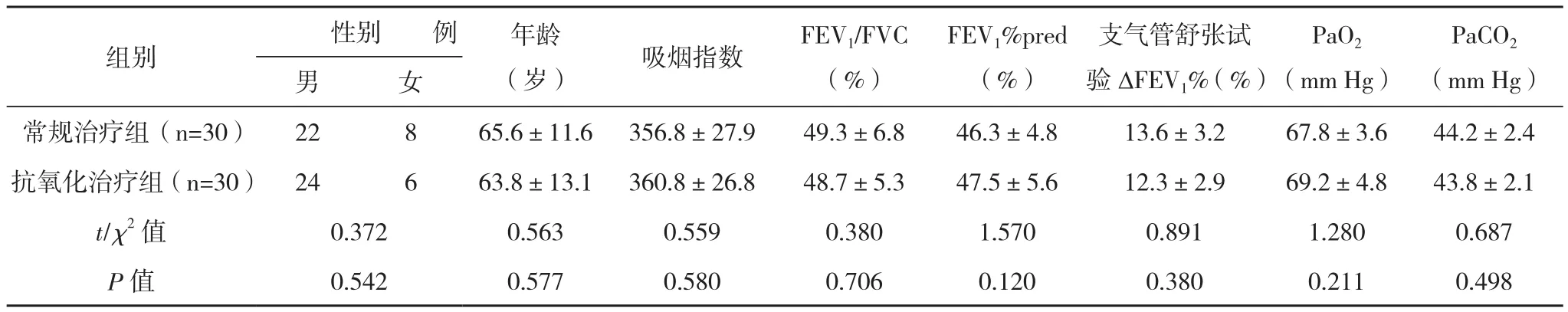
表2 不同治疗组一般资料、肺功能及血气分析的比较
2.2ACOS组与对照组血清氧化应激指标比较 ACOS组血清MDA较对照组明显升高,而血清GSH含量和SOD活性较对照组明显下降(P<0.05),见表3。
表3 ACOS组与对照组血清氧化应激指标比较(±s)

表3 ACOS组与对照组血清氧化应激指标比较(±s)
组别 MDA(nmol/L) GSH(mg/L) SOD(U/mL)ACOS组(n=60) 7.65±1.73 198.32±28.95 43.65±6.28对照组(n=60) 5.68±1.09 369.24±31.21 85.38±7.36 t值 7.460 31.070 33.400 P值 0.000 0.000 0.000
2.3ACOS患者氧化应激指标与肺功能的相关性 ACOS患者血清MDA与FEV1呈显著负相关(r=-0.745,P<0.05),而血清GSH含量和SOD活性与FEV1呈显著正相关(r=0.779,P<0.05;r=0.698,P<0.05)。
2.4治疗前后氧化应激指标、肺功能及疗效比较 常规治疗组与抗氧化治疗组治疗前后血清MDA下降,而血清GSH含量和SOD活性及FEV1上升(P<0.05),见表4。抗氧化治疗组血清MDA、血清GSH含量、SOD活性及FEV1变化幅度较常规治疗组明显(P<0.05),见表5。
3 讨论
氧化应激是由于内源性和/或外源性刺激使机体代谢异常而产生大量活性氧自由基,或机体抗氧化物质不足,氧化剂/抗氧化剂动态平衡失衡,使机体处于氧化应激状态,导致DNA、脂质及蛋白质的氧化损伤,进一步引起细胞死亡和组织损伤,这与很多疾病的病理生理过程相关[6]。肺脏存在于高氧环境中且拥有巨大的表面积和充足的血液供应,容易发生氧化应激介导的组织损伤[7]。氧化应激不仅直接损伤肺组织,而且可使抗蛋白酶氧化失活、炎症细胞渗出、炎前介质基因表达,从而促进肺部慢性疾病的发生发展。氧化应激与慢性气道炎症性疾病如支气管哮喘,COPD的关系目前已较明确[8]。哮喘患者由于体内炎症细胞及免疫细胞或体外香烟烟雾,大气污染物及颗粒物质产生的活性氧自由基(reactiveoxygenspecies,ROS)及活性氮自由基(reactivenitrogenspecies,RNS),导致其体内氧化应激水平升高[9]。氧化应激也可通过多种途径导致慢阻肺发生和发展,包括气道和肺泡上皮细胞损伤和凋亡、促炎介质基因表达增加、蛋白酶一抗蛋白酶失衡和黏液腺高分泌等[10]。然而具有哮喘与COPD共同临床特征的ACOS,其氧化应激水平及氧化应激在ACOS发生和发展中的作用尚不明确,鲜有研究报道。临床上常通过检测自由基的氧化代谢产物(MDA、8-异前列腺)、抗氧化酶(SOD、GSHPx和CAT)及非酶抗氧化剂(谷胱甘肽、维生素C、维生素E)以评价机体氧化应激水平[11]。本研究通过检测ACOS患者血清MDA、GSH含量,SOD活性,并与健康吸烟者比较,发现ACOS患者血清MDA含量较正常吸烟者明显升高,而GSH含量及SOD活性则明显下降,提示ACOS患者存在显著的全身性氧化抗氧化失衡;同时研究发现各血清氧化应激指标与ACOS患者肺功能存在明显相关性,反映了ACOS患者体内存在的全身性的氧化/抗氧化失衡与其肺功能下降有关。这些结果与氧化应激在哮喘和COPD相关的研究结果一致[12-13]。但本研究尚存许多不足之处,如未进一步比较ACOS、哮喘、COPD三者之间或不同时期ACOS患者在氧化应激水平的差异,亦未研究ACOS气道局部氧化应激水平,均有待于进一步探讨。
表4 常规治疗组和抗氧化治疗组治疗前后氧化应激指标、肺功能比较(±s)

表4 常规治疗组和抗氧化治疗组治疗前后氧化应激指标、肺功能比较(±s)
PaCO2(mm Hg)常规治疗组(n=30) 治疗前 7.86±1.68 200.52±31.36 45.75±7.32 49.3±6.8 46.3±4.8 13.6±3.2 67.8±3.6 44.2±2.4治疗后 6.91±1.29 235.0±25.8 53.9±6.62 53.2±6.9 49.8±5.6 11.6±2.8 70.1±3.8 42.8±1.0 t值 3.470 6.570 6.390 2.200 2.590 2.580 2.410 2.950 P值 0.000 0.000 0.000 0.036 0.010 0.015 0.023 0.010抗氧化治疗组(n=30) 治疗前 8.15±1.83 197.66±28.31 46.32±6.41 48.7±5.3 47.5±5.6 12.28±2.9 69.2±4.8 42.8±2.1治疗后 6.05±1.62 241±27.16 57.89±7.12 55.7±5.8 51.9±6.1 12.16±3.0 70.2±3.6 40.6±3.0 t值 4.710 6.050 6.610 4.880 2.910 0.158 1.180 3.290 P值 0.000 0.000 0.000 0.000 0.007 0.238 0.876 0.030组别 时间 MDA (nmol/L)GSH (mg/L)SOD (U/mL)FEV1/FVC (%)FEV1%pred (%)支气管舒张试验ΔFEV1%(%)PaO2(mm Hg)
表5 常规治疗组和抗氧化治疗组治疗前后氧化应激指标、肺功能变化幅度比较(±s)
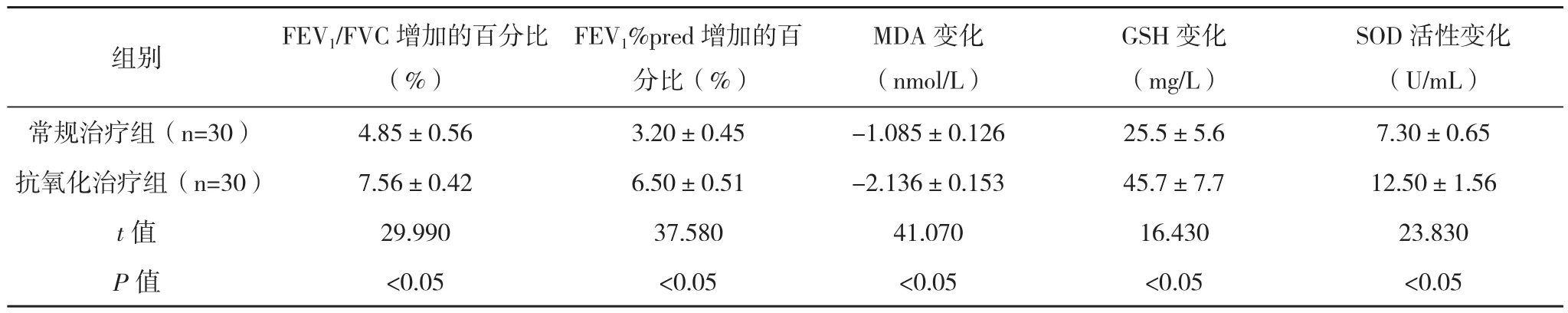
表5 常规治疗组和抗氧化治疗组治疗前后氧化应激指标、肺功能变化幅度比较(±s)
SOD活性变化(U/mL)常规治疗组(n=30) 4.85±0.56 3.20±0.45 -1.085±0.126 25.5±5.6 7.30±0.65抗氧化治疗组(n=30) 7.56±0.42 6.50±0.51 -2.136±0.153 45.7±7.7 12.50±1.56 t值 29.990 37.580 41.070 16.430 23.830 P值 <0.05 <0.05 <0.05 <0.05 <0.05组别 FEV1/FVC增加的百分比(%)FEV1%pred增加的百分比(%)MDA变化(nmol/L)GSH变化(mg/L)
ACOS的治疗策略包括:(1)对于所有该表型患者推荐尽早使用ICS,正如在哮喘中的治疗;(2)ICS的剂量应根据症状的控制、肺功能和/或痰中嗜酸粒细胞进行调整;(3)对于严重COPD以及COPD合并哮喘患者,建议使用三种药物联合治疗即ICS加吸入长效β2肾上腺素受体激动剂加吸入长效抗胆碱能药物[4]。除了以上策略外,考虑到氧化应激对ACOS发病机制的影响,通过提高机体抗氧化能力来干预氧化应激对机体的不良影响,是符合逻辑的治疗思路。抗氧化治疗可能是治疗ACOS的有效方法。近年来NAC较为广泛的应用于临床和动物实验,是治疗常用的抗氧化剂[14]。NAC是含有巯基的化合物,可作为细胞内半胱氨酸的供体,也是GSH的前体。GSH是细胞内外最重要的抗氧化剂,所以NAC具有强氧化作用[15]。它能减少GSSH的二硫键,还可以直接与氧化物发生反应,NAC能够完全抑制CSE导致的肺泡细胞凋亡和坏死[16]。研究表明,NAC能减少COPD患者呼出H2O2,降低健康吸烟者血清/血浆中MPO的浓度;抑制健康吸烟者的肺泡巨噬细胞产生超氧阴离子自由基;减少COPD吸烟者外周血多形核白细胞H2O2的释放;逆转吸烟诱导GSH、SOD的下降。NAC同时是祛痰剂,能抑制肺部炎症。因此,NAC通过减少氧化物的产生,增加抗氧化物的水平,使氧化/抗氧化系统趋于平衡,减轻氧化物对肺造成的损伤[17]。N-乙酰半胱氨酸在支气管哮喘、COPD中的抗氧应激的效果已得到证实[18-19]。一项为期1年的前瞻性、随机、双盲和安慰剂对照研究结果表明,我国中重度慢阻肺患者长期应用N-乙酰半胱氨酸(600 mg,2次/d)可有效预防急性加重,中度慢阻肺患者获益尤其明显[20]。但抗氧化治疗及NAC在ACOS中的应用,尚鲜有研究报道。本研究结果表明,常规治疗策略及用N-乙酰半胱氨酸(600 mg,2次/d)辅助常规治疗均可改善ACOSH患者血清中MDA和GSH水平及SOD活性,从而有效缓解体内氧化应激反应;但加用N-乙酰半胱氨酸治疗患者改善更为显著。本研究还发现NAC亦能改善ACOS患者肺通气功能,通过升高FEV1、降低RV/TLC指标达到减轻ACOS患者临床症状的作用,其机制可能与对氧化应激相关指标的改善作用有关。未来需要更多的、更全面的基础科学研究及多中心临床试验来研究这一重叠综合征的更深的发病机制,为研发新的药物及新的治疗方法提供更多的依据。
[1]Harding M,Cho M,McDonald M L,et al.The clinical and genetic features of COPD-asthma overlap syndrome[J].Eur Respir J,2014,44(2):341-350.
[2]孙永昌.哮喘-慢阻肺重叠综合征指南解读[J].中国呼吸与危重监护杂志,2014,13(4):325-329.
[3] Barrecheguren M,Esquinas C,Miravitlles M.The asthmachronic obstructive pulmonary disease overlap syndrome (ACOS):opportunities and challenges[J].Cur Opin Pulm Med,2015,21 (1):74-79
[4] Soler-Cataluña J J,Cos í o B,Izquierdo J L,et al.Consensus document on the overlap phenotype COPD-asthma in COPD[J]. Arch Bronconeumol,2012,48(9):331-337.
[5] The Global Initiative for Chronic Obstructive Lung Disease Science Committee.Global Strategy for the Diagnosis,Management,and Prevention of COPD(Revised 2011)[S/OL].[2011-12-05].http://www.goldcopd org/uploads/users/files/GOLD 2011 Summary.pdf
[6]王秋林,王浩毅,王树人.氧化应激状态的评价[J].中国病理生理杂志,2005,21(10):2069-2074.
[7]Rosanna D P,Salvatore C.Reactive oxygen species,inflammation,and lung diseases[J].Curr Pham Des,2012,18 (26):3889-3900.
[8] Tsukagoshi H,Shimizu Y,Iwamae S,et al.Evidence of oxidative stress in asthma and COPD; potential inhibitory effect of theophylline[J].Respir Med,2000,94(6):548-588.
[9] Comhair S A,Xu W,Ghosh S,et al.Super oxide dismutase in activation in pathophysiology of asthmatic airway remodeling and reactivity[J].Am J Pathol,2005,166(3):663-674.
[10] Kirkham P A,Bames P J.Oxidative stress in COPD[J].Chest,2013,144(1):266-273.
[11]钟琳晔,杨汀,肖飞.氧化应激及其评价指标在慢性阻塞性肺疾病中的作用[J].中华结核和呼吸杂志,2014,37(7):524-527.
[12] Chung K F,Marwick J A.Molecular mechanisms of oxidative stress in airways and lungs with reference to asthma and chronic obstructive Pulmonary disease[J].Annals of the New York Academy of Sciences,2010,1203(1203):85-91.
[13]刘凌云,曾勉,左万里,等.不同时期慢性阻塞性肺疾病患者气道局部和全身氧化应激水平的变化[J].华北煤炭医学院学报,2008,10(4):442-444.
[14] De Benedetto F,Aceto A,Dragani B,et al.Long-term oral N-acetylcysteine reduces exhaled hydrogen peroxide in stable COPD[J].Pulm Pharmacol Ther,2005,18(1):41-47.
[15] Decramer M,Rutten-Van M M,Dekhuijzen P N,et al.Effects of N-acetylcyseine on outcomes in chronic obstructive pulmonary disease (Bronchitis Randomized on NAC Cost-Utility Study,BRONCuS):a randomised pIacebo-controlled trial[J].Lancet,2005,365(9470):1552-1560.
[16] Ito K,Ito M,Elliott W M,et al.Decreased histone deacetvlase activity in chronic obstructive pulmonary disease[J].N Engl J Med,2005,352(19):1967-1976.
[17] Adcock I M,Barnes P J.Molecular mechanisms of conicostemid resistance[J].Chest,2008,134(2):394-401.
[18] Masoud A,Ali P A,Ali S,et al.Effects of N-acetylcysteine on asthma exacerbation[J].Iranian Journal of Allergy Asthma & Immunology,2010,9(2):103-109.
[19]洪克付,王士国,邓爱华.乙酰半胱氨酸片辅助治疗慢性阻塞性肺疾病急性加重期的效果和作用机制[J].贵阳医学院学报,2015,40(3):301-303.
[20] Zheng J P,Wen F Q,Bai C X,et al.Twice daily N-acetylcysteine 600 mg for exacerbations of chronic obstructive pulmonary disease (PANTHEON):a randonfised.Double-blind placebo-controlled trial[J].Lancet Respir Med,2014,2(3):187-194.
Oxidative Stress and Antioxidant Therapy in Patients with Asthmatic Chronic Obstructive Pulmonary Disease Overlap Syndrome
LIU Ling-yun,ZENG Mian,ZUO Wan-li,et al.//Medical Innovation of China,2016,13(21):009-013
Objective:To investigate the oxidative stress and curative effects of fluimucil in treating Asthma-COPD overlap syndrome(ACOS).Method:A total of 60 patients with stable ACOS from June 2012 to June 2014 in our hospital patients(ACOS group) and 60 healthy smokers in the same period in our hospital physical examination center (the control group) were selected.ACOS group was randomly divided into routine treatment group and antioxidant treatment group.Routine treatment group received simple inhalation of Glucocorticoid/Long-actingβ2Receptor Agonist(Salmeterol/Fluorine Fluticasone Propionate Powder for Inhalation 50/500μg, two times a day),while antioxidant treatment group added the N acetylcysteine 600 mg twice/day based on routine treatment group.The course of treatment was 3 months.Pulmonary function tests,bronchial dilation test,arterial blood gas analysis,and serum MDA,GSH content,SOD activity were performed before and after treatment in all testers.Result:Compared with the control group,serum MDA,and GSH content in serum of ACOS group were significantly higher,the activity of superoxide dismutase(SOD) of ACOS group compared with the control group was decreased significantly(P<0.05).ACOS group serum MDA and FEV1significantly negative correlation(P<0.05),and GSH content in serum,SOD activity and FEV1significantly positive correlation (P<0.05).Routine treatment group and Antioxidant treatment group before and after treatment,serum MDA decreased,and GSH content in serum,SOD activity and FEV1rose(P<0.05).Antioxidant treatment group,the serum levels of MDA decreased and GSH content in serum,SOD activity and FEV1increased amplitude compared with routine treatment group significantly(P<0.05).Conclusion:ACOS patients have systemic oxidation/ antioxidant imbalance,and the imbalance are related to the decline in lung function.N-acetyl cysteine oxidation treatment can improve ACOS patients systemic oxidation/antioxidant imbalance,so as to improve their lung function.
Asthma-COPD overlap syndrome; Oxidative stress; Acetylcysteine Tablets;Pulmonary function; Malondialdehyde; Superoxide dismutase; Glutathione Peroxidase
10.3969/j.issn.1674-4985.2016.21.003
①广东省江门市中心医院 广东 江门 529000
②中山大学第一附属医院
刘凌云
2016-04-25) (本文编辑:程旭然)
