谈高考试题对化学教学的启示
2016-08-12李晓明
摘要:通过例举分析高考试题,阐述了目前高考试题对科学性教学、教学的严谨性、理解性教学和渗透化学价值观的教学启示;指出在教学中教师不仅要关注高考试题的解题方法、知识和能力的考查要求,还应从中汲取对改善教学的启示。
关键词:高考试题;试题分析;教学启示;化学教学
文章编号:1005–6629(2016)6–0085–06 中图分类号:G633.8 文献标识码:B
高考试题凝结了命题专家的心血和智慧,是精心的设计和苦心的创作。每当我们在研读高考试题时,都会被试题的原创性、试题背景的新颖性及相关问题设置的科学严谨性所深深折服。然而,如果我们能够对高考试题进行进一步的分析和思考,还能对我们平时的教学有很多的启示。
1 对教学科学性的启示
教学的科学性问题现在越来越受到教师的重视,向学生传递正确的化学知识,尽量避免出现科学性错误是对我们开展教学活动的最基本的要求,但是由于长期的流传和错误试题的引导使我们在教学中会出现将知识绝对化的行为,这是出现科学性问题的主要原因之一。例如在电解教学过程中,教师在归纳总结离子放电规律时,常会说当惰性电极电解时,在阴极放电的是阳离子,而阴离子在阳极放电。


同样,阳离子也会在阳极放电。在2014年全国新课标Ⅱ卷理综第27题涉及以石墨为电极,通过电解Pb(NO3)2和Cu(NO3)2的混合溶液来制取PbO2,此时阳极的电极反应式为Pb2++2H2O-2e-=PbO2+4H+。2013年的天津理综第9题的第(7)小题和2013年的福建理综第23题均涉及在惰性电极时,电解FeCl2溶液的问题。阳极反应式为Fe2++2e-=Fe,总反应式为2Fe2++2H+=2Fe3++ H2↑。而在2014年的北京理综28题更是将电解FeCl3酸性溶液脱除H2S后的废液以再生作为背景素材,设计为探究性的实验题。通过在不同电压下电解pH=1的FeCl2溶液,获知阳极产生Fe3+的原因即可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化,也可能是Fe2+直接在阳极放电,而且通过控制电压的实验结果,验证了Fe2+要先于Cl-放电。
例2 (2014年北京理综,26题节选)(4)工业上电解NO制备NH4NO3,其工作原理如图1所示。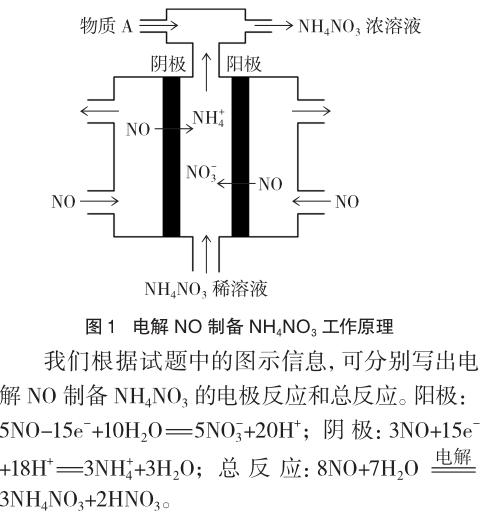
通过上述两例可知,电解池中在阴、阳极放电的既可以是离子也可以是气体分子,阳离子既可能在阴极放电也可能在阳极放电,同样,阴离子既可能在阳极放电也可能在阴极放电。这些试题启示我们,在平时的教学中切勿随意对高中的知识进行归纳,而是要将本质的规律讲透彻。电解的基本原理之一就是阳极发生氧化反应,阴极发生还原反应,这是任何形式的电解装置共同的核心本质。
2 对教学严谨性的启示
在教学过程中教师对有些教学内容的处理过于简单化,考虑问题过于单一化,没有综合地、全面地考虑问题,使我们的教学变得不够严谨。如在金属的电化学腐蚀的教学中,教师经常简单地说,“钢铁在酸性环境下发生析氢腐蚀,在碱性或中性环境下发生吸氧腐蚀”。按照书本[3]编排的析氢腐蚀实验,具体操作:向还原铁粉中加入少量的碳粉,混合均匀后,撒入内壁用稀醋酸润湿过的具支试管中,按图2组装好仪器。马上打开止水夹,会观察到导管中的液面低于试管中的液面,但是很快又会出现导管中的液面高于试管中液面的情况。面对这种情况,教师总是关注导管中液面低于试管中的液面的现象,而忽略后一现象,或者对该实验进行改进,如提高醋酸的浓度甚至用强酸代替醋酸,以期达到较长时间出现导管中的液面高于试管中液面的现象。其实,钢铁的电化学腐蚀是较复杂的过程,无论在酸性、中性还是碱性条件下吸氧腐蚀都是存在的。而析氢腐蚀则主要发生在H+浓度较大的环境中。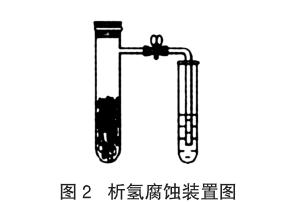
例3 (2014安徽理综,28题节选)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图3)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。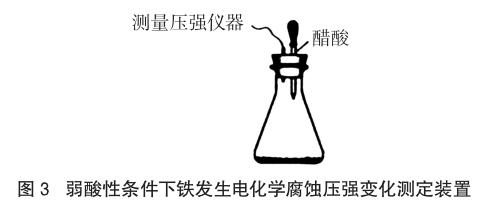
(1)请完成以下实验设计表(表中不要留空格):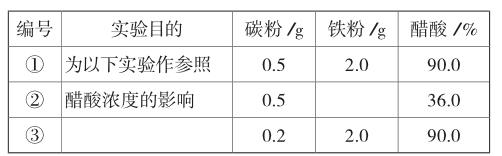
(2)编号①实验测得容器中压强随时间变化如图4。……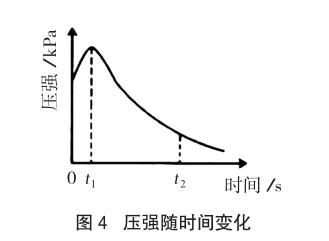
(3)该小组对图4中0~t1时压强变大的原因提出了如下假设,
请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二: ;……
该试题说明了在弱酸性条件下吸氧和析氢腐蚀是同时发生的,在教学中我们要正视这个问题,而且也是有必要向学生讲明的。在新课教学中可以通过演示例3中的数字化实验,得出图4的压强随时间变化图像,并将此实验结果作为新课教学中的一个教学资源由师生共同分析,以利于学生掌握金属腐蚀的基本原理。在教学中教师要综合考虑问题,尽量避免非此即彼的观念泛化的现象。
由于中学化学教学的阶段性,很多知识都是进行了简化处理。教师需要对教材中经过简化处理的概念和理论的背景知识有所了解。在苏教版《化学反应原理》教材中对化学反应速率的定义为“通常用单位时间内反应物浓度(常用物质的量浓度)的减少或者生成物浓度的增加来表示化学反应速率”[4]。并且说明“反应物或生成物的物质的量浓度可以用mol·L-1表示”[5]。在教学中很多教师没有关注到“通常”这两个字的含义,只是一味地介绍用物质的量浓度变化表示的化学反应速率,造成了教学的“死教”和学生的“死学”。
(2015广东理综,31题节选)用O2将HCl转化为Cl2,可提高效益,减少污染。(3)一定条件下测得反应过程中n(Cl2)的数据如下:
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程)。
化学反应的平均速率是单位时间内反应物的减少量或者生成物的增加量,其减少量或增加量可以是质量、气体体积或者是物质的量,当反应是在体积一定的密闭容器内进行的化学反应,则可以用单位时间内反应物浓度的减少或者生成物的浓度的增加来表示。上述两例就是很好的说明。
例5 (2014年福建理综,12题)在一定条件下,N2O分解的部分实验数据如下:
下图能正确表示该反应有关物理量变化规律的是 。正确答案如图5所示。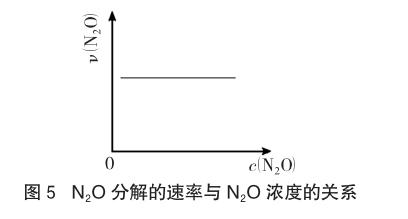


3 对理解教学的启示
当下的化学教学降低了对化学事实性知识的学习要求,而是以提高学生科学素养为主旨,突出对知识学习的过程与方法的体验和学科基本观念的形成。在教学过程中教师不能只是通过背诵、记忆具体事实及概念原理让学生对知识的理解停留在浅层次上,而是要让学生对可迁移的核心概念和对更为根本的学科知识结构进行深层次的理解。事实性知识只是促进学生深入理解化学核心概念和基本原理的载体与工具,在教学中要让具体知识的学习为学生学科观念和学科思想发展提供支撑,这样学生才能对知识有深层次和本质的理解。
例6 (2015广东理综,11题节选)一定温度下,水溶液中H+和OH-的浓度变化曲线如图6所示。
(2013年全国大纲卷,理综12题节选)下图(图7)表示水中c(H+)和c(OH-)的关系。
(2013山东理综,13题节选)某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH{pOH=-lg[OH-]}与pH的变化关系如图8所示,则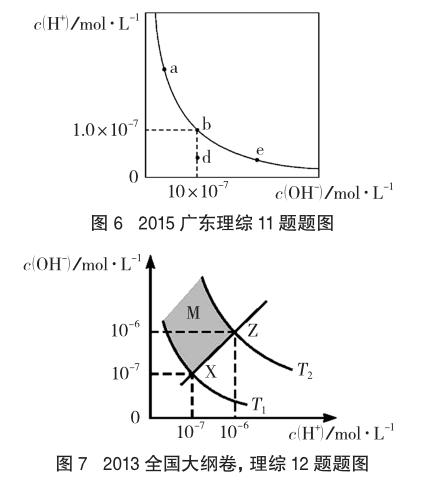

在溶液的酸碱性的教学过程中,为了要让学生理解掌握溶液酸碱性的本质,可以采用数学图像的手段。图6所表示的是同一温度下水溶液中c(H+)和c(OH-)之间的关系图,属于数学中的反比例函数图像,c(H+)和c(OH-)数值的相对大小决定了溶液的酸碱性。图7所表示的是不同温度下水溶液中c(H+)和c(OH-)之间的关系图,其中T1为常温下的关系图,T2为温度高于常温下(T1)的关系图,若温度低于常温则其c(H+)和c(OH-)关系图要低于常温下(T1)的关系图。象限的角平分线为中性线,在该线段上的点(X、Z)均为中性点,而在中性线的上方区域(M区)则为碱性区域,中性线的下方区域为酸性区域。为了加深学生对pH的理解,可以迁移类比到pOH。在图8中pH与pOH为一次函数曲线,同样,该曲线象限的角平分线为中性线,在该线段上的点均为中性点(Q点),而在中性线的上方区域(M点)则为酸性区域,中性线的下方区域(N点)为碱性区域。当图8中a=7时,是常温下的关系曲线,若高于常温,则曲线位于常温曲线的下方,若低于室温,则曲线位于常温曲线的上方。通过这一系列图像的分析,学生对溶液酸碱性的实质有了更深入的理解。
我们还可以借用哲学中的矛盾观来理解溶液的酸碱性,水溶液中的H+和OH-可以看作是一对矛盾,它们相互之间可以相互反应体现了矛盾的对立性和斗争性,同时它们又同时存在于水溶液中,不会出现某一方的单方面的消亡,这体现了矛盾的统一性,它们相互依存,存在着此消彼长的辩证关系。
H+代表着酸性,OH-代表着碱性,这是矛盾的两个方面,当c(H+)>c(OH-)时,酸性是矛盾的主要方面,而碱性是次要方面,即酸性是矛盾起主导作用的方面,所以显酸性,反之当c(OH-)>c(H+)时,碱性是矛盾的主要方面,而酸性是次要方面,即碱性是矛盾起主导作用的方面,所以显碱性,当c(H+)与c(OH-)相等时,则势均力敌,达到一种平衡,所以溶液显中性[7]。
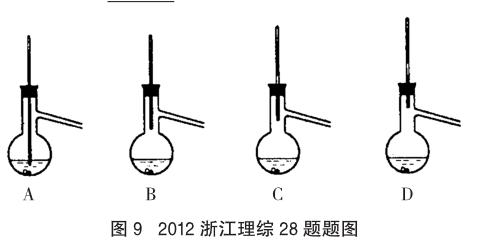
例7 (2012年浙江理综,28题节选)(6)粗产品蒸馏提纯时,下面装置中温度计位置正确的是 C ,可能会导致收集到的产品中混有低沸点杂质的装置是 A、B 。
(2014年全国新课标Ⅰ卷,理综26题节选)(6)在蒸馏操作中,仪器选择及安装都正确的是B (填标号)。
(2013年全国新课标Ⅰ卷,26题节选)(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C、D (填正确答案标号)。
A.圆底烧瓶 B.温度计
C.吸滤瓶 D.球型冷凝管 E.接收器
上述3道高考试题均考察了学生对蒸馏实验的理解程度,这些问题启示我们,如果在实验教学中只是告诉学生事实性知识,学生是很难真正理解这些事实存在的缘由的,就不会对实验有透彻的掌握。我们在实验教学中应该引导学生多去思考一些为什么,如实验中为什么要选用这样的仪器?该仪器为什么这样进行设计?为什么要这样进行操作?若不这样操作会产生怎样的结果?在分析讨论中学生对实验才能做到真正的掌握。如在蒸馏实验教学中,可由学生讨论如下问题:(1)蒸馏时温度计水银球的位置应在哪里?为什么?(2)若温度计的水银球过高或过低会对实验结果产生怎样的影响?为什么?(3)在蒸馏装置中冷凝的仪器选用直型冷凝管还是球型冷凝管?若采用球型冷凝管会产生怎样的结果?(4)蒸馏时若无蒸馏烧瓶能否进行蒸馏操作?可选用怎样的仪器?经过深度思考后,学生就不会把仪器的使用当作一种简单的、孤立的操作。学生就会思考自己所进行的每个操作怎样一步步达成实验目的,从而使自己的操作符合系统性和规范性要求。
4 对教学中体现学科价值的启示
化学是一门中心的、实用的、创造性的基础学科,化学学科的发展对人类文明的进步作出了巨大的贡献,在我们的教学中要责无旁贷地向学生渗透化学学科的价值,让学生认同和热爱化学这门学科。化学教学不仅要传授给学生基本的化学知识、技能和方法,更重要的是要让他们能从化学的视角去认识和关注科学、技术、社会和生活方面的问题。在高考中有很多将化学知识与生产、生活、社会、环境、能源、科技等方面相联系的试题,这类试题考查了学生在真实情境中应用化学知识和技能解决问题的能力。因有贴近社会生活的素材为背景、有体现可持续发展的思想为问点,对培养学生的化学价值观具有独特的功能和价值。
例8 (2015年四川理综,化学部分,第11题节选)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
(2015年浙江理综,28题节选)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有 (填编号)。
(2015年重庆理综,化学部分,第11题节选)我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是 。
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
上述几道试题中的情境素材体现了在循环使用资源、优化保护环境、改良创新技术、充分利用能源甚至考古等方面所涉及的化学知识,并且能够将考察的知识寓于实际问题中。在分析试题的过程中,通过对素材的关注可让学生领略和感受到学习化学的价值,在利用化学概念和原理与解决这些生产生活中的化学问题的过程中,不仅提高了学生解决实际问题的能力,通过引导还可使学生树立正确的化学价值观。在高考试题中的很多素材背景又可以拓展教师的视野,在平时教学中可以作为教学情境加以利用,不断地去充实教学资源。
当我们仔细去研读这些新课程高考下的试题时,总会让我们有着不一样的发现,总会给我们的教学带来思考。如果我们只是去关注这些题目的解法、考察的知识和能力,将会使我们错过它们所带给我们的精彩和对改善化学教学的启示。
参考文献:
[1]刘卉,陶国宏,邵元华,寇元.功能化的离子液体在电化学中的应用[J].化学通报,2004,(11):795.
[2]王喜然,刘海洋. NaCl对离子液体中电解精炼铝的影响[J].化学通报,2011,74(8):738~739.
[3][4][5]王祖浩主编.普通高中课程标准实验教科书·化学反应原理(选修)[M].南京:江苏教育出版社,2006:23,31.
[6]傅献彩,沈文霞,姚天扬,侯文华.物理化学[M].北京:高等教育出版社,2006:173.
[7]李晓明.“溶液的酸碱性”创新教学设计[J].中学化学教学参考,2015,(8):27
