模拟氨碱法制备纯碱实验的条件优化
2016-08-12张婷封享华丁世敏张杨
张婷 封享华 丁世敏 张杨
摘要:通过实验定量研究了吸收液浓度、温度、液面高度,通气速率、吸收方式等因素对氨碱法制备纯碱实验的影响,并优化了实验条件:吸收液体积比浓度为13:2,吸收液温度为42±1℃,采用18mm×180mm试管为吸收液容器,6mm×8mm×250mm玻璃管作为吸收导管,通气速率保持在240±10个气泡/min。实验条件优化后,能全面解决实验存在的问题,并使纯碱收率达49.2%。
关键词:氨碱法; 纯碱制备;实验条件优化;实验改进
文章编号:1005–6629(2016)6–0072–05 中图分类号:G633.8 文献标识码:B
1 问题的提出
模拟氨碱法制备纯碱的实验因为涉及到的知识点及操作较多,是高中化学非常好的课外设计实验的题材。但由于该实验的影响因素较多,在进行实验设计时难以确定实验条件,致使实际操作中存在诸多问题:一是实验过程中气路易堵塞,甚至导致气体回冲至滴液漏斗;二是实验时间长,通常需要3.5小时以上;三是纯碱收率低(由于条件控制的差异,其纯碱收率通常在15%~30%)。
多年来不少学者对该实验进行了研究[1~4]。如陈国钦老师认为,实验中CO2的吸收温度和吸收方式是影响实验的关键因素,认为吸收温度在38~50℃较适宜,并提出了一种吸收CO2的方式:“喷散式”,即将通气管末端(或烧制成尖嘴,要求平滑)与试管底部接触,通气时,较大的气体压力冲击试管底部,从而使气体分散成许多小气泡[5]。但对于吸收液浓度、液面高度,通气速率、吸收时间等对实验的影响研究却未见报道。本课题全面研究了多种因素对实验的影响,以期解决实验中存在的问题。
2 实验过程
2.1 实验原理
将NaCl溶于浓氨水中形成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液[6]。再将经过滤、洗涤得到的NaHCO3晶体加热分解制得Na2CO3。
2.2 实验材料与装置
2.2.1 实验材料
药品:NaCl晶体、浓氨水、CaCO3固体(大理石,块状,与盐酸反应每克能产生0.43g CO2)、浓盐酸、冰
仪器:托盘天平、250mL锥形瓶、滴液漏斗、100mL集气瓶、6mm×8mm玻璃管、各规格试管、200mL烧杯、温度计(100℃)、铁架台、酒精灯等
2.2.2 实验装置
2.3 实验方法
依据计算及反复多次的实验表明,NaCl用量为3.0g,既能节约药品,又能满足产品称量时对称量误差的要求;CaCO3采用块状及盐酸体积比浓度采用1:1更容易控制气流速率;吸收液体积确定为15.0mL,该体积适宜NaCl的用量及装置的要求;洗气瓶导管及吸收导管均采用6mm×8mm常规玻璃管。
(1)吸收液配制:称取3.0g NaCl多份,分别与不同浓度的浓氨水置于玻璃试管中混合溶解。
(2)按图1装配仪器,检查装置气密性。称取足量块状CaCO3置于锥形瓶中,将足量的1:1盐酸倒入滴液漏斗,将100mL蒸馏水置于集气瓶。加热烧杯中蒸馏水至一定温度。
(3)打开滴液漏斗活塞,通过控制稀盐酸滴加速率,保持集气瓶中匀速产生气泡,以集气瓶中气泡产生的个数度量通气速率(个/min)。
(4)一定时间后停止通气,将热水浴中热水换成冰-水混合体系,冷却一定时间。
(4)取出试管,过滤。将所得白色固体用冰水冷却的少量蒸馏水(每次3mL)洗涤2次。
(5)固体移至蒸发皿,用酒精灯加热并不断搅拌,直至全部变为白色粉末为止,冷却,称重,计算纯碱收率。
2.4 对照实验
2.4.1 吸收液浓度对实验的影响
吸收液碱性越强,越有利于溶液对CO2的吸收[7],且NaCl浓度和氨浓度越高,越有利于NaCl向NaHCO3的转化。因此,理论上CO2的吸收液应配成被NaCl饱和的浓氨水溶液。但是该溶液的配制存在一些问题,一是当氨水浓度较高时,NaCl在其中的溶解度无数据可查(NaCl在氨水中的溶解度随着氨水浓度的增大而下降[8]);二是溶解达到饱和的时间长,浪费时间。因此,应选择溶质浓度高,又能快速配制的吸收液。在相同条件下[吸收液温度42±1℃,喷散式,通气速率= 130±5个/min,t(吸收)=90min,t(冷却)=15min,18mm×180mm试管],按照浓氨水体积比浓度分别为10:5、12:3、13:2、14:1设计四组对照实验,得出最佳的吸收液浓度比。
2.4.2 吸收液温度对实验的影响
NH3和CO2的反应是一个放热反应,因此吸收液温度会对实验有一定的影响。实验设计在同一条件下[吸收液浓度为13:2,喷散式,通气速率=130±5个/min,t(吸收)=90min,t(冷却)=15min,18mm×180mm试管],测定不同吸收液温度下开始析晶的时间和纯碱收率。吸收液温度分别为32±1℃、37±1℃、42±1℃、47±1℃、52±1℃、 57±1℃。
2.4.3 吸收液冷却时间的确定
在进行“2.4.2”中吸收液温度为42±1℃的实验时,当反应气体通气结束后,取出试管,放入冰水中冷却,并将温度计插入吸收液,测定温度变化情况。
2.4.4 吸收液液面高度对实验的影响
从理论上判断,吸收液液面越高,气泡与吸收液接触的时间越长,越有利于提高CO2的利用率和单位时间内纯碱的收率。为研究该因素对实验的影响程度,在相同实验条件下[吸收液温度42±1℃,喷散式,通气速率=130±5个/min,t(吸收)=90min,t(冷却)=11min],实验设计选择18mm×180mm和25mm×200mm两种规格的试管作为反应容器,进行两组对比实验。
2.4.5 通入CO2速率对实验的影响
通气速率的大小会直接影响气液反应的接触面积,从而影响纯碱收率[9]。在相同条件下[吸收液温度42±1℃,喷散式吸收,t(吸收)=90min,t(冷却)=11min,18mm×180mm试管],实验设计三组不同的通气速率实验,通气速率(通过控制稀盐酸滴加速率,以集气瓶中气泡产生的个数度量通气速率)分别为130±5个/min、190±10个/min、240±10个/min。
2.4.6 吸收方式对实验的影响
气-液接触面积越大、接触时间越长,越有利于CO2的吸收。提高了CO2的利用率,就降低了实验成本和实验时间。实验室通常用6mm×8mm×250mm玻璃管作为通气导管,通气导管插入液相内部,气泡在液体内的上升过程中实现液体对气体的吸收,这种方式称为普通式。由于普通式产生的气泡体积大,比表面小,理论上对气体的吸收效率低。而喷散式可使气体分散成许多小气泡,大大增加了气泡的比表面,理论上可以提高气体吸收效率,从而提高反应速率。
在同一实验条件下[吸收液温度42±1℃,通气速率=240±10个气泡/min,t(吸收)=90min,t(冷却)=11min,18mm×180mm试管],实验采用三种吸收方式做比较。普通式,6mm×8mm×25cm玻璃管,内径6mm,导管口离试管底部0.5cm;6mm内径喷散式,6mm×8mm×25cm玻璃管,内径6mm;1.5mm内径喷散式,6mm×8mm×25cm玻璃管末端烧制成尖嘴,内径1.5mm。
2.4.7 冷却过程是否通入CO2对实验结果的影响
为研究冷却过程是否继续通气对纯碱收率有无影响,实验设计在同一条件下[吸收液温度42±1℃,喷散式,通气速率=240±10个/min,t(吸收)=90min,t(冷却)=11min,18mm×180mm试管],在冷却过程中继续通入CO2或不通入时,分别测定纯碱的收率。
2.4.8 通入CO2时间对实验的影响
实验设计在同一条件下[吸收液温度42±1℃,喷散式,通气速率=240±10个/min,t(冷却)=11min,18mm×180mm试管],通气时间分别为30min、60min、90min、120min时,分别测定纯碱收率。通气时间越长,纯碱收率越高,但90min后继续通气对纯碱收率贡献不大,从节约时间考虑,通气时间设置为90min最合适。
3 实验结果与分析
3.1 不同吸收液浓度的实验结果
通过四组不同浓度吸收液的对照实验,可以发现总体积为15.0mL的吸收液,随着吸收液中氨浓度的增加,初始析晶的时间就越短,纯碱收率就越高,但NaCl溶解所需时间也就越长,当吸收液氨水体积比浓度为14:1时,NaCl已不能全部溶解。综合时间和效率两个因素,选择氨水浓度为13:2的吸收液比较恰当。实验结果如表1所示。
3.2 不同吸收液温度的实验结果
吸收液温度越高,CO2、氨气在水中溶解度越小,且碳酸氢铵在36℃以上开始分解为CO2、氨气和水,60℃可以分解完全。因此,高温不利于NaHCO3晶体的生成;但温度低,质点运动速率慢,不利于CO2在气-液界面和液体内部的传质[10],CO2的吸收速率小,也不利于晶体的生成。实验结果表明,温度低于或高于42±1℃,开始析晶的时间变长,纯碱收率降低,故吸收液最佳反应温度为42±1℃。实验结果如图2所示。
3.3 吸收液冷却时间确定的实验结果
实验结果如图3所示,吸收液温度的降低主要发生在前3min,其后,温度降速变小,11min时降为0℃。建议吸收液的冷却时间为11min。
3.4 不同吸收液液面高度的实验结果
吸收液液面越高,气泡与吸收液接触的时间越长,就越有利于提高CO2的利用率和单位时间内纯碱的收率。表2表明,液面高度从4.0cm增加到10.0cm,开始析晶时间显著缩短,纯碱收率明显提高,因此,反应容器应采用18mm×180mm试管。
3.5 不同CO2通入速率的实验结果
实验结果(见表3)表明,通气速率越大,越有利于缩短开始析晶的时间,有利于提高纯碱收率。但通气速率大于240±10个气泡/min时,气泡会将液体冲出试管。所以,通气速率控制在240±10个气泡/min为宜。
3.6 不同吸收方式的实验结果
实验结果见表4所示,喷散式与普通式相比,同时产生的气泡个数显著增加,气泡直径显著减小,开始析出晶体的时间显著缩短,纯碱收率明显提高。对于不同内径的喷散式,内径越小,开始析出晶体的时间有所缩短,纯碱收率有所提高,但提高幅度不大。对于1.5mm内径喷散式,尖嘴内部容易析晶,导致堵塞,需要多次清理,去除堵塞物方能使实验有效进行,因此,采用6mm内径喷散式是合理的。
3.7 冷却过程是否通入CO2的实验结果
实验结果(见表5)表明,冷却过程是否通气对纯碱收率无明显影响。其原因是,降温过程主要发生在前3min,吸收液处在相对较高温度的时间段,温度越低,CO2的吸收速率越小,对纯碱收率的贡献越小。因此,建议冷却时不通气,以减少药品的消耗。
3.8 不同通气时间的实验结果
实验结果(见表6)表明,通气时间越长,纯碱收率越高,但90min后继续通气对纯碱收率的贡献不大,从节约时间考虑,通气时间设置为90min最合适。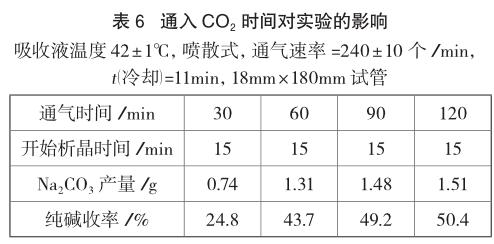
综上实验,优化实验条件后,纯碱最大收率可达49.2%。存在于母液中的NaCl未得到循环利用,NaHCO3的溶解损失(包括母液中的溶解和洗涤过程中的溶解)、NaHCO3在滤纸上的粘附、纯碱在蒸发皿上的粘附等也是影响纯碱收率的因素。
4 结论
(1)模拟氨碱法制备纯碱实验中,吸收液浓度、温度、液面高度,通气速率、吸收方式、吸收时间等因素都对纯碱收率产生较大的影响,而吸收液冷却过程中是否通入CO2对实验结果影响不大。
(2)实验最宜条件为:用3.0g NaCl与13.0mL浓氨水、2.0mL蒸馏水配成吸收液,所需1:1盐酸约180mL,块状CaCO3约45g,采用18mm×180mm试管为吸收液容器,6mm×8mm×250mm玻璃管作为吸收导管,采用喷散式吸收CO2,通气速率保持在240±10个气泡/min,吸收液温度控制在42±1℃,通气时间控制在90min,通气后吸收液的冷却时间控制在11min,且冷却过程不用通入CO2。在此条件下,实验总共耗时约为143min,通气15min后可见晶体析出,实验能使纯碱收率达到49.2%,可制备Na2CO3 1.48g。
(3)条件优化后,实验装置能平稳运行,实验时间显著缩短,纯碱收率明显提高。
参考文献:
[1][5]陈国钦.做好氨碱法实验的关键是什么[J].化学通报,1957,(8):57~59.
[2]王绪岩.联合制碱法反应原理的模拟实验设计[J].化学教学,2008,(5):12~13.
[3]刘怀乐.纯碱生产实验的秘诀[J].化学教学,2011,(1):48~49.
[4]陆丽洁,刘丽君.模拟工业制备纯碱的实验设计[J].化学教学,2014,(1):52~54.
[6]张晓鸥,张特逊.氨碱法和联碱法[J].中学化学教学参考,2001,(1~2):74.
[7][8]陈扬录.氨水溶液中氯化钠溶解度的计算[J].纯碱工业,1988,(3):57~58.
[9]伍强.饱和碳酸钠溶液和二氧化碳气体反应实验的研究[J].化学教学,2014,(8):57~59.
[10]武汉大学编.化学工程基础(第二版)[M].北京:高等教育出版社,2009:135~136.
