17β-雌二醇调控大鼠成肌细胞L6GNR4细胞迁移能力的机制研究
2016-08-12彭召红辛俊池王莉莉
吴 迪,彭召红,辛俊池,王莉莉
·论著·
17β-雌二醇调控大鼠成肌细胞L6GNR4细胞迁移能力的机制研究
吴迪,彭召红,辛俊池,王莉莉*
中国医科大学附属盛京医院实验研究中心,沈阳 110004
[摘要]目的研究17β-雌二醇对大鼠成肌细胞L6GNR4细胞迁移能力的调控作用及机制。方法L6GNR4细胞培养在含有10%胎牛血清的DMEM高糖增殖培养基中,培养基中添加10 nM雌激素17β雌二醇和/或50 nM雌激素竞争性拮抗剂Tamoxifen。应用细胞划痕试验在药物处理后0、12、24 h观察17β雌二醇对成肌细胞迁移能力的影响。在药物处理24 h后,应用荧光定量PCR技术检测各组细胞中雌激素受体α和β的表达。同时还检测了成肌细胞迁移相关关键基因(Pax3、Fhl1以及Fhl1相互作用蛋白Actg1、Myh10)在各组细胞中的表达情况。结果与对照组比较,17β-雌二醇在划痕24 h时可以明显抑制L6GNR4的细胞迁移。17β-雌二醇能够明显抑制ERβ的表达,而雌激素竞争性拮抗剂Tamoxifen能够部分逆转17β-雌二醇对ERβ的抑制作用。17β-雌二醇能够明显抑制成肌细胞迁移相关的关键因子Pax3、Fhl1以及Fhl1相互作用蛋白Myh10的表达,而雌激素竞争性拮抗剂Tamoxifen能够逆转或部分逆转17β-雌二醇对Pax3、Fhl1和Myh10的转录抑制作用。相同浓度的雌激素对L6GNR4细胞中Actg1的表达改变不明显。结论雌激素17β-雌二醇通过ERβ转录抑制Pax3、Fhl1以及Fhl1的相互作用蛋白Myh10的表达,发挥其抑制大鼠成肌细胞迁移的作用。
[关键词]17β-雌二醇;L6GNR4成肌细胞;细胞迁移
0 引言
骨骼肌组织是人体含量最多的肌肉组织,其构成和大小存在着明显的性别差异。雌激素(17β-estradiol,E2)与雌激素受体(Estrogen receptor,ER)的配体结合结构域-雌激素受体反应元件结合后,发挥其调控靶基因转录的作用[1]。骨骼肌表达雌激素受体ERα和ERβ[2]。因此,雌激素可能在胚胎期肌肉发生、出生后骨骼肌发育以及骨骼肌损伤修复过程中发挥重要作用。肌肉发生指在胚胎发育过程中,体节细胞经过一系列增殖、迁移和分化,最终形成肌肉组织的过程[3]。①由胚胎的体节细胞出现细胞决定(分化方向),并分化为成肌细胞。②成肌细胞向胚胎肢芽迁移并保持增殖能力。③成肌细胞停止分裂,彼此融合成多核体细胞,并表达肌纤维特异性的肌球蛋白,使其分化为成熟的骨骼肌细胞。肌肉发生还包括了成体肌肉干细胞-骨骼肌卫星细胞的激活、分化、融合和成熟等过程。机体遇到肌肉损伤等刺激时,骨骼肌卫星细胞被激活,增殖并分化为成肌细胞。这些细胞再分化并融合进已存在的骨骼肌纤维中,或者彼此融合,形成新的肌纤维。L6GNR4细胞是来自大鼠骨骼肌的成肌细胞,其作为研究胚胎期肌肉发生和骨骼肌损伤修复的工具细胞,具有广阔的应用前景和实用价值。目前,有关雌激素对成肌细胞迁移功能的影响的相关研究很少。因此,本研究应用17β-雌二醇处理大鼠L6GNR4成肌细胞,观察其对成肌细胞迁移能力的影响及可能的机制。
1 材料与方法
1.1材料L6GNR4大鼠成肌细胞购自上海中科院细胞库,17β雌二醇和雌激素竞争性拮抗剂Tamoxifen购自Sigma公司,定量PCR相关试剂购自TAKARA公司,细胞培养用血清和培养基等购自Gibco公司。
1.2细胞培养L6GNR4细胞培养在含有10%胎牛血清的DMEM高糖增殖培养基中,后者添加雌激素17β雌二醇和/或雌激素竞争性拮抗剂Tamoxifen。每组细胞重复实验3次。根据Ogawa等[4]报道,本研究在成肌细胞培养基中添加10 nM 17β雌二醇和50 nM Tamoxifen。
1.3细胞划痕实验接种前用marker笔在6孔板背面画横线标记,拍照时定位同一个视野。每组细胞消化后接入6孔板,细胞长满板底后,用20 μL枪头垂直于孔板制造细胞划痕。吸去细胞培养液,用PBS冲洗孔板3次,洗去划痕产生的细胞碎片。加入无血清培养基,不同时间点拍照记录。
1.4定量PCR用TRIZOL试剂提取各组细胞的总RNA。用反转录酶和Olingo (dT) 20引物合成cDNA。定量PCR的引物序列见表1。在定量PCR过程中,每个基因重复扩增3次,基因的相对表达水平应用2-△△ct方法计算。PCR产物经2%琼脂糖胶分离并拍照。
1.5统计学分析应用SPSS 10.0软件统计分析各组细胞间基因表达水平是否存在差异。
2 结果
2.117β-雌二醇抑制大鼠成肌细胞L6GNR4细胞迁移在细胞划痕实验中,连续观察24 h 17β-雌二醇对大鼠成肌细胞L6GNR4迁移能力的影响,结果显示,与对照组比较,17β-雌二醇在划痕24 h时,可以明显抑制L6GNR4的细胞迁移(见图1)。细胞划痕实验重复3次,每次的实验结果一致。2.217β-雌二醇抑制大鼠成肌细胞L6GNR4中ERβ的表达大鼠成肌细胞L6GNR4中,有雌激素受体ERα和ERβ的表达,并且以ERβ为主(ERα相对表达水平为1时,ERβ的相对表达水平为3.05±0.55)。各组细胞ERα的相对表达水平比较差异无统计学意义(数据未显示)。对照组、E2组、Tam组、E2+Tam组细胞ERβ的相对表达水平分别为0.99±0.005、0.17±0.09、0.78±0.02、0.38±0.01。结果显示,17β-雌二醇能够明显抑制ERβ的表达(对照组 vs.E2组,P=0.0020),而Tamoxifen能够部分逆转17β-雌二醇对ERβ的抑制作用(E2组 vs.E2+Tam组,P=0.0199)。

图1 17β-雌二醇抑制大鼠成肌细胞L6GNR4细胞迁移
2.317β-雌二醇抑制大鼠成肌细胞L6GNR4中调节细胞迁移的关键基因的表达为了探索17β-雌二醇抑制大鼠成肌细胞L6GNR4细胞迁移的机制,对成肌细胞迁移相关的关键因子Pax3和Fhl1以及Fhl1相互作用蛋白Actg1、Myh10在各组细胞中mRNA的表达水平[4]。Pax3相对表达水平:对照组1.00±0.09,E2组0.51±0.05,Tam组1.20±0.06,E2+Tam组1.21±0.03(对照组 vs.E2组,P=0.000 1;E2组 vs.E2+Tam组,P=0.002 7)。Fhl1的相对表达水平:对照组1.00±0.12,E2组0.37±0.12,Tam组0.97±0.00,E2+Tam组1.00±0.05(对照组 vs.E2组,P=0.0305;E2组 vs.E2+Tam组,P=0.029 4)。Actg1的相对表达水平:对照组1.00±0.03,E2组0.81±0.12,Tam组0.99±0.03,E2+Tam组1.02±0.08(对照组 vs.E2组,P=0.050 8;E2组 vs.E2+Tam组,P=0.059 7)。Myh10的相对表达水平:对照组1.00±0.03,E2组0.03±0.01,Tam组0.98±0.11,E2+Tam组0.56±0.01(对照组 vs.E2组,P=0.0003;E2组 vs.E2+Tam组,P=0.0046)。结果显示,17β-雌二醇能够明显抑制成肌细胞迁移相关的关键因子Pax3、Fhl1及Myh10的表达(P<0.05),而Tamoxifen能够逆转17β-雌二醇对Pax3、Fhl1的转录抑制作用。同时Tamoxifen能够部分逆转17β-雌二醇对Myh10的转录抑制作用。相同浓度的雌激素对L6GNR4细胞中Actg1的表达改变不明显,见图2、图3。
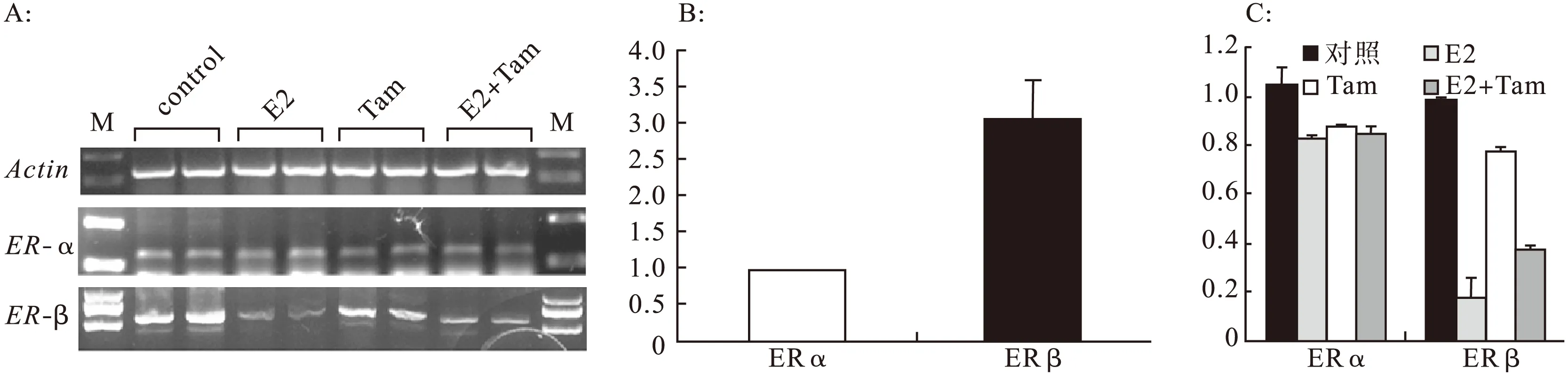
图2 17β-雌二醇抑制大鼠成肌细胞L6GNR4ERβ的表达
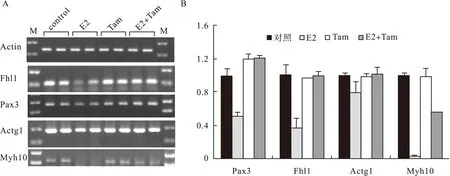
图3 17β-雌二醇抑制大鼠成肌细胞L6GNR4中关键细胞迁移相关因子的表达

基因引物序列长度(bp)复性温度(℃)ActinGGAGATTACTGCCCTGGCTCCTAGACTCATCGTACTCCTGCTTGCTG13956ERαCGATGGTGCATTGGTTTGTGAGACTCGCTACTGTGCTGTG14160ERβGCCCTTGTTACTGATGTGCCATGCCCTGGTCTGGGTGATT11260Pax3CTGCTCTGCGGTGAAGGTGGAGGAGGAGGCGGATTTAG19160Fhl1CGTGCCAGTAGCGATTCTTATGCTGCCTGAAGTGCTTTGAC10756Actg1AATGCCGTGCTCAATAGGGTCGCAATGGAAGAAGAAATCG22960Myh10ACTTGCCAAAGCGAGATGAGACAAAGGAAGAAAGGACCAC12960
3 讨论
雌激素和ERα的配体结合结构域-雌激素受体反应元件结合后发挥其调控靶基因转录的作用。而ERβ不仅能和雌激素受体反应元件结合发挥其转录因子的作用,还能够以不依赖配体结合的方式发挥其作用[2]。ERα和ERβ竞争性地结合同一个雌激素受体反应元件,或者特异地结合在不同雌激素受体反应元件上,因此其在调控基因表达的功能上也不相同[5-6]。大鼠成肌细胞L6GNR4中有雌激素受体ERα和ERβ的表达,并且以ERβ为主。研究表明,17β-雌二醇可以抑制成肌细胞中骨骼肌分化标记物(Myosin heavy chain,MHC)、Tropomyosin和Myogenin的表达水平,并且可以抑制成肌细胞融合形成肌管的过程[7]。但Galluzzo等[8]研究结果表明,17β-雌二醇可以提高大鼠成肌细胞L6GNR4中Myogenin和MHC的表达。17β-雌二醇还可以通过PI3K/Akt信号通路抑制成肌细胞的凋亡[9]。目前,关于雌激素对成肌细胞迁移功能影响的相关研究很少。因此,本研究应用17β-雌二醇处理大鼠成肌细胞,观察其对成肌细胞迁移能力的影响及可能的机制。
在细胞划痕实验中,笔者连续观察24 h 17β-雌二醇对大鼠成肌细胞L6GNR4迁移能力的影响,结果显示,17β-雌二醇在划痕24 h时,可以明显抑制L6GNR4的细胞迁移。同时,检测17β-雌二醇对成肌细胞中不同雌激素受体亚型和调节细胞迁移的关键基因(Pax3、Fhl1等)表达的影响。结果表明,17β-雌二醇能够明显抑制ERβ的表达,而Tamoxifen能够部分逆转17β-雌二醇对ERβ的抑制作用。17β-雌二醇能够明显抑制成肌细胞迁移相关的关键因子Pax3、Fhl1及Myh10的表达,而Tamoxifen能够逆转或部分逆转17β-雌二醇对Pax3、Fhl1及Myh10的转录抑制作用。
Pax3、Fhl1及Myh10在骨骼肌发育中发挥重要作用。在胚胎期,肌肉前体细胞从轴旁体节迁移至其他形成肌肉组织的部位,如:肢体。肌肉前体细胞的迁移在肌肉发生中发挥重要作用,而Pax3通过调节c-Met参与调节肌肉前体细胞的迁移过程[10-11]。在小鼠骨骼肌So18细胞中,重组表达的Fhl1可以调节integrin介导的细胞骨架的重排。细胞表面integrin激活直接导致细胞骨架actin重组,同时伴有粘着斑复合物和弹力纤维的形成。在成肌细胞中GFP-Fhl1的过表达可以通过-5-1-integrin特异地抑制成肌细胞粘附力,并提高细胞的扩散和迁移能力[12]。Non-muscle myosin 2B(Myh10)和actin细胞骨架的结合在细胞的运动、黏附和细胞形态的维持中发挥重要作用[13-14]。有关Non-muscle myosin在骨骼肌发育中的作用的相关研究很少。有研究表明,在成肌细胞中,non-muscle myosins 2A/2B和actin的相互作用能够改变成肌细胞的形态、黏附和运动能力。此外,non-muscle myosin 2B敲除后,可以明显抑制成肌细胞的尾部收缩,增加细胞长度,干扰肌管形成过程中细胞核的重分布[15]。
综上所述,雌激素17β-雌二醇通过ERβ转录抑制Pax3、Fhl1及Myh10的表达,以发挥抑制大鼠成肌细胞迁移的作用。
参考文献:
[1]Vivar OI,Zhao X,Saunier EF,et al.Estrogen receptor beta binds to and regulates three distinct classes of target genes[J].J Biol Chem,2010,285(29):22059-22066.
[2]Wiik A,Ekman M,Johansson O,et al.Expression of both oestrogen receptor alpha and beta in human skeletal muscle tissue[J].Histochem Cell Biol,2009,131(2):181-189.
[3]Wang LL,Peng ZH,Fan Y,et al.Dynamic expression of molecules that control limb muscle development including Fhl1 in hind limbs of different gestational age[J].APMIS,2014,122(9):766-771.
[4]Wang L,Miao J,Li L,et al.Identification of an FHL1 protein complex containing gamma-actin and non-muscle myosin IIB by analysis of protein-protein interactions[J].PLoS One,2013,8(11):e79551.
[5]Hayashi SI,Eguchi H,Tanimoto K,et al.The expression and function of estrogen receptor alpha and beta in human breast cancer and its clinical application[J].EndocrRelat Cancer,2003,10(2):193-202.
[6]Lazennec G,Bresson D,Lucas A,et al.ER beta inhibits proliferation and invasion of breast cancer cells[J].Endocrinology,2001,142(9):4120-4130.
[7]Ogawa M,Yamaji R,Higashimura Y,et al.17β-estradiol represses myogenic differentiation by increasing ubiquitin-specific peptidase 19 through estrogen receptor α[J].J Biol Chem,2011,286(48):41455-41465.
[8]Galluzzo P,Rastelli C,Bulzomi P,et al.17beta-Estradiol regulates the first steps of skeletal muscle cell differentiation via ER-alpha-mediated signals[J].Am J Physiol Cell Physiol,2009,297(5):1249-1262.
[9]La Colla A.Vasconsuelo AA.Boland R.Estradiol exerts antiapoptotic effects in skeletal myoblasts via mitochondrial PTP and MnSOD[J].J Endocrinol,2013,216(3):331-341.
[10]Birchmeier C,Brohmann H.Genes that control the development of migrating muscle precursor cells[J].Curr Opin Cell Biol,2000,12(6):725-730.
[11]Buckingham M,Relaix F.PAX3 and PAX7 as upstream regulators of myogenesis[J].Semin Cell Dev Biol,2015,44:115-125.
[12]Robinson PA,Brown S,Mc Grath MJ,et al.Skeletal muscle LIM protein 1 regulates integrin-mediated myoblast adhesion,spreading,and migration[J].Am J Physiol Cell Physiol,2003,284(3):681-695.
[13]CramerLP.Organization and polarity of actin filament networks in cells:implications for the mechanism of myosin-based cell motility[J].BiochemSoc Symp,1999,65:173-205.
[14]Conti MA,Adelstein RS.Nonmuscle myosin II moves in new directions[J].J Cell Sci,2008,121(Pt 1):11-18.
[15]Swailes NT,Colegrave M,Knight PJ,et al.Non-muscle myosins 2A and 2B drive changes in cell morphology that occur as myoblasts align and fuse[J].J Cell Sci,2006,119(Pt 17):3561-3570.
收稿日期:2016-03-22
基金项目:国家自然科学基金(81100434,81471466)
*通信作者
DOI:10.14053/j.cnki.ppcr.201607001
Mechanism of 17β-estradiol regulating the migration of L6GNR4 myoblast
WU Di,PENG Zhao-hong,XIN Jun-chi,WANG Li-li*
(Medical Research Center,Shengjing Hospital of China Medical University,Shenyang 110004,China)
[Abstract]ObjectiveTo investigate the effect of 17β-estradiol on the migration of L6GNR4 myoblast and discuss the molecular mechanism.MethodsL6GNR4 cells were cultured in high-glucose DMEM containing 10 nM 17β-estradiol and/or 50 nM tamoxifen.The effect of 17β-estradiol on the migration of L6GNR4 myoblasts was detected by Wound-healing assays at 0 h,12 h and 24 h after medication.The expression levels of ER and key genes involved in myoblast migration (Pax3,Fhl1,Fhl1 interactor-Actg1 and Myh10) were examined by real-time RT-PCR in each group.Results17β-estradiol inhibited the migration of myoblast after 24 h and down-regulated the expression of ERβ,Pax3,Fhl1 and Myh10 which could be totally or partly reversed by tamoxifen,while the same dose of estrogen has no obvious effect on Actg1 expression in L6GNR4.Conclusion17β-estradiol can inhibit the expression of Pax3,Fhl1 and Myh10 by ERβ-mediated transcription,thus restraining the L6GNR4 myoblast migration
Key words:17β-estradiol;L6GNR4 myoblast;Migration
