植物激素对大花蕙兰丛生芽增殖与生长的影响
2016-08-12王育选任建宏王鹏丽赵娟
王育选,任建宏,王鹏丽,赵娟
(山西农业大学 农学院,山西 太谷 030801)
植物激素对大花蕙兰丛生芽增殖与生长的影响
王育选,任建宏,王鹏丽,赵娟*
(山西农业大学 农学院,山西 太谷 030801)
摘要:[目的] 研究不同种类、浓度及配比的植物激素对大花蕙兰丛生芽增殖与生长的影响。[方法]以大花蕙兰试管苗为外植体,接种于附加不同种类、浓度及配比植物激素的MS培养基中进行培养。[结果]不同浓度6-BA、KT、ZT与同一浓度NAA(0.2 mg·L-1)配比时,均可诱导大花蕙兰不定芽分化丛生芽,实现增殖,但增殖倍率和苗的生长情况存在差异,其中以培养基为MS+6-BA 3 mg·L-1+NAA 0.2 mg·L-1时,大花蕙兰丛生芽增殖倍率最高,达3.57倍,且丛生芽生长健壮,叶片浓绿;在附加ZT的培养基中,丛生芽增殖倍率低,最高为2.07倍,且丛生芽生长较慢,不够健壮,但试管苗不易褐化。同一浓度BA(3 mg·L-1)与不同浓度IBA配比时,以IBA 1.0 mg·L-1时丛生芽增殖倍率略低,为2.03倍,但苗生长健壮,可直接成苗。[结论]不同植物激素对大花蕙兰丛生芽增殖和生长的影响不同,其最适宜培养基为MS+6-BA 3 mg·L-1+NAA 0.2 mg·L-1。
关键词:大花蕙兰;丛生芽;植物激素;增殖倍率
大花蕙兰(Cymbidiumhybridium)又名西姆比兰、虎头兰、蝉兰,为兰科兰属植物,是世界五大重要商品兰花之一,具有很高的观赏价值和经济价值,市场需求量大[1]。由于兰花结实率低,分株能力弱,以传统的有性、无性繁殖方法扩繁植株速度较慢,不能满足大规模商品化生产的需求,利用植物组织培养技术快速繁殖兰花可以极大提高其繁殖率,加速繁育速度,缩短育种周期,实现规模化生产[2,3]。
目前,大花蕙兰组织培养的相关报道中,多数研究是由外植体分化原球茎后,通过原球茎增殖实现其快速繁殖[4~6],此途径的发生过程需要外植体经历脱分化和再分化,增加了原球茎再生植株的变异率。由丛生芽增殖途径快繁材料,具有繁殖速度快、再生植株遗传性状稳定的特点,此途径已在蝴蝶兰的快速繁殖[7,8]上获得成功。因此,利用丛生芽增殖途径实现大花蕙兰快速繁殖,在短期内提供大量遗传性状一致的再生植株,对推广大花蕙兰新品种、满足其商品化生产的需求具有重要的应用价值。本研究通过添加不同浓度和种类的多种植物激素,研究其对大花蕙兰丛生芽增殖与生长的调控作用,以期获得促进大花蕙兰丛生芽增殖和生长的最适宜激素浓度,为其大量快速繁殖提供依据。
1 材料与方法
1.1试验材料
大花蕙兰(Cymbidiumhybridium)试管苗由山西农业大学农学院植物组织培养实验室前期试验获得。
1.2试验方法
1.2.1外植体的选取
以大花蕙兰生长健壮试管苗为外植体,切取不定芽(从基部与老假鳞茎相连处切断),接种于不同培养基中。
1.2.2不同浓度和种类植物激素配比设置
以MS为基本培养基,添加不同浓度6-BA、KT、ZT分别与NAA 0.2 mg·L-1(前期试验筛选的适宜浓度)配比,每个处理接种10瓶,每瓶接种
3个材料,40 d后,统计丛生芽的增殖和生长情况。
1.2.3培养基和培养环境
本试验所用培养基均以MS培养基为基本培养基,附加蔗糖30 g·L-1,琼脂6 g·L-1, pH值调节至5.6~5.8,121 ℃高压灭菌20 min。培养温度(25±2) ℃,光照16 h·d-1,光照强度2 000~3 000 Lx。
1.3数据统计
增殖倍率=分化出的丛生芽总数/接种数,试验采集的数据均由DPS 7.05软件进行数据分析。
2 结果与分析
2.16-BA与NAA配比对大花蕙兰增殖的影响
由表1可见,在附加NAA 0.2 mg·L-1的MS培养基中添加不同浓度的6-BA,接种材料培养40 d后,不定芽在所设培养中均可分化出丛生芽,实现增殖,但丛生芽的增殖倍率和生长情况有差异。随着6-BA浓度的增加,丛生芽增殖倍率呈现先升后降的趋势,其浓度为3 mg·L-1时,增殖倍率最高,达3.57倍,且苗生长较健壮,叶片嫩绿;当6-BA浓度的提高至4 mg·L-1,不仅丛生芽增殖倍率下降,而且苗生长细弱,出现部分畸形苗。此外,在所设培养基中培养的丛生芽均出现较明显地褐化现象。综合考虑,在 MS培养基中附加6-BA 3 mg·L-1与NAA 0.2 mg·L-1配比时,可作为诱导大花蕙兰丛生芽增殖与生长的适宜培养基(图1)。
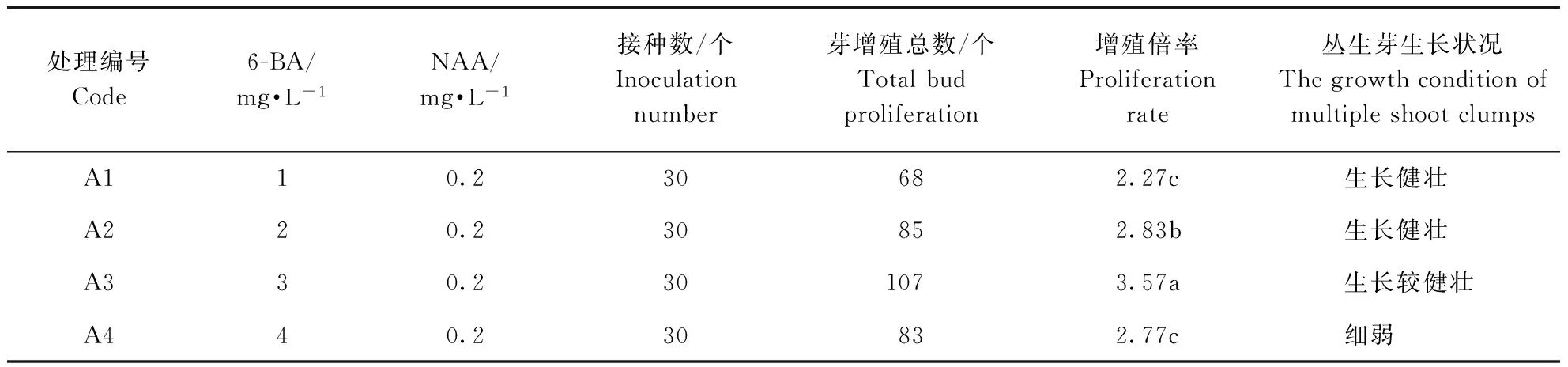
表1 不同6-BA/NAA配比对大花蕙兰丛生芽增殖与生长的影响
注:同列不同小写字母表示差异显著(p<0.05)。表2~表4同。
Note:Different lowercase letters show significant difference at the 0.05 level in the same column. The same in Table 2~4.

图1 6-BA与NAA配比对大花蕙兰增殖的影响Fig.1 Effect of different 6-BA/NAA concentration on the proportion and growth of Cymbidium hybridium
2.2KT与NAA配比对大花蕙兰增殖的影响
由表2可见,在MS+NAA 0.2 mg·L-1基本培养基上添加不同浓度的KT,培养40 d后,接种的不定芽也可分化丛生芽;增殖倍率的变化趋势与附加6-BA时一致,先升高后下降。KT浓度为3 mg·L-1时,增殖倍率最高,达到2.53倍,且苗生长较健壮;当KT浓度为4 mg·L-1时,丛生芽增殖率下降,在所设培养基中附加KT时的芽增殖倍率均低于附加相同浓度的6-BA。当KT浓度小于3 mg·L-1时,丛生芽生长健壮,叶片嫩绿;随着KT浓度的提高,增殖苗生长受抑,出现比较明显的褐化现象,部分叶片发黄。在所设置培养基中,以MS+KT 3 mg·L-1+NAA 0.2 mg·L-1为好,不定芽增值率较高,苗生长良好。
2.3ZT与NAA配比对大花蕙兰丛生芽增殖与生长的影响
由表3可见,不同浓度ZT与NAA配比时,随着ZT浓度的增加,不定芽增殖倍率逐渐增加,但各浓度之间差异不显著,且苗长势一般,较细弱。与相同浓度6-BA、KT与NAA的配比相比,不同浓度的ZT与NAA配比时,大花蕙兰丛生芽增殖倍率较低,且分化出的丛生芽生长较慢,苗不如前两者健壮,但在附加不同浓度ZT的培养基中,均未见丛生芽出现明显的褐化现象(图2)。
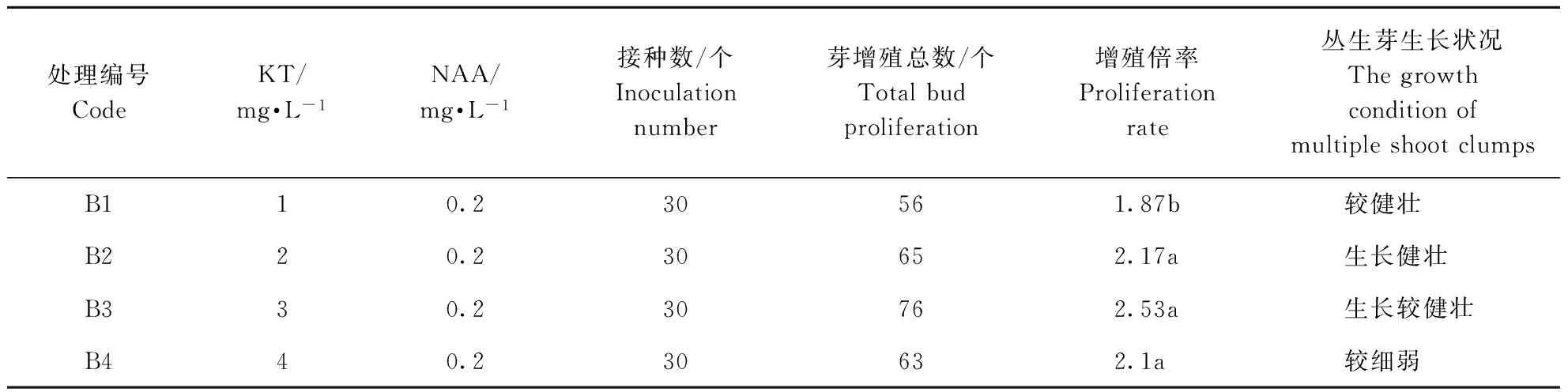
表2 不同KT/NAA配比对大花蕙兰幼苗增殖培养的影响
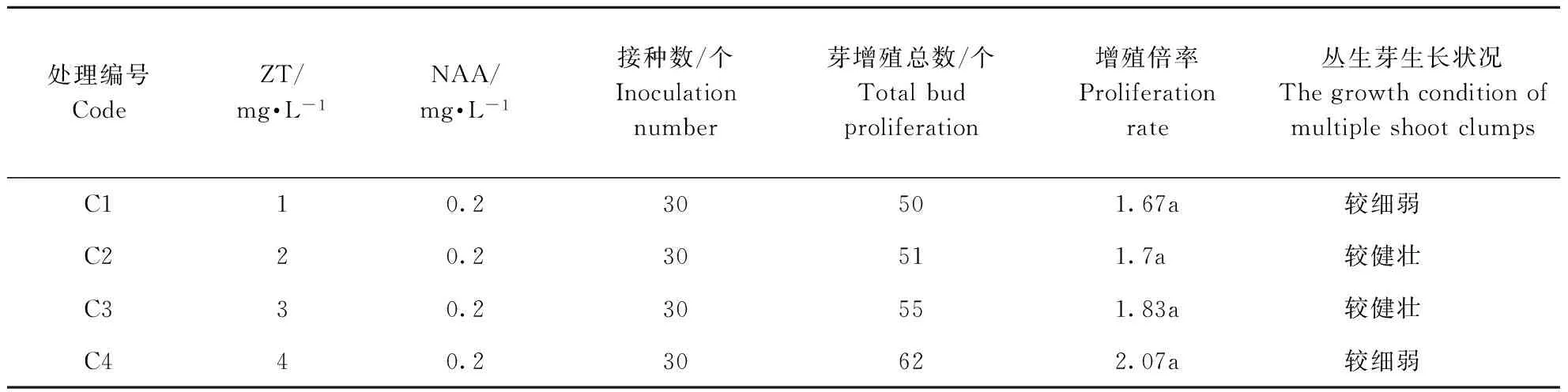
表3 不同ZT/NAA配比对大花蕙兰幼苗增殖培养的影响
2.46-BA与IBA配比对大花蕙兰丛生芽增殖与生长的影响
由表4可见,在MS+6-BA 3 mg·L-1基本培养基上添加不同浓度的IBA,随着IBA浓度的增加,不定芽增殖倍率逐渐增加,但各组合间差异不大,分化出的丛生芽长势良好,叶片嫩绿;与使用6-BA与NAA配比时相比,增殖倍率偏低,但丛生芽生长健壮,可直接成苗(图3)。

图2 添加不同细胞分裂素对大花蕙兰褐化程度的影响Fig.2 Effect of different cytokinin on the browning rate of Cymbidium hybridium
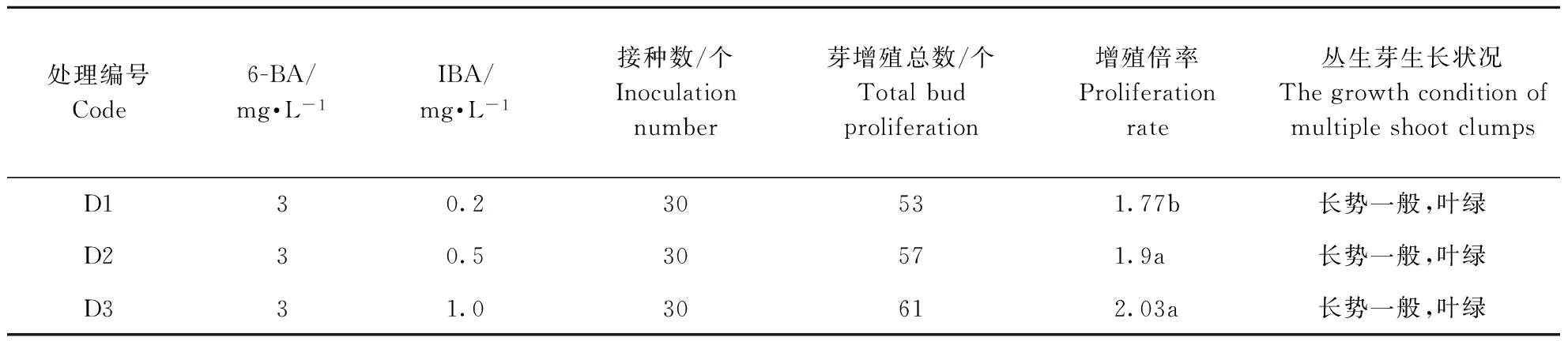
处理编号Code6-BA/mg·L-1IBA/mg·L-1接种数/个Inoculationnumber芽增殖总数/个Totalbudproliferation增殖倍率Proliferationrate丛生芽生长状况ThegrowthconditionofmultipleshootclumpsD130.230531.77b长势一般,叶绿D230.530571.9a长势一般,叶绿D331.030612.03a长势一般,叶绿

图3 6-BA与IBA配比对大花蕙兰增殖的影响Fig.3 Effect of different 6-BA/IBA concentration on the proportion and growth of Cymbidium hybridium
3 讨论与结论
一般在兰科植物的离体培养中,培养基中激素(尤其是细胞分裂素和生长素)的种类与配比是调控丛生芽分化与生长的关键[9]。生长素抑制侧芽萌发,维持植株的顶端优势,而细胞分裂素却可消除顶端优势,促进侧芽生长。当生长素比例高于细胞分裂素时,主要诱导植物生根或形成愈伤组织;当细胞分裂素比例高于生长素浓度时,主要诱导不定芽的发生和再分化[10]。现有关于大花蕙兰组织培养的研究表明,低浓度细胞分裂素(0.8 mg·L-1)可促进原球茎的分化,而较高浓度的细胞分离素(1 mg·L-1以上)可以诱导丛生芽分化[11~13]。本试验的研究结果表明,较高浓度的6-BA、KT、ZT(1~4 mg·L-1)分别与相同浓度的NAA配比,均可诱导大花蕙兰不定芽分化丛生芽,实现增殖,但三者对丛生芽增殖与生长的影响存在差异。其中,6-BA促进增殖效果最佳,丛生芽生长健壮,叶片浓绿;KT促增殖效果略低于BA,丛生芽长势较好,叶片嫩绿;ZT促增殖效果最差,且不同浓度的ZT与NAA配比对大花蕙兰丛生芽增殖与生长的影响差异不显著,不同种类细胞分裂素对丛生芽增殖的影响为6-BA>KT>ZT。使用6-BA与KT时,都是浓度为3 mg·L-1时,增殖倍率最高。随着浓度的提高,增殖率反而下降。这可能是因为细胞分裂素在一定浓度范围内对植物生长起促进作用,当其浓度过高时则抑制芽的发生,使细胞体积因强烈的活动而急剧缩小,导致已形成的芽不能正常萌发生长。ZT也能促进不定芽分化丛生芽,但作用效果不如6-BA和KT[14]。
IBA也是常用的生长素,在某些植物的离体培养中,IBA较NAA更有利于丛生芽的增殖与生长。但在本试验中,不同浓度的IBA与6-BA配比对丛生芽增殖的影响较小,但丛生芽生长健壮,叶片嫩绿。因此,可根据研究和生产的具体目的和要求选择不同的激素配比来诱导大花蕙兰丛生芽增殖。
另外,由于兰花组织中的多酚氧化酶活性较强,易积累大量酚类物质而导致植株褐化。褐化过程中,植物组织中的酚类物质被氧化为醌类物质并逐渐扩散到培养基中,毒害所培养的材料,导致其褐化死亡[15]。研究表明,兰花启动培养后,3/4植株因褐化死亡[16]。因此防止和减少褐化一直是兰花快速繁殖过程的关键问题之一。本研究中,附加ZT的培养基中幼苗增殖倍率较低,但培养过程中没有出现明显褐化,而在添加6-BA、KT的培养基中均出现不同程度的褐化。因此可知,培养材料的褐化程度与培养基中添加的细胞分裂素的种类密切相关,如何能更好的通过调控激素的配比和使用来控制不定芽的生长分化及褐化程度,还有待进一步研究。
参考文献
[1]范成明,李枝林,何月秋.兰花组织培养及分子生物学研究进展[J].园艺学报,2003,30(4):487-491.
[2]邹宗兰,秦庭豪,文颖.大花蕙兰工厂化繁殖技术研究[J].西南农业学报,2007,20(4):743-746.
[3]杨录军,李晓青.大花蕙兰组培工厂化生产技术[J].北方园艺,2007(8):186-187.
[4]张树珍,曾宪松,张银东.大花蕙兰的组织培养[J].热带作物研究,1995(4):26-28..
[5]谢利,马晓娟,郭和蓉,等.杂交兰类原球茎增殖中芽分化的控制和快速繁殖[J].植物生理学报,2014,50(2):209-213.
[6]周音,张建军,殷丽青.植物生长调节剂对个大花蕙兰品种类原球茎及不定芽诱导的影响[J].上海农业学报,2013,29(1):15-17.
[7]刘荣维,梅庆超,崔元方.丛生芽—蝴蝶兰无性快速繁殖新途径[J].热带作物学报,1993,14(2):105-107.
[8]谭文澄,戴策刚.观赏植物组织培养技术[M].北京:中国林业出版社,1991:60-65.
[9]柳俊,谢从华.植物细胞工程.2版.[M].北京:高等教育出版社,2011:33-36.
[10]黄学林,李筱菊.高等植物组织离体培养的形态建成及其调控[M].北京:中国农业出版社,1992:65-68.
[11]韩明,李晏萍,潘学峰.利用丛生芽增殖途径对大花蕙兰进行离体快繁[J].热带生物学报,2012,3(3):261-266.
[12]张晨晨,余家平,蒋琳.大花蕙兰高频再生体系的研究[J].植物学生理通讯,2007,43(6):1101-1104.
[13]樊家荣,孟想想,曹可.大花蕙兰组培快繁技术研究[J].生物学杂志,2014,31(6):99-102.
[14]徐宏英,赵玉明,谢海军.大花蕙兰组织培养快繁影响因素分析[J].园艺学报,2002,29(2):183-185.
[15]李友勇,李秀菊.应用生物技术[M].北京:中国农业科技出版社,2004:59-60.
[16]周音,张建军,殷丽青.复合抗氧化剂对大花蕙兰组织培养的影响[J].上海农业学报,2013,29(2):14-16.
(编辑:马荣博)
收稿日期:2016-05-19 修回日期:2016-06-09
作者简介:王育选(1968-),男(汉),实验师,研究方向:植物组织培养 *通讯作者:赵娟,博士,副教授,硕士生导师。Tel:13834836658;E-mail:sxndzhaojuan@163.com
基金项目:山西省科技攻关项目(20130311014-1) ;山西农业大学博士科研启动项目(2012YJ13)
中图分类号:S644.1
文献标识码:A
文章编号:1671-8151(2016)09-0628-05
Effect of phytohormone on the proliferation and growth of clustered shoots inCymbidiumhybridium
Wang Yuxuan, Ren Jianhong, Wang Pengli, Zhao Juan*
(CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China)
Abstract:[Objective]The effects of variety and concentration of several hormones were investigated on proliferation and growt of multiple shoot clumps of Cymbidium hybridium. [Methods] The test-tube plantlet of Cymbidium were used as explants to be cultured in the MS medium with different variety and concentrations of hormones. [Results]The results showed that added different concentrations 6-BA、KT、ZT and NAA(0.2 mg·L-1) in MS medium could induce differentiation of Multiple shoot clumps, but there were some differences on proliferation rate and growth condition of multiple shoot clumps. The most optimal medium for proliferation and growth of multiple shoot clumps was MS+6-BA3 mg·L-1+NAA 0.2 mg·L-1,with the highest proliferation ratio 3.57. The test-tube plantlet were not appear brown in medium added ZT. The optimal concentration of IBA was 1.0 mg·L-1when added the same concentration of BA (3 mg·L-1) and different concentration IBA in MS medium, with the lower proliferation rate compared with added 6-BA and NAA, but the multiple shoot clumps growed vigorously and seedlings directly generated. [Conclusion] There were different influence for different plant hormones on proliferation and growth of multiple shoot clumps and the the optimum medium for it was MS+6-BA 3 mg·L-1+NAA 0.2 mg·L-1.
Key words:Cymbidium hybridium; Clustered shoots; Phytohormone; Proliferation ratio
