饲料氧化鱼油对草鱼肝胰脏结构和功能的损伤
2016-08-10陈科全叶元土蔡春芳吴萍黄雨薇吴韬林秀秀罗其刚张宝彤萧培珍
陈科全叶元土蔡春芳吴 萍黄雨薇吴 韬林秀秀罗其刚张宝彤萧培珍,
饲料氧化鱼油对草鱼肝胰脏结构和功能的损伤
陈科全1叶元土1蔡春芳1吴 萍1黄雨薇1吴 韬1林秀秀1罗其刚1张宝彤2萧培珍1, 2
(1. 苏州大学基础医学与生物科学学院, 江苏省水产动物营养重点实验室, 苏州 215123;2. 北京营养源研究所、水产动物系统营养研究开放实验室, 北京 100000)
为了探讨饲料氧化鱼油对草鱼(Ctenopharyngodon idellus)肝胰脏组织结构及其功能的影响, 研究以豆油、鱼油及氧化鱼油作为饲料脂肪源, 分别设计鱼油组(6F)、豆油组(6S)、2%氧化鱼油(4S2OF)、4%氧化鱼油(2S4OF)及6%氧化鱼油(6OF)5组等氮、等能的半纯化饲料, 在池塘网箱中养殖72d。结果显示: 氧化鱼油显著增加草鱼血清ALB、GLB、MDA和GSH含量(P<0.05), 显著降低肝胰脏GSH和SOD含量(P<0.05); 氧化鱼油会显著增加草鱼肝胰脏指数及肝胰脏脂肪含量(P<0.05), 且草鱼血清TG含量显著上升(P<0.05), HDL/LDL显著下降(P<0.05); 氧化鱼油使血清及肝胰脏TC含量显著增加(P<0.05), 血清TBA显著下降(P<0.05), 肝胰脏TBA显著上升(P<0.05); 氧化鱼油会引起草鱼脂肪肝, 损伤肝胰脏细胞线粒体, 并导致肝胰脏细胞纤维化和组织萎缩。结果表明: 饲料添加氧化鱼油会引起草鱼氧化应激, 并降低草鱼肝胰脏抗氧化能力; 扰乱草鱼肝胰脏脂肪代谢, 引起脂肪肝; 影响胆汁酸肝肠循环, 使胆汁酸在肝胰脏中堆积, 并损伤肝胰脏细胞线粒体, 最终增加草鱼肝胰脏脂肪性肝炎发生率。
脂肪代谢; 胆汁酸; 线粒体; 草鱼
鱼油因其富含EPA、DHA等长链不饱和脂肪酸(LC-PUFA)而对水产动物有很好的营养作用, 但高含量的LC-PUFA会在光照、温度和氧等因素的影响下迅速被氧化产生过氧化物、酯类、多聚体等氧化产物而对动物体造成损害[1], 因此鱼油对水产动物具有营养作用和氧化损伤的二面性。现有研究表明, 氧化鱼油会导致虹鳟(Oncorhynchus mykiss)肝脏肿大, 并出现脂肪肝[2]; 鲤(Cyprinus carpio)肝胰脏抗氧化能力下降, 肝细胞受损[3, 4]。
草鱼(Ctenopharyngodon idellus)作为我国主要的淡水养殖经济鱼类, 在实际养殖中也是病害较多养殖鱼类之一[5]。肝胰脏是草鱼最重要的代谢和解毒器官, 具有代谢脂肪、合成胆汁酸、分泌免疫蛋白、分解有毒物质等众多功能[6]。近年来, 通过保护动物肝胰脏来加强其自身体抗力的途径已成为水产动物病害防治的关键点, 并越来越受到重视[7, 8]。但关于氧化鱼油对水产动物肝胰脏功能和结构的损伤进行系统、深入的研究和探讨的报道尚少见。本文以草鱼为试验对象, 以豆油为对照, 研究氧化鱼油对草鱼肝胰脏细胞、线粒体结构的损伤及对脂肪代谢、胆汁酸循环功能的影响, 期望为阐述油脂氧化产物对鱼体肝胰脏结构、功能损伤机制及其作用方式等科学问题提供依据, 为实际生产中饲料油脂的选择与质量控制提供参考。
1 材料与方法
1.1 草鱼
草鱼来源于浙江一星饲料有限公司养殖基地,为池塘培育的1冬龄鱼种, 共350尾, 平均体重为(74.8±1.0) g。草鱼随机分为5组, 每组设3重复, 每重复20尾。分组剩余草鱼用于养殖前期取样分析。
1.2 饲料
以酪蛋白和秘鲁蒸气鱼粉为主要蛋白源, 采用等氮、等能方案设计基础饲料, 设置了6%豆油组(简称6S组)、6%鱼油组(6F组)、2%氧化鱼油+ 4%豆油组(4S2OF组)、4%氧化鱼油+2%豆油组(2S4OF组)、6%氧化鱼油组(6OF组)共5种半纯化饲料, 配方及实测营养指标见表 1。各组蛋白含量为29.52%—30.55%, 无显著差异; 各组能量为19.943—20.860 kJ/g, 无显著差异。

表 1 试验饲料组成及营养水平Tab. 1 POV value, AV value and MDA content in diets
饲料原料粉碎过60目筛, 用绞肉机制成直径1.5 mm的长条状, 切成1.5 mm×2 mm的颗粒状, 风干。饲料置于-20℃冰柜保存备用。
豆油为“福临门”牌一级大豆油, 鱼油来源于广东省良种引进服务公司生产的“高美牌”精炼鱼油,氧化鱼油参考文献[9]方法制备。分别测定3种油脂过氧化值(POV)、酸价(AV)、丙二醛(MDA), 并计算饲料中POV、AV、MDA值(饲料中AV、POV、MDA测定尚无有效方法, 故采用油脂测定结果的计算值), 结果分别见表 2。
由表 2可知, 本试验中使用的鱼油有一定程度的氧化, 由于其在饲料中比例为6%, 而氧化鱼油组是由氧化鱼油和豆油按比例混合作为脂肪源, 所以6F组的实际POV值比4S2OF组高12.25%, 而AV值则比4S2OF和2S4OF组分别高出100%和3.9%。
1.3 饲养管理
养殖试验在浙江一星饲料有限公司试验基地进行。在面积为5 m×667 m (平均水深1.8 m)的池塘中设置网箱, 网箱规格为1.0 m×1.5 m×2.0 m。将各组试验草鱼随机分配在5组、15个网箱中。
分别用试验饲料驯化1周后, 开始正式投喂, 每天7:00和16:00定时投喂, 投饲率为3%—4%, 每10d依据投饲量估算鱼体增重并调整投饲率, 记录每天投饲量。正式试验共养殖72d。
每周测定水质一次, 试验期间溶解氧浓度>8.0 mg/L, pH 7.8—8.4, 氨氮浓度<0.2 mg/L, 亚硝酸盐浓度<0.01 mg/L, 硫化物浓度<0.05 mg/L。养殖期间水温25—33℃。
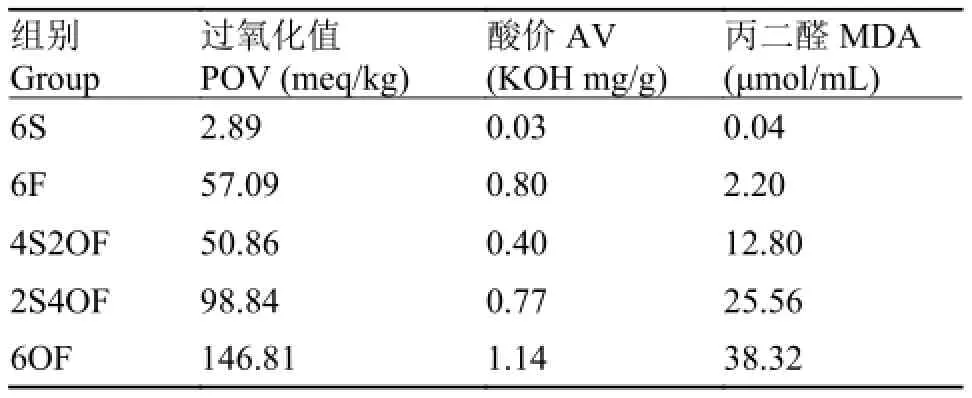
表 2 试验饲料中POV值、AV及MDA含量分析结果Tab. 2 POV value, AV value and MDA content in diets
1.4 样品采集及其分析方法
经72d养殖、禁食24h后进行样品采集。
肝胰脏组织学样品制备及分析 每网箱取6尾鱼、每组18尾, 单独记录其体重和肝胰脏重量,用于肝胰脏指数(HSI)计算, 并收集肝胰脏用索氏抽提法测定其粗脂肪。另每网箱取3尾鱼, 于肝胰脏左叶取1 mm3和1 cm3组织块各1块, 分别放入4%戊二醛溶液及Bouin试液中固定, 用于透射电镜和组织学切片分析。
组织学切片采用石蜡切片方法, 苏木精-伊红染色, 中性树胶封片, 光学显微镜下观察肝胰脏组织结构并采用Nikon COOLPIX4500型相机进行拍照。
透射电镜采用锇酸固定、丙酮脱水, 最后放入胶囊内包埋切片染色, 用日立HT7700透射式电子显微镜观察肝胰脏组织结构并拍照。
肝胰脏组织匀浆样品制备与分析 取部
分新鲜肝胰脏, 称重后加入10倍体积0.02 mol/L磷酸缓冲液(pH7.4), 匀浆器10000 r/min匀浆1min,3000 r/min冷冻离心10min, 取上清液分装, 液氮速冻后-80℃冰箱保存。丙二醛(MDA)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)采用南京建成试剂盒测定, 胆固醇(TC)、胆汁酸(TBA)采用雅培C800全自动生化分析仪测定。
血清样品制备与分析 每个网箱随机取10尾鱼, 以无菌1 mL注射器自尾柄静脉采血, 置于Eppenddorf离心管中室温自然凝固0.5h, 3000 r/ min冷冻离心10min, 取上清液分装后, 液氮速冻并于-80℃冰箱中保存。
MDA、SOD采用南京建成试剂盒。白蛋白(ALB)、球蛋白(GLB)、谷丙转氨酶(ALT)、谷氨酰转肽酶(GGT)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、甘油三酯(TG)、血清胆固醇(TC)、胆汁酸(TBA)采用雅培C800全自动生化分析仪测定。
饲料油脂样品分析 油脂过氧化值测定参照GB/T 5538-2005; 酸价测定参照GB/T 5530-2005;MDA采用南京建成试剂盒测定。
1.5 数据处理
试验结果用SPSS 21.0软件进行统计分析, 采用平均值±标准差(mean±SD)表示, 在单因素方差分析的基础上, 采用Duncan氏法多重比较检验组间差异显著性, 用Pearson分析方法检验数据相关性, 以P<0.05表示差异显著, P<0.01表示差异极显著。
2 结果
2.1 氧化鱼油对草鱼肝胰脏功能的影响
饲料氧化鱼油引起草鱼抗氧化损伤应激与氧化损伤 经72d养殖试验后, 各组草鱼血清ALB、GLB、MDA及SOD含量见表 3。
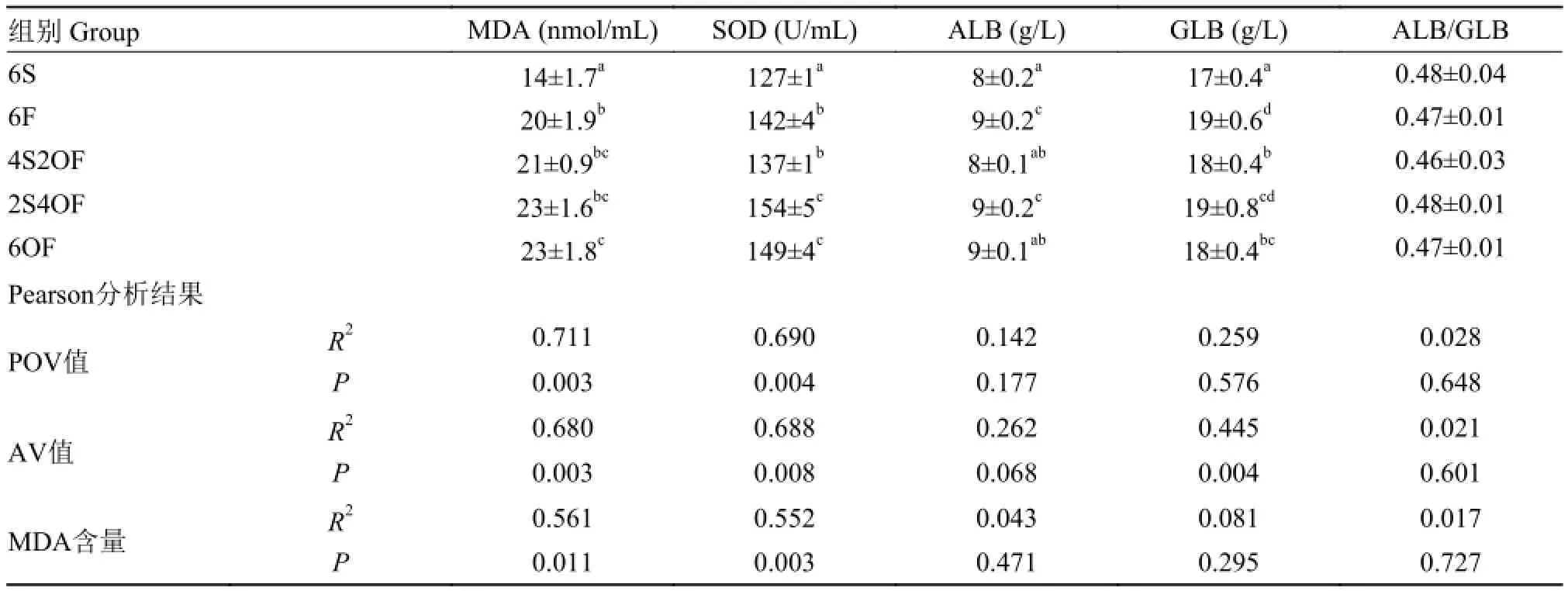
表 3 血清MDA、SOD、ALB、GLB、ALB/GLB测定结果Tab. 3 MDA, SOD, ALB, GLB content and ALB/GLB in serum
由表 3 可知, 相比6S组, 添加鱼油或氧化鱼油后, 草鱼血清ALB、GLB、MDA、SOD含量, 除4S2OF、6OF组ALB含量与6S组差异不显著外, 其余各组含量均显著上升(P<0.05), 虽然ALB/GLB各组间没有显著差异, 但有下降趋势。在相关性分析中, 血清MDA、SOD含量与饲料油脂中POV值、AV值相关性较大, R2为0.68—0.71, 且相关性极显著(P<0.01)。
血清酶学指标能反映鱼体整体的生理功能状态, 上述结果显示, ALB/GLB有下降趋势, 表明草鱼肝胰脏蛋白质合成能力下降, 且血清中免疫细胞增多, 体内可能有炎症反应; 氧化物质MDA含量增加, 抗氧化的SOD含量增加, 说明氧化损伤和抗氧化损伤加剧; 血清中MDA、SOD含量与饲料油脂中POV、AV值呈极显著正相关关系, 但与饲料中MDA无显著相关系, 说明血清中的MDA并不是直接来源于饲料中的MDA, 而可能是来源于饲料中POV、AV引起鱼体体内氧化损伤所产生的MDA。上述结果表明, 饲料鱼油氧化产物的影响是以氧化损伤为主, 鱼体处于氧化损伤与抗氧化损伤的应激状态; 氧化损伤的程度与饲料中油脂氧化程度呈正相关关系。
饲料氧化鱼油引起草鱼肝胰脏抗氧化功能下降 经72d养殖试验后, 各组草鱼血清ALT、GGT含量及肝胰脏GSH、MDA、SOD含量见表 4。
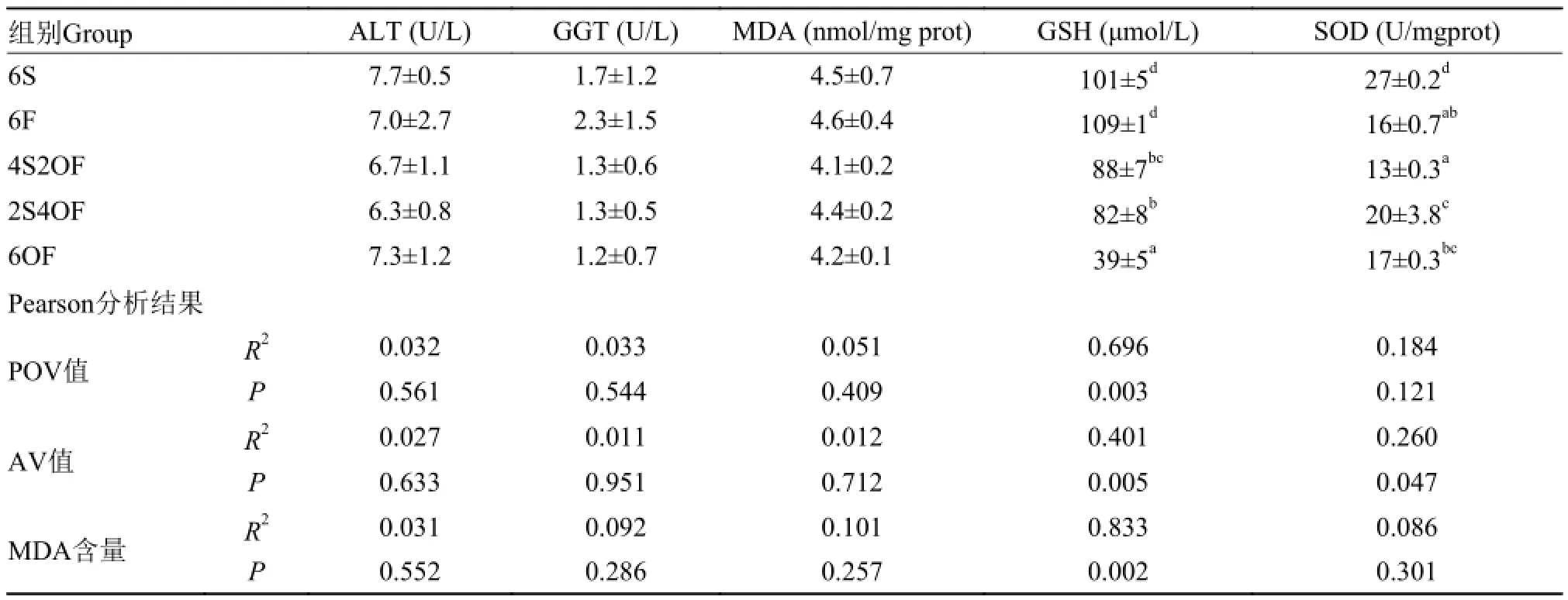
表 4 血清ALT、GGT含量与肝胰脏GSH、MDA、SOD测定结果Tab. 4 ALT and GGT content in serum and GSH, MDA and SOD content in hepatopancreas

表 5 氧化鱼油对草鱼肝胰脏指数、肝胰脏脂肪含量及血清TG、HDL和LDL含量的影响Tab. 5 Effects of oxidized fish oil on the HSI, lipid content of hepatopancreas and TG, HDL and LDL content in serum
由表 4 可知, 在添加鱼油或氧化鱼油后, 草鱼血清ALT、GGT含量及肝胰脏MDA含量各组间差异不显著, GSH和SOD含量均显著下降(P<0.05)。在相关性分析中, 肝胰脏GSH含量与饲料油脂中POV值、MDA含量相关性较大, R2分别为0.69与0.83, 且相关性极显著(P<0.01)
上述结果显示, 血清ALT和GGT含量没有差异,表明草鱼肝胰脏细胞通透性没有发生显著性的改变; 虽然血清MDA随饲料中鱼油氧化产物含量增加而增加, 但肝胰脏组织中MDA没有增加, 还有下降的趋势, 同时GSH和SOD下降, 说明肝胰脏抗氧化能力下降了。且肝胰脏GSH含量与饲料油脂POV值、MDA含量呈极显著负相关关系。
饲料氧化鱼油有引起草鱼发生损伤性脂肪肝的趋势 经72d养殖试验后, 各组草鱼肝胰脏指数(HSI)、肝胰脏脂肪含量(Lipid)及血清TG、HDL、LDL和HDL/LDL测定结果见表 5。
由表 5 可知, 添加鱼油或氧化鱼油后, 草鱼肝胰脏脂肪含量、HSI显著上升(P<0.05), 血清TG含量也显著上升(P<0.05)。血清HDL和LDL含量都有先上升后下降的趋势, 但HDL/LDL结果显示, 6S、6F及4S2OF组差异不显著, 2S4OF及6OF组则显著下降(P<0.05)。上述结果显示, 在饲料中添加氧化鱼油后, 肝胰脏指数和肝胰脏脂肪含量、血脂含量均增加, 部分达到脂肪肝标准, 说明草鱼肝胰脏有发生脂肪肝的趋势。
氧化鱼油导致草鱼肝胰脏胆汁酸淤积 经72d养殖试验后, 各组草鱼血清及肝胰脏中TBA和TC含量见表 6。

表 6 血清、肝胰脏TBA和TC测定结果Tab. 6 TBA and TC content in serum and hepatopancreas
由表 6 可知, 相比6S组, 添加鱼油或氧化鱼油后, 草鱼血清、肝胰脏胆汁酸、胆固醇含量变化如下: ①血清TBA含量显著下降(P<0.05), TC含量显著上升(P<0.05); ②肝胰脏TC含量除6F和2S4OF组、TBA含量除6F组外, 其余各组均显著上升(P<0.05)。在相关性分析中, 肝胰脏TBA含量与饲料油脂MDA含量相关性较大, R2为0.65, 且相关性极显著(P<0.01)。
上述结果显示, 血清胆汁酸含量显著下降、而肝胰脏胆汁酸显著上升, 说明胆汁酸在肝胰脏中大量淤积; 肝胰脏胆固醇含量上升与HDL/LDL显著下降结果相一致, 说明肝胰脏将胆固醇等脂类转运至外周组织的能力下降, 脂肪在肝胰脏聚积可能性增加。且肝胰脏TBA含量与饲料油脂MDA含量呈极显著负相关关系。
2.2 氧化鱼油对草鱼肝胰脏结构的影响
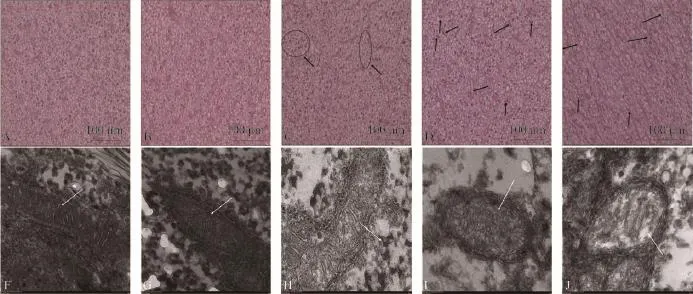
草鱼肝胰脏组织学观察 经72d养殖试验后, 各组草鱼肝胰脏组织切片结果见图版Ⅰ-A-E。
由图版Ⅰ-A-E可知: 6S、6F组草鱼肝胰脏细胞排列整齐, 大小均一; 4S2OF组草鱼肝胰脏出现部分因肝胰脏增生而导致相互挤压变形的细胞(见图中箭头所示); 2S4OF组草鱼肝胰脏出现部分细胞细胞核由细胞中央转移至细胞边缘(见图中箭头所示);6OF组草鱼肝胰脏出现细胞形态异常, 结缔组织增生, 且有明显纤维化趋势(图中箭头所示)。
由表 7可知, 6S、6F、4S2OF和2S4OF组Mn/Mc有减小趋势, 但无显著差异, 而6OF组则显著小于所有组, 说明6OF组中草鱼肝胰脏出现实质性损伤。
氧化鱼油对草鱼肝胰脏细胞线粒体的损伤
经72d养殖试验后, 各组草鱼肝胰脏线粒体透射电镜结果见图版Ⅰ-F-J。
由图版Ⅰ-F-J可知, 6S和6F组草鱼肝胰脏线粒体呈正常长杆型, 内部结构清晰, 嵴形态明显;4S2OF组线粒体形态正常, 但嵴形态模糊; 2S4OF组线粒体形态发生明显变化, 内部结构模糊, 嵴形态消融; 6OF组线粒体接近圆形, 内部出现大面积空缺, 嵴已基本消融。
上述结果显示, 氧化鱼油会损伤草鱼肝胰脏中线粒体, 而导致肝胰脏发生炎症, 这与本实验血清ALB和GLB结果相一致。
3 讨论
鱼油因其富含高不饱和脂肪酸而极易容易被氧化, 所产生的多种中间产物或终产物如醛类、酮类、脂类、多聚体等, 会对水产动物造成氧化损伤与抗氧化应激反应[10, 11]。
3.1 氧化鱼油导致草鱼氧化应激并造成肝胰脏氧化损伤
MDA作为油脂氧化的终产物[12], 会交联蛋白质及磷脂的氨基, 从而降低细胞膜的流动性[13], 而细胞膜流动性下降后更易被过氧化氢氧化从而产生MDA[14]。SOD和GSH水平作为机体抗氧化状态的标志[15], 常作为机体抗氧化能力的指标。本试验结果显示, 添加鱼油或氧化鱼油后草鱼血清中MDA和SOD含量均出现显著上升, 且与饲料油脂中POV、AV值呈正相关关系; 而肝胰脏SOD和GSH含量显著下降, 肝胰脏GSH含量与饲料油脂中POV值、MDA含量呈极显著负相关性关系。这说明在本试验中草鱼鱼体处于氧化应激状态, 肝胰脏的抗氧能力显著下降, 且抗应激程度很大程度上取决于饲料油脂的氧化程度。

表 7 肝胰脏细胞核与细胞个数比值(Mn/Mc)结果Tab. 7 The ratio of hepatopancreas nucleus to hepatopancreas cells
而在本试验中各组草鱼肝胰脏MDA含量没有显著差异, 这与Mourente等[16]在用氧化油脂饲喂金头鲷(Sparus aurata)后得到结果相一致, 他们认为油脂氧化产物在肝胰脏CAT、SOD等抗氧化酶的作用下, 其在肝胰脏中的含量并不会上升。
ALB只能由肝胰脏合成, 而GLB是机体主要的血清免疫球蛋白, 两者的比值常用来反映肝胰脏的病理损伤程度[17]。在本试验中6F、4S2OF和2S4OF组血清ALB较6S组显著上升, 而6OF组与6S组无显著差异, 说明草鱼肝胰脏功能在少量氧化产物的情况下会出现代偿性增强, 当氧化产物过高后其功能会受到抑制, 这与HSI结果相一致。而ALB/GLB的显著下降则表示肝胰脏有因氧化应激而产生炎症的可能。
血清中ALT和GGT都主要来自肝胰脏, 当肝胰脏受到实质性损伤其细胞通透性增加后血清中ALT和GGT含量会显著上升[18]。而在本试验中各组血清ALT和GGT没有显著升高, 说明肝胰脏细胞通透性没有增加。
结果表明, 鱼油氧化产物会引起草鱼氧化应激,且应激程度与鱼油氧化程度正相关; 草鱼肝胰脏有发生炎症的可能, 且炎症主要发生在肝胰脏细胞内部, 尚未对细胞通透性造成影响。
3.2 氧化鱼油干扰草鱼胆固醇、胆汁酸代谢
胆汁酸是以胆固醇为原料在肝脏中合成的一种重要物质, 其对胆固醇代谢的调控、及胆汁胆固醇的溶解和对肠道脂类物质的消化、吸收具有重要意义[19]。在正常情况下机体存在“胆汁酸肠肝循环”[20]以循环利用胆汁酸。胆汁酸的肠肝循环是调节胆汁酸合成速率的重要调节机制[21], 以防止具有毒性的疏水性胆汁酸在肝胰脏内大量聚积而损伤肝胰脏。胆汁酸的肠肝循环过程中任何一个环节发生障碍, 都会导致胆汁酸在肝细胞和肝内胆管内淤积, 从而发生肝胰脏增大、黄疸等疾病[22]。本试验结果显示, 鱼油氧化产物会导致肝胰脏胆汁酸、胆固醇含量显著上升。与6S组比较, 在饲料中添加鱼油或氧化鱼油后, 草鱼血清胆汁酸量显著下降、胆固醇含量增加, 而肝胰脏是胆汁酸、胆固醇含量均显著增加, 表明饲料中氧化鱼油显著干扰草鱼的胆固醇、胆汁酸代谢, 草鱼胆汁酸肠肝循环发生障碍, 胆汁酸大量淤积在肝胰脏中, 且肝胰脏胆汁酸含量与饲料油脂MDA含量极显著正相关。
在肝胰脏中高含量的胆汁酸会引起疏水性胆汁酸在肝内聚积, 疏水性胆汁酸会溶解细胞膜, 从而引起肝胰脏细胞的坏死, 是胆汁淤积性肝损伤的主要原因[23]。Hino等[24]在小鼠肝脏中发现, 加入抗氧化剂可显著降低疏水性胆汁酸的毒性, 并且降低肝脏中MDA的含量, 他认为氧自由基与疏水性胆汁酸的细胞毒作用之间存在某种关系。刘菁菁[25]在用富含牛磺胆酸的狐胆汁处理被过氧化物损伤的乳鼠心肌细胞后发现, 牛磺胆酸可以提高细胞的抗氧化能力, 降低MDA含量。黄延风等[26]在用大黄治疗幼鼠肝内胆汁淤积时发现, 熊去氧胆酸也能有效的治疗肝内胆汁淤积。富含熊去氧胆酸的熊胆粉可以有效降低因氧化损伤而产生的MDA[27, 28]。可见亲水性胆汁酸具有一定的抗氧化能力, 并且亲水性胆汁酸可在肠道胆汁酸重吸收时竞争性抑制疏水性胆汁酸的重吸收, 从而减少体内胆汁酸中疏水性胆汁酸的含量[29]。
因此, 本试验结果显示, 可能是鱼油氧化产物大量消耗体内亲水性胆汁酸、导致胆汁酸中疏水性胆汁酸比例上升, 从而堵塞胆管致使草鱼肝胰脏中胆汁酸大量淤积, 最终引发肝胰脏炎症。其具体机理有待进一步分析。
另外, 鱼油富含胆固醇, 肝胰脏胆固醇含量的增加是否是由于饲料中鱼油添加量增加所致?6F 与6OF组相比较, 在饲料中鱼油添加量均为6%, 饲料所含胆固醇量相等。但是, 由表 6结果显示,6OF组草鱼血清、肝胰脏TC含量均高于6F组, 且肝胰脏TC含量显著高于6F。这个结果表明, 血清、肝胰脏TC含量的增加并不是源于饲料中TC, 而是由于鱼油的氧化所致。饲料中氧化鱼油引起鱼体自身胆固醇生物合成量显著增加, 这与我们以前的研究结果[30, 31]相一致。胆固醇的去路之一是合成胆汁酸, 对于各组草鱼胆汁酸含量的差异, 6F组与6OF组饲料鱼油添加量均为6%, 6S组为6%的豆油,6OF组肝胰脏胆汁酸显著高于6F组、6F组与6S组无显著差异; 6OF组血清胆汁酸含量显著高于6F组,表明本试验中添加氧化鱼油后(6OF组), 草鱼肝胰脏胆汁酸含量的增加并非由不同油脂源(6F、6S)所引起的, 而是由于鱼油的氧化程度所致。
3.3 氧化鱼油增加草鱼肝胰脏发生脂肪性肝炎的机率
脂肪肝是指由肝细胞内脂肪堆积过多而导致肝脏病变的一种慢性肝脏病[32]。Lin等[33]认为, 草鱼HSI大于3%, 肝胰脏脂肪含量大于5%即可称为脂肪肝。但鱼类HSI会随着生长阶段和种类的变化而变化[34], 鱼类摄食不同脂肪源其肝胰脏在不发生病变的情况下脂肪含量也会发生较明显变化[35, 36]。因此, 目前对于鱼类脂肪肝还没有明确的判断标准。但可以肯定的是, 鱼类发生脂肪肝后其肝胰脏脂肪含量会显著上升, HSI在脂肪肝前期会代偿性增加, 后期可能会因肝胰脏实质性损伤而减小, 且肝胰脏中脂肪氧化会加剧[37], 血脂含量也会增加[38]。
本实验结果显示, 添加鱼油或氧化鱼油后草鱼HSI显著增大, 但6OF组有减小的趋势(可能是肝胰脏严重损伤后出现萎缩性变化), 肝胰脏脂肪含量显著增加, 说明肝胰脏脂肪代谢功能受干扰;HDL/LDL显著下降, 也说明鱼油氧化产物会降低草鱼将外周组织胆固醇转运至肝胰脏的能力, 致使血脂含量的上升; 血清TG、TC、HDL和LDL含量均显著上升, 说明试验草鱼血脂含量显著上升。上述结果表明, 草鱼有发生脂肪肝的趋势, 再结合杜震宇[39]有关营养型与氧化型脂肪肝的表型比较结果来看, 本试验草鱼脂肪肝接近氧化型脂肪肝。
上述结果表明, 油脂氧化产物会干扰草鱼脂肪正常代谢, 但低氧化程度的油脂会引起草鱼应激,从而使其肝胰脏代偿性增生来代谢一定量的氧化产物。而高氧化程度的油脂, 其氧化产物含量超出草鱼耐受范围后, 会对肝胰脏造成损伤, 使肝胰脏代谢脂肪能力下降, 从而导致脂肪在草鱼体内大量沉积, 最终降低草鱼生长速度。并且本试验中[40]氧化鱼油导致草鱼蛋白沉积率下降、脂肪沉积率上升也和Chen等[41]得到氧化鱼油会增加鱼类使用蛋白质代替脂肪作为能量消耗的结果相一致。
结合肝胰脏组织切片(图版Ⅰ-A-E)可以发现:6S、6F组肝胰脏细胞大小均匀、细胞核明显; 4S2OF组中可发现, 部分肝胰脏细胞出现因增生而相互挤压导致细胞大小明显不一; 2S4OF组中则出现部分细胞细胞核向细胞边缘靠近; 6OF组中肝细胞形态发生改变, 排列不规则, 有明显纤维化趋势。这些结果与大口黑鲈(Micropterus salmoides)[42]、红姑鱼(Sciaenops ocellatus)[43]脂肪肝组织学观察结果相一致, 进一步说明鱼油氧化产物会引起草鱼脂肪肝。
通过肝胰脏透射电镜结果((图版Ⅰ-F-J)可以发现: 6S、6F组肝胰脏细胞中线粒体为长杆状的正常形态, 且内部结构完整, 嵴形态明显; 2OF组中肝胰脏线粒体形态尚正常, 但是内部嵴较分散, 有消融趋势; 4OF组中肝胰脏线粒体形态发生变化, 内部结构模糊, 嵴结构混乱明显消融; 6OF组中肝胰脏线粒体形态接近圆形, 内部结构基本全部消融。这与因人工饲喂引起鲈(Lateolabrax japonicas)脂肪肝[44]及用氧化鱼油饲喂鲤造成肝胰脏损伤的电镜结果相一致[3]。
肝胰脏作为各种营养物质代谢和解毒中心, 对氧化鱼油的毒性极为敏感。一般认为氧化油脂在肠道消化吸收后, 其结合在乳糜微粒中的氧化产物,一部分会随血液循环转运至肝脏[45], 另一部分会转运给脂蛋白, 并由脂蛋白运送到各组织, 但其中以转运至肝脏的最多[46]。而运送至肝脏的次级氧化产物可能先在线粒体中性脂肪上代谢, 然后转运至微粒体磷脂上代谢[47]。
线粒体是真核细胞重要的细胞器, 生物体内90%以上的氧分子是在线粒体中被消耗的, 而此过程在生物体内具有两重性: 一方面, 线粒体利用氧分子产生APT, 这是生物体的重要能量代谢过程;另一方面, 线粒体体内的呼吸作用及氧化反应会产生大量有害的氧自由基, 并造成细胞损伤, 导致疾病和衰老[48]。研究发现, 脂肪性肝炎患者普遍存在线粒体肿胀, 氧化呼吸复合体功能下降等[49], 并认为线粒体反应性氧体系与脂肪肝的发生密切相关。
上述结果表明鱼油氧化产物会引发草鱼肝胰脏脂肪肝, 并会损伤肝胰脏细胞线粒体而引起脂肪性肝炎。
在本试验中鱼油氧化产物对线粒体的损伤可能由两方面造成的: (1)线粒体膜富含多不饱和脂肪酸极易被鱼油氧化产物中氢过氧化物所氧化, 使线粒体膜流动性下降、通透性增加[50], 进而肝胰脏中氧化产物大量进入线粒体, 最后导致线粒体变形与溶酶体融合[51]; (2)线粒体反应性氧体系的形成可启动不饱和脂肪酸氧化从而引发脂质过氧化发生[52],且鱼油氧化产物导致肝胰脏产生应激而消耗大量的GSH及维生素E, 从而降低线粒体抗氧化能力, 最终导致线粒体内部被破坏。
4 结论
饲料中鱼油氧化产物会引起肝胰脏氧化应激,其抗氧化能力下降; 使肝胰脏中脂肪转运发生障碍、脂肪积累增加; 引起草鱼肝胰脏中线粒体损伤、肝细胞纤维化; 饲料氧化鱼油对肝胰脏的损伤类型为氧化性损伤, 并导致肝胰脏由脂肪肝转变成脂肪性肝炎、肝纤维化或肝萎缩。氧化鱼油会导致草鱼体内胆汁酸中亲水性胆汁酸含量下降, 从而引起疏水性胆汁酸堵塞胆管, 造成其在肝胰脏中大量淤积, 进而扰乱胆汁酸、胆固醇的正常代谢循环;胆汁酸在肝胰脏淤积会导致肝胰脏脂肪代谢异常,致使草鱼肝胰脏成为脂肪肝, 并增加其发生脂肪性肝炎的机率。
[1]Yao S B, Ye Y T, Li J, et al. Oxidation index and its fatty acid composition changes in fish oil during oxidation [J]. Feed Research, 2012, 6: 74—76 [姚仕彬, 叶元土, 李洁,等. 鱼油在氧化过程中氧化指标及其脂肪酸组成的变化. 饲料研究, 2012, 6: 74—76]
[2]Řehulka J. Effect of hydrolytically changed and oxidized fat in dry pellets on the health of rainbow trout, Oncorhynchus mykiss (Richardson) [J]. Aquaculture Research,1990, 21(4): 419—434
[3]Ren Z L, Zeng H, Huo Q G, et al. Effect of oxidized fish oil on the anti-oxidative function and histological structure of carp hepatopancreas [J]. Journal of Dalian Fisheries University, 2000, 15(4): 235—243 [任泽林, 曾虹, 霍启光, 等. 氧化鱼油对鲤肝胰脏抗氧化机能及其组织结构的影响. 大连海洋大学学报, 2000, 15(4): 235—243]
[4]Liu W, Zhang G L, Chen H Y. Effects of add oxidative oil in diet on lipid peroxidation and hematological values for common carps [J]. Journal of Fishery Sciences of China, 1997, 4(1): 94—96 [刘伟, 张桂兰, 陈海燕. 饲料添加氧化油脂对鲤体内脂质过氧化及血液指标的影响.中国水产科学, 1997, 4(1): 94—96]
[5]Jiang T. Comprehensive prevention and control three disease of grass carp [J]. Chongqing Fisheries, 2005, 73(4):31—32 [江涛. 草鱼“三病”的综合防治. 重庆水产, 2005,73(4): 31—32]
[6]Qing J. The effect of oxidized oil on primary culture of hepatocytes form Ctenopharyngodon idellus [D]. Shanghai Ocean University. 2012 [秦洁. 氧化油脂对草鱼肝细胞损伤机制的研究. 上海海洋大学. 2012]
[7]Yang B H, Yuan M F, Tang J. Chinese herbal medicine on the application prospect of aquaculture animal liver health [J]. Feed Research, 2013, 4: 60—63 [杨保和, 袁明凤, 唐精. 中草药对水产动物肝健康的应用前景. 饲料研究, 2013, 4: 60—63]
[8]Li C, Zhang Q Z, Yang Y Y, et al. Effect of different doses of compound Chinese herbal immunostimulant in feed on the growth and immune function of grass carp (Ctenopharyngodon idellus) [J]. Journal of Shanghai Ocean University, 2011, 20(4): 534—540 [李超, 张其中,杨莹莹, 等. 不同剂量复方中草药免疫增强剂对草鱼生长性能和免疫功能的影响. 上海海洋大学学报, 2011,20(4): 534—540]
[9]Yin Y F, Ye Y T, Cai C F, et al. Variation of the oxidation index of soybean oil in homemade oxidation device at different time [J]. Journal of Anhui Agriculture Science, 2011, 39(7): 4052—4054 [殷永风, 叶元土, 蔡春芳, 等. 在自制氧化装置中氧化时间对豆油氧化指标的影响. 安徽农业科学, 2011, 39(7): 4052—4054]
[10]Vázquez-Añón M, Jenkins T. Effects of feeding oxidized fat with or without dietary antioxidants on nutrient digestibility, microbial nitrogen, and fatty acid metabolism [J]. Journal of Dairy Science, 2007, 90(9): 4361—4367
[11]Ren Z L, Huo Q G. Effects of oxidized oil on animals [J]. Chinese Journal of Animal Nutrition, 2000, 12(3): 1—13[任泽林, 霍启光. 氧化油脂对动物机体的影响. 动物营养学报, 2000, 12(3): 1—13]
[12]Benzie I F F. Lipid peroxidation: a review of causes, consequences, measurement and dietary influences [J]. International Journal of Food Sciences and Nutrition, 1996,47(3): 233—261
[13]Lin Y H, Zhang J J. Protective effect of sodium ferulate on damage of the rat liver mitochondria induced by oxygen free radicals [J]. Acta Pharmaceutica Sinica, 1994,29(3): 171—175 [林迎晖, 张家俊. 阿魏酸钠对大鼠肝线粒体氧化性损伤的保护作用. 药学学报, 1994, 29(3):171—175]
[14]Pan H Z, Feng L M, Xu C M, et al. Effect of Malondialdehyde on red blood cells [J]. Progress in Biochemistry and Biophysics, 1984, 2: 34—37 [潘华珍, 冯立明, 许彩民等. 丙二醛对红细胞的作用. 生物化学与生物物理进展, 1984, 2:34—37]
[15]Trevisan M, Browne R, Ram M, et al. Correlates of markers of oxidative status in the general population [J]. American Journal of Epidemiology, 2001, 154(4): 348—356
[16]Mourente G, Dıaz-Salvago E, Bell J G, et al. Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L.) fed dietary oxidised oil: attenuation by dietary vitamin E [J]. Aquaculture, 2002, 214(1): 343—361
[17]Xie Q L, Wang G S, Liu M H. The correlation between serum markers of liver fibrosis and Alb, Glb, Alb/Glb in chronic hepatitis [J]. Modern Medicine & Health, 2005,21(13): 1638—1639 [谢秋里, 王功遂, 刘梅华. 白蛋白,球蛋白, 白/球比值与肝组织病理的关系. 现代医药卫生, 2005, 21(13): 1638—1639]
[18]Peng W F, Zhong Z Y. Significance of combined detection of ADA and ALT, ASt, GGT in the diagnosis of liver diseases [J]. Contemporary Medicine, 2011, 17(9):4—6 [彭文锋, 钟政永. ADA与ALT, AST, GGT联合检测在肝脏疾病诊断中的意义. 当代医学, 2011, 17(9):4—6]
[19]Davis M. Cholestasis and endogenous opioids: liver disease and exogenous opioid pharmacokinetics [J]. Clinical Pharmacokinetica, 2007, 46(10): 825—850
[20]Kullak-ublick G A, Stieger B, Meier P J. Enterohepatic bile salt transporters in normal physiology and liver disease [J]. Gastroenterology, 2004, 126(1): 322—342
[21]Anwer M S. Cellular regulation of hepatic bile acid transport in health and cholestasis [J]. Hepatology, 2004,39(3): 581—590
[22]Nakajima T, Okuda Y, CHSIaki K, et al. Bile acids increase intracellular Ca2+concentration and nitric oxide production in vascular endothelial cells [J]. British Journal of Pharmacology, 2000, 130(7): 1457—1467
[23]Zhong L, Fan J G. The mechanism and application of ursodeoxycholic acid in chronic liver diseases [J]. Foreign Medical Science: Section of Digestive Disease, 1999,19(2): 91—94 [钟岚, 范建高. 熊去氧胆酸在慢性肝病中的应用及机制. 国外医学: 消化系疾病分册, 1999,19(2): 91—94]
[24]Hino A, Morita M, Une M, et al. Effects of deoxycholic acid and its epimers on lipid peroxidation in isolated rat hepatocytes [J]. Journal of Biochemistry, 2001, 129(5):683—689
[25]Liu J J. The analysis of fox bile by high performance liquid chromatography and bile to myocardial antioxidant injury research [D]. Northeast Forestry University. 2013[刘菁菁. 狐胆汁HPLC 分析及其对心肌抗氧化损伤的研究. 东北林业大学. 2013]
[26]Huang Y F, Zhu C M. Therapeutic effect of rhubarb on intrahepatic cholestasis in infant rats [J]. Journal of the Fourth Military Medical University, 2006, 27(13):1178—1181 [黄延风, 朱朝敏. 大黄对幼鼠肝内胆汁淤积的治疗作用. 第四军医大学学报, 2006, 27(13):1178—1181]
[27]Zhang Q G, Xu H B, Bu H S. Effect of Fel Ursi powder for injection on cerebral thrombosis in rats [J]. Chinese Traditional and Herbal Drugs, 2005, 36(9): 1360—1364[张庆镐, 徐惠波, 朴惠善. 注射用熊胆粉对大鼠脑血栓的影响. 中草药, 2005, 36(9): 1360—1364]
[28]Wang W W. Study on the efficacy Bear gall powder [J]. Heilongjiang Medicine Journal, 2010, 23(2): 196—198[王巍巍. 熊胆粉的药效学研究. 黑龙江医药, 2010,23(2): 196—198]
[29]Huang W F. Protective mechanisms of ursodeoxycholic acid [J]. Foreign Medical Sciences: section of Clinical Biochemistry and Laboratory Medicine, 1999, 20(2):68—71 [黄文方. 熊脱氧胆酸的护肝机制. 国外医学: 临床生物化学与检验学分册, 1999, 20(2): 68—71]
[30]Ye Y T, Cai C F, Xu F, et al. Feeding grass carp (Ctenopharyngodon idellus) with oxidized fish oil up-regulates the gene expression in the cholesterol and bile acid synthesis pathway in intestinal mucosa [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 94—104 [叶元土, 蔡春芳, 许凡, 等. 灌喂氧化鱼油使草鱼肠道黏膜胆固醇胆汁酸合成基因通路表达上调. 水生生物学报, 2015, 39(1):94—104]
[31]Huang Y W, Ye Y T, Cai C F, et al.The effect of the gene expression in metabolism of cholesterol synthesis pathway after intestine injured on Ctenopharyngodon idellus [J]. Journal of Nanjing Agricultural University, 2015,38(3): 497—503 [黄雨薇, 叶元土, 蔡春芳, 等. 肠道损伤对草鱼胆固醇代谢通路基因表达的影响. 南京农业大学学报, 2015, 38(3) : 497—503]
[32]Zhou Y, Wang J K, Huang K, et al. Relationship between liver function and serum lipid among patients with fatty liver [J]. Chinese Public Health, 2011, 27(1): 101—102[周燕, 王绩凯, 黄凯, 等. 脂肪肝患者肝功能与血脂水平关系. 中国公共卫生, 2011, 27(1): 101—102]
[33]Ding L, Yongqing M, Fasheng C. Nutritional lipid liver disease of grass carp Ctenopharyngodon idullus (C. et V.)[J]. Chinese Journal of Oceanology and Limnology, 1990,8(4): 363—373
[34]Li X N. Effect of dietary carbohydrate levels on growth performance, physiological status and body composition of turbot (Scophthalmus macimus Linnaeus) and Japanese flounder (Paralichthys olivaceus) [D]. Ocean University of China. 2011 [李晓宁. 饲料糖水平对大菱鲆和牙鲆生长, 生理状态参数及体组成的影响. 中国海洋大学. 2011]
[35]Cheng X F, Tian J J, Ji H, et al. Effects of different lipid sources in the silkworm pupa-based diet for mirror carp (Cyprinus Carpio Var. Specularis) on growth performance, body composition and health status [J]. Acta Hydrobiologica Sinica, 2013, 37(4): 656—668 [程小飞, 田晶晶, 吉红, 等. 蚕蛹基础日粮中添加不同脂肪源对框鳞镜鲤生长, 体成分及健康状况的影响. 水生生物学报,2013, 37(4): 656—668]
[36]Huang J, Cheng Z P, Jin M C, et al. Effects of different lipid sources instead of fish oil in diet for Trachinotus ovatus on growth performance [J]. Journal of Yangtze University (National Science Edition), 2013, 10(6):48—50 [黄劼, 程志萍, 金明昌, 等. 饲料中不同脂肪源替代鱼油对金鲳鱼生长的影响. 长江大学学报(自然科学版), 2013, 10(6): 48—50]
[37]Wang K Y, Miao C H, Huang J L, et al. Changes in main biochemical indices and Acetyl-CoA carboxylase 1 mRNA expression of grass carp fed a high-fat diet [J]. Chinese Journal of Animal Nutrition, 2012, 24(12):2375—2383 [汪开毓, 苗常鸿, 黄锦炉, 等. 投喂高脂饲料后草鱼主要生化指标和乙酰辅酶A羧化酶1 mRNA表达的变化. 动物营养学报, 2012, 24(12):2375—2383]
[38]Zhu R J, Li X Q, Xie J, et al. Effects of dietary supple-mental choline chloride on growth performance and lipid deposition and activities of lipid metabolism enzymes of grass carp, Ctenopharyngodon idullus [J]. Journal of Fishery Sciences of China, 2010, 17(3): 527—535 [朱瑞俊, 李小勤, 谢骏, 等. 饲料中添加氯化胆碱对草鱼成鱼生长, 脂肪沉积和脂肪代谢酶活性的影响. 中国水产科学, 2010, 17(3): 527—535]
[39]Du Z Y. Causes of fatty liver in farmed fish: a review and new perspectives [J]. Journal of Fisheries of China, 2014,38(9): 1628—1638 [杜震宇. 养殖鱼类脂肪肝成因及相关思考. 水产学报, 2014, 38(9): 1628—1638]
[40]Chen K Q, Ye Y T, Cai C F, et al. Effects of dietary oxidized fish oil on growth and muscle fatty acid composition of grass carp (Ctenopharyngodon idellus) [J]. Chinese Journal of Animal Nutrition, 2015, 27(6):1698—1708 [陈科全, 叶元土, 蔡春芳, 等. 饲料中氧化鱼油对草鱼生长及肌肉脂肪酸组成的影响. 动物营养学报, 2015, 27(6):1698—1708]
[41]Chen Y J, Liu Y J, Yang H J, et al. Effect of dietary oxidized fish oil on growth performance, body composition,antioxidant defence mechanism and liver histology of juvenile largemouth bass Micropterus salmoides [J]. Aquaculture Nutrition, 2012, 18(3): 321—331
[42]Tan X Y, Liu Y J, Tian L X, et al. The effects of dietary carbohydrate levels on the growth, nutrient composition of juvenile largemouth bass Micropterus salmoides [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni,2005, 44(B06): 258—263 [谭肖英, 刘永坚, 田丽霞, 等.饲料中碳水化合物水平对大口黑鲈, Micropterus salmoides 生长, 鱼体营养成分组成的影响. 中山大学学报: 自然科学版, 2005, 44(B06): 258—263]
[43]Feng J, Jia G. Studies on the fatty liver diseases resulted from different lipid levels in Sciaenops ocellatus diets [J]. Acta Hydrobiologica Sinica, 2005, 29(1): 61—64 [冯健,贾刚. 饵料中不同脂肪水平诱导红姑鱼脂肪肝病的研究. 水生生物学报, 2005, 29(1): 61—64]
[44]Mosconi-Bac N. Hepatic disturbances induced by an artificial feed in the sea bass (Dicentrarchus labrax) during the first year of life [J]. Aquaculture, 1987, 67(1): 93—99
[45]Stephan G, Messager J L, Lamour F, et al. Interactions between dietary alpha-tocopherol and oxidized oil on sea bass Dicentrarchus labrax [J]. Colloques de l'INRA (France), 1993, 61(6): 215—218
[46]Kanazawa K, Kanazawa E, Natake M. Uptake of secondary autoxidation products of linoleic acid by the rat [J]. Lipids, 1985, 20(7): 412—419
[47]Kazuki K, Hitoshi A, Shinsuke M, et al. The effect of orally administered secondary autoxidation products of linoleic acid on the activity of detoxifying enzymes in the rat liver [J]. Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism, 1986, 879(1): 36—43
[48]Zhao Y G, Xu J X. Mitochondria, reactive oxygen species and apoptosis [J]. Progress in Biochemistry and Biophysics, 2001, 28(2): 168—171 [赵云罡, 徐建兴. 线粒体, 活性氧和细胞凋亡. 生物化学与生物物理进展,2001, 28(2): 168—171]
[49]Caldwell S H, Swerdlow R H, Khan E M, et al. Mitochondrial abnormalities in non-alcoholic steatohepatitis [J]. Journal of Hepatology, 1999, 31(3): 430—434
[50]Monahan F J, Gray J I, Asghar A, et al. Effect of dietary lipid and vitamin E supplementation on free radical production and lipid oxidation in porcine muscle microsomal fractions [J]. Food Chemistry, 1993, 46(1): 1—6
[51]De Gritz B G, Rahko T, Korpela H. Diet-induced lipofuscin and ceroid formation in growing pigs [J]. Journal of Comparative Pathology, 1994, 110(1): 11—24
[52]Yang S Q, Zhu H, Li Y, et al. Mitochondrial adaptations to obesity-related oxidant stress [J]. Archives of Biochemistry and Biophysics, 2000, 378(2): 259—268
DAMAGE OF OXIDIZED FISH OIL ON THE STRUCTURE AND FUNCTION OF HEPATOPANCREAS OF GRASS CARP (CTENOPHARYNGODON IDELLUS)
CHEN Ke-Quan1, YE Yuan-Tu1, CAI Chun-Fang1, WU Ping1, HUANG Yu-Wei1, WU Tao1, LIN Xiu-Xiu1,LUO Qi-Gang1, ZHANG Bao-Tong2and XIAO Pei-Zhen1, 2
(1. Preclinical Medicine and Biological Science College of Soochow University, Key Laboratory of Aquatic Animal Nutrition in Jiangsu Province, Suzhou 215123, China; 2. Laboratory of Aquatic Animal Nutrition Research System, Beijing Institute of Nutrition,Beijing 100000, China)
To investigate effects of oxidized fish oil on the structure and permeability of hepatopancreas of grass carp (Ctenopharyngodon idellus), five iso-nitrogen and iso-energy diets were formulated with soybean oil, fish oil and oxidized fish oil at different concentrations, 6% fish oil, 6% soybean oil, 2% oxidized fish oil and 4% soybean oil, 4% oxidized fish oil and 2% soybean oil, 6% oxidized fish oil for a 72d experiment. Result showed that oxidized fish oil significantly increased (P<0.05) the content of ALB, GLB, MDA, GSH of grass carp serum and significantly reduced(P<0.05) the content of GSH, SOD of grass carp hepatopancreas. Oxidized fish oil significantly increased (P<0.05) the HSI, content of lipid of hepatopancreas and TG content of serum, and significantly reduced (P<0.05) the ratio of HDL and LDL at the same time. Oxidized fish oil significantly enhanced the content of TC on serum and hepatopancreas and the content of TBA on hepatopancreas (P<0.05) but significantly diminished the content of serum TBA (P<0.05). Oxidized fish oil caused fatty liver by disrupting the fat metabolism, mitochondrial damage of hepatopancreas by impacting bile acid accumulation, hepatopancreas cell fibrosis, and tissue atrophyin grass carp. In conclusion, products of oxidized fish oil may cause grass carp oxidative stress and decrease antioxidant capacity of grass carp hepatopancreas.
Fat Metabolism; Bile Acid; Mitochondrial; Ctenopharyngodon idellus
图版Ⅰ 氧化鱼油对草鱼肝胰脏形态、结构的影响PlateⅠ Effect of oxidized fish oil on morphology and structure of grass carp hepatopancreas
S963.1
A
1000-3207(2016)04-0793-11
10.7541/2016.103
2015-01-13;
2015-11-05
国家自然科学基金项目(31172417); 苏州市应用基础研究项目(SYN201316)资助 [Supported by the National Natural Science Foundation of China (31172417); Applied Basic Research Programs of Suzhou City (SYN201316)]
陈科全(1990—), 男, 浙江诸暨人; 硕士研究生; 研究方向为水产动物营养与饲料。E-mail: 326088246@qq.com
叶元土, 教授, 硕士生导师; E-mail: yeyt@suda.edu.cn, Tel./Fax:+86-0512-65880179
