育肥饲料中植物油混合替代鱼油对中华绒螯蟹雄体脂肪酸代谢相关基因表达的影响
2016-08-10刘泽华吴旭干2龙晓文赵磊李嘉尧2成永旭
刘泽华吴旭干, 2龙晓文赵 磊李嘉尧, 2成永旭, 2
育肥饲料中植物油混合替代鱼油对中华绒螯蟹雄体脂肪酸代谢相关基因表达的影响
刘泽华1吴旭干1, 2龙晓文1赵 磊1李嘉尧1, 2成永旭1, 2
(1. 上海海洋大学水产种质资源发掘与利用教育部重点实验室, 上海 201306; 2. 上海海洋大学上海市教委水产动物遗传育种协同创新中心, 上海 201306)
为研究植物油替代鱼油对中华绒螯蟹(以下简称河蟹)脂肪酸代谢产生的影响, 通过荧光定量PCR (qRTPCR)技术研究了河蟹脂肪酸碳链延长酶(Es-FAE)、Δ9脂肪酸去饱和酶(Es-FAD9)、Δ6脂肪酸去饱和酶b (Es-FAD6b)、脂肪酸结合蛋白3 (Es-FABP3)、脂肪酸结合蛋白9 (Es-FABP9)和脂肪酸结合蛋白10 (Es-FABP10)基因在不同组织中的表达情况, 以及育肥饲料中不同鱼油替代水平(鱼油替代水平分别为0、25%、50%、75%和100%, 记为饲料1#—5#组)对河蟹雄体肝胰腺中这些基因mRNA表达水平的影响, 以探讨育肥中鱼油替代对河蟹雄体成蟹脂肪酸代谢的影响。结果表明: (1) Es-FAE、Es-FAD6b和Es-FAD9均在肝胰腺中表达水平最高, 在心脏和血淋巴中表达水平较低, 不同基因在其他组织中的表达规律有所不同; Es-FABP3、Es-FABP9和Es-FABP10主要在肝胰腺、肌肉、输精管和副性腺中表达水平较高, 在胃、肠和心脏中表达水平较低。(2) 随着饲料中鱼油替代水平的提高, 肝胰腺中Es-FAE-mRNA有显著增加趋势; 就Es-FAD6b而言, 饲料3#组显著高于饲料2#组, 其余各组间差异不显著; 随着饲料中鱼油水平的降低, 饲料1#—3#组肝胰腺中Es-FAD9-mRNA也有显著增加趋势, 但差异不显著。(3) 就Es-FABP3而言, 饲料2#和3#组肝胰腺中表达水平最高,且显著高于饲料1#组(P<0.05), 其余各组间差异不显著; 随着鱼油替代水平的升高, 肝胰腺中Es-FABP9和Es-FABP10-mRNA水平均有先上升后下降趋势, 但各组间差异不显著。综上, 河蟹脂肪酸代谢和转运相关基因在肝胰腺中表达水平最高, 饲料中不同鱼油替代水平对肝胰腺中上述基因mRNA表达水平具有较大影响。
中华绒螯蟹; 鱼油替代; 育肥饲料; 脂质代谢; 脂肪酸结合蛋白
中华绒螯蟹(Eriocheir sinensis H. Milne-Edwards)(以下简称河蟹)是我国重要的养殖蟹类之一, 在水产养殖业中占有极其重要的地位, 每年成蟹养殖产量通常在8×108左右[1]。肌肉、肝胰腺和性腺是河蟹的三大可食部位, 其性腺发育情况直接影响着其食用价值和上市时间, 可食部位的生化组成对其营养价值有着重要作用[2, 3], 先前的研究表明蟹类独特的香气和营养价值与其含有较多的高度不饱脂肪酸(Highly unsaturated fatty acids, HUFA)有关[4, 5]。由于鱼油富含高度不饱和脂肪酸, 通常需要在河蟹育肥饲料(性腺发育期的饲料)中添加较高含量的鱼油来促进其性腺发育, 提高可食组织中的HUFA含量[6, 7]。随着水产养殖业的快速发展, 全球鱼油资源已不能满足水产饲料业的需求, 因此寻求合适的鱼油替代源已势在必行[8]。由于植物油具有来源广泛、价格低廉和总产量大等优点, 故植物油已成为水产饲料中鱼油替代的重要选择[9—11]。由于不同植物油的脂肪酸组成有所不同, 因此不同植物油混合可能起到脂肪酸平衡的作用, 有利于提高替代效果[12—14], 豆油和菜籽油是目前水产饲料最常用的两种植物油, 其脂肪酸和维生素组成具有一定的互补性, 因此采用两者混合在水产饲料上具有一定的优势[15, 16]。
脂肪酸去饱和酶(Fatty acyl desaturase, FAD)、脂肪酸碳链延长酶(Fatty acyl elongase, FAE) 和脂肪酸结合蛋白(Fatty acid binding protein, FABPs)在水生动物脂肪酸代谢和运输过程中扮演着十分重要的角色[17, 18]。相关研究表明, FAD和FAE主要参与高度不饱和脂肪酸的合成, 分别起到脂肪酸去饱和和碳链延长的作用, 饲料中植物油替代鱼油可能显著影响这些基因的表达水平, 如植物油替代鱼油导致大西洋鲑(Salmo salar L.)肝脏中的FAD和FAE-mRNA水平显著提高[19—22]; FABPs在脂肪酸运输和β-氧化中也起着十分重要的作用[23], 其表达水平也会受到饲料中鱼油水平和脂肪酸组成的影响[10]。
迄今为止, 河蟹饲料中鱼油替代的研究报道较少[24, 25], 尚未见河蟹性腺发育阶段饲料(育肥饲料)中鱼油替代的研究。先前的研究表明, 河蟹可能具有一定的HUFA合成能力[26, 27], 这为河蟹饲料中开展鱼油替代提供了可能。河蟹育肥饲料中HUFA组成和含量对河蟹雌体卵巢发育和脂代谢具有一定的影响[7, 28], 尚不清楚饲料中鱼油替代对河蟹雄体性腺发育和脂肪酸代谢的研究报道。近年来, 河蟹脂肪酸碳链延长酶(Es-FAE)、去饱和酶(Es-FAD)和脂肪酸结合蛋白(Es-FABP)等基因先后被克隆,并初步研究了其在幼蟹不同组织中的表达及其对不同脂肪源的响应模式[27, 29—31], 但未见雄体性腺发育阶段的研究报道, 这非常不利于河蟹雄体性腺发育阶段脂质代谢调控的研究和育肥饲料的开发。鉴于此, 本文首先研究了脂肪酸碳链延长酶(Es-FAE)、Δ9脂肪酸去饱和酶(Es-FAD9)、Δ6脂肪酸去饱和酶b (Es-FAD6b)、脂肪酸结合蛋白3 (Es-FABP3)、脂肪酸结合蛋白9 (Es-FABP9)和脂肪酸结合蛋白10 (Es-FABP10)基因在成体雄蟹不同组织中的表达情况, 在此基础上采用混合植物油(豆油∶菜籽油=1∶1)替代鱼油配制5组不同替代水平的育肥饲料进行养殖实验, 研究了饲料中不同鱼油替代水平(0、25%、50%、75%和100%)对雄蟹性腺发育阶段肝胰腺中这些脂肪酸代谢基因表达的影响, 结果可为雄蟹脂质代谢研究、鱼油替代和育肥饲料配制提供基础资料和理论参考。
1 材料与方法
1.1 实验饲料
实验饲料以豆粕、菜籽粕和鱼粉作为主要蛋白源, 采用植物油混合(豆油∶菜籽油=1∶1)替代鱼油, 按表 1配制五种不同鱼油替代水平的实验饲料,鱼油替代水平分别为0、25%、50%、75%和100%(表 1), 分别记为饲料1#、饲料2#、饲料3#、饲料4#和饲料5#。所有饲料原料粉粹后过60目筛, 充分混合后制备成沉性膨化饲料, 粒径4 mm, 长度10 mm左右, 植物油和鱼油按比例混合后采用真空后喷涂方式添加。实验饲料的常规生化成分和脂肪酸组成见表 2。所有实验饲料冷却后保存于-20℃冰箱中备用。
1.2 河蟹来源和养殖管理
实验用蟹采自上海海洋大学崇明基地, 均为生殖蜕壳后的雄蟹, 体重135—165 g, 从中挑选600只附肢健全、体无外伤、活力较好的个体用于实验。为了使研究结果更加接近于养殖实际, 育肥养殖实验在室外小型实验土池中(长×宽×深=7.8 m× 7.8 m×0.7 m)中进行, 土池四周设置双层防逃塑料板, 实验前采用漂白粉对实验土池进行消毒。实验池四周种植部分水稻, 同时放适量水花生, 以净化水质和供河蟹隐蔽, 实验期间水深70 cm左右。每口实验池塘中随机放入25只雄蟹, 每组饲料重复4口实验池塘, 共20口实验池塘。实验用蟹在池塘中暂养3—5d后开始正式实验, 正式实验于2014年9月25日开始。
每日18:00左右投喂对应的实验饲料, 投喂方式为全池均匀泼洒, 同时每池设有食台以观测河蟹摄食情况, 投喂后23h检查食台残饵情况, 饲料投喂量通常占蟹总体重的1%—3%, 具体根据水温和摄食情况等灵活调整。次日上午9:00左右, 检查池塘四周残饵和蟹的死亡情况, 并及时记录。养殖过程中, 每隔3天测定1次水质指标, 根据水质指标每2周左右适当换水或加水, 养殖期间水质指标要求为:pH 7.0—9.0; 平均溶氧>4 mg/L; 氨氮<0.5 mg/L, 亚硝酸盐<0.15 mg/L, 这些均在河蟹养殖的安全水质指标范围内。整个养殖实验共进行60d, 养殖30d采样进行基因表达等研究, 养殖60d实验进行性腺发育、营养品质分析, 本文主要报道脂肪酸代谢相关基因表达的影响。
1.3 样品采集
实验30d后停食1d, 从每个池塘中随机采样2只雄蟹, 每个饲料组合计各8只蟹, 用于脂质代谢相关基因的研究。用吸水纸擦干体表水分后用电子天平称重(精确度=0.01 g), 用游标卡尺(精确度=0.01 mm)测量壳长、壳宽。解剖后用经过灭菌的镊子取出所有肝胰腺和性腺并准确称重, 然后取少量肝胰腺组织液氮速冻后用于研究鱼油替代水平对相关基因表达的影响。同时于2015年1月取经暂养后的成熟雄体5只, 体重为103.84—127.22 g, 称重后分别采集脑神经节、胸神经节、肝胰腺、胃、肠道、心脏、鳃、血淋巴、肌肉、三角膜、生精区、储精囊和副性腺组织用于相关基因表达水平的组织特异性研究。所有RNA提取用样品均保存于-80℃超低温冰箱中, 待用于后续实验。

表 1 实验饲料配方Tab. 1 Formulation of experiental diets (%)
1.4 RNA提取、引物设计和序列验证
取冻存后的河蟹样品液氮研磨后, 采用TaKaRa的RNA提取试剂(TaKaRa, RNAiso Plus,Cat. 9109)提取总RNA, 具体方法按操作说明书进行, 分别采用1%琼脂糖凝胶电泳和紫外分光光度计(Quawell, Q5000)检测RNA的完整度和纯度。各取500 ng总RNA为反转录模板, 采用反转录试剂盒(TaKaRa, Cat.RR036A)进行第一链cDNA合成。按照表 3序列分别合成河蟹内参基因β-actin、脂肪酸碳链延长酶(Es-FAE)、Δ9脂肪酸去饱和酶(Es-FAD9)、Δ6脂肪酸去饱和酶b(Es-FAD6b)、脂肪酸结合蛋白(Es-FABP3)、脂肪酸结合蛋白(Es-FABP9)和脂肪酸结合蛋白(Es-FABP10)基因的上游和下游引物, 其中β-actin、Es-FAD9和Es-FABP3的定量PCR的引物序列和反应体系按照相关文献进行, 其余基因的定量PCR的引物序列是本实验中采用Primer Premier 5.0 软件设计而成(表 3),所有引物均由上海生工生物工程有限公司合成。以河蟹肝胰腺的cDNA为模板, 利用上述引物进行常规PCR扩增, 验证PCR产物是否该目标基因序列,有无非特异性扩增。PCR反应体系为: cDNA模板1 μL, dNTP Mixture (2.5 mmol/L) 4 μL, 上下游引物(10 mmol/L)各0.5 μL, 10×PCR buffer 2.5 μL,rTaq酶(5 U/μL) 0.25 μL, 加灭菌超纯水至总体积25 μL。PCR反应条件为: 94℃预变性5min, 94℃变性30s, 55℃退火30s, 72℃延伸30s, 30个循环;72℃延伸10min, 4℃保存。取PCR产物3 μL经1%琼脂糖凝胶电泳检测扩增结果后, 按琼脂糖凝胶DNA回收试剂盒(天根, Cat. DP209)操作说明书回收纯化PCR特异性扩增产物, 并连接至pMT-19载体(TaKaRa, Cat. D104A), 重组质粒转化至大肠杆菌TOP 10感受态细胞(天根, Cat. CB104-01)中, 转化产物于37℃、200 r/min条件下振荡培养1—2h, 涂布接种后进行蓝白斑筛选, 选出的阳性克隆经菌液PCR初步鉴定后交上海生工生物工程有限公司进行测序。
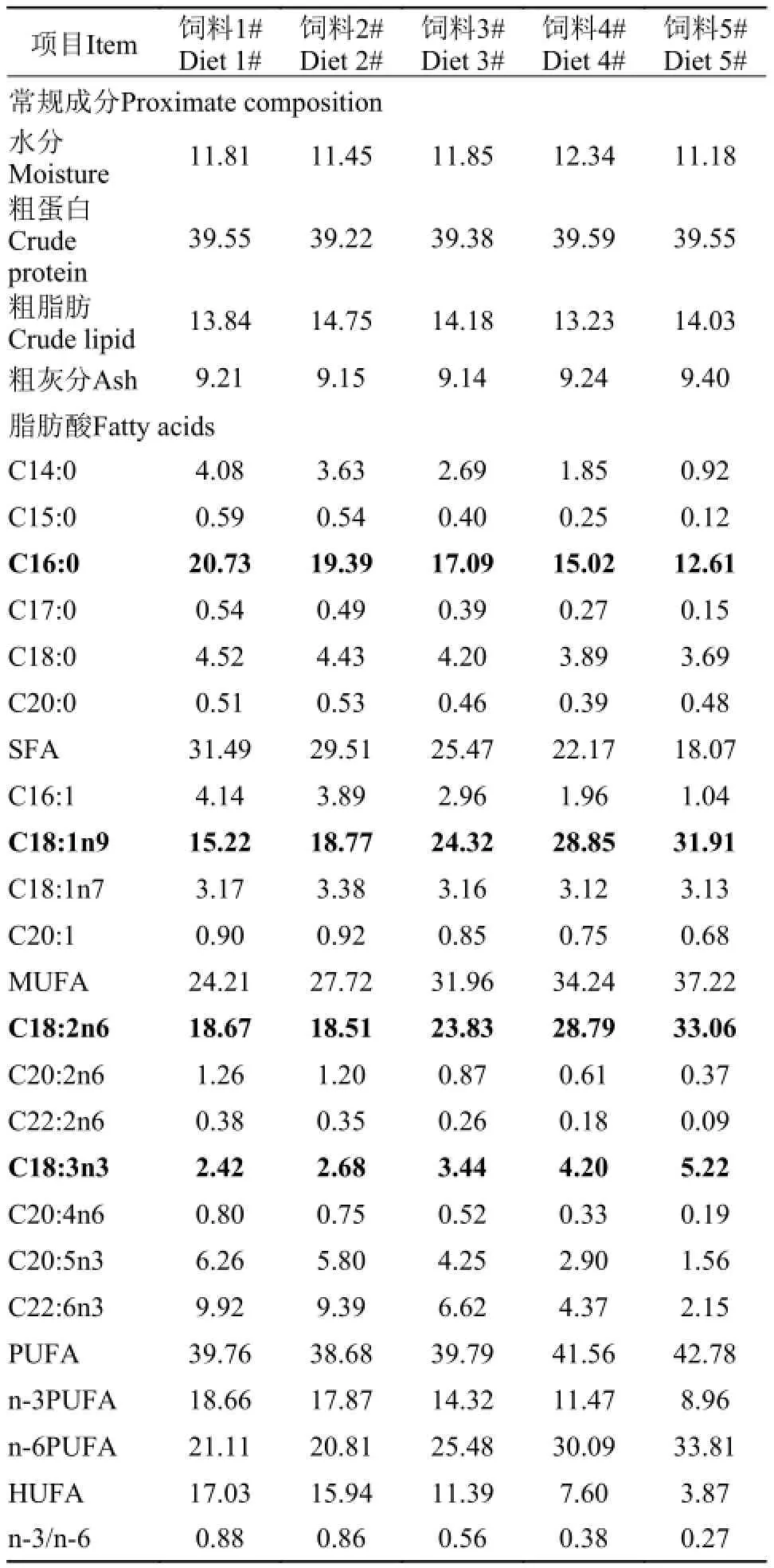
表 2 实验饲料常规成分(%干重)及脂肪酸组成(%总脂肪酸)Tab. 2 Proximate composition (% dry weight) and fatty acid composition (% of total fatty acids) of experimental diets
1.5 实时荧光定量PCR (qRT-PCR)
按照TaKaRa荧光定量PCR试剂盒(TaKaRa,Cat. RR420A)说明, 将模板cDNA梯度稀释后进行标准曲线扩增。当无非特异性扩增, 目标基因和内参基因的扩增效率在95%—105%, 标准曲线R2>0.99时, 确定qRT-PCR反应体系与条件。qRTPCR的反应体系见表 4, Es-FAE反应条件为:95℃预变性30s; 95℃变性5s, 60.4℃退火30s, 40个循环; Es-FABP10反应条件为: 95℃预变性30s;95℃变性5s, 60.5℃退火30s, 40个循环; Es-FAD6b、Es-FAD9、Es-FABP3和Es-FABP9反应条件为: 95℃预变性30s; 95℃变性5s, 60℃退火30s,40个循环。qRT-PCR反应体系与条件确定后, 首先采用成熟雄体的脑神经节、胸神经节、肝胰腺、胃、肠道、心脏、鳃、血淋巴、肌肉、三角膜、生精区、储精囊和副性腺组织的cDNA, 研究脂质代谢相关基因在各组织中mRNA表达水平差异, 每个样品重复3次, 每个组织重复5只个体; 然后再研究饲料中不同鱼油替代水平对肝胰腺中脂质代谢相关基因mRNA表达水平的影响, 每个样品重复3次, 每个饲料组重复8只个体。
1.6 数据处理
荧光定量PCR数据分析采用2-ΔΔCt法计算脂质代谢相关基因的表达水平(通过公式ΔΔCt=ΔCt样品-ΔCt对照, 计算ΔΔCt), 用SPSS 18.0软件对实验数据进行统计分析, 所有数据均以平均值±标准误(X±SE)表示。采用Levene's法对所有数据进行方差齐性检验, 当不满足齐性方差时对百分比数据进行反正弦或平方根处理。采用ANOVA对实验结果进行方差分析, 采用Duncan法进行多重比较, 取P<0.05为差异显著。
2 结果
2.1 脂质代谢相关基因在不同组织中的表达情况
由图 1—6可见, 6个脂质代谢相关基因在河蟹脑神经节、胸神经节、肝胰腺、胃、肠道、心脏、鳃、血淋巴、肌肉、三角膜、生精区、储精囊和副性腺中广泛表达, 整体上肝胰腺中这6个基因的表达水平均高于其他组织, 但是各基因在不同组织中的表达模式有所差异。就Es-FAE而言, 肝胰腺中表达水平极显著高于其他组织(P<0.01, 图 1),然后是肠道、鳃和胃中Es-FAE-mRNA表达水平依次降低, 相对表达量为肝胰腺中的1/350—1/30, 其余依次为三角膜>储精囊>胸神经节>脑神经节>副性腺>血淋巴>生精区>肌肉>心脏; 就Es-FAD6b而言, 主要在肝胰腺、三角膜、肌肉、胸神经节、脑神经节和储精囊表达, 这些组织中Es-FAD6bmRNA相对表达水平均大于100, 心脏中相对表达水平最低; 就Es-FAD9而言, 主要在肝胰腺、脑神经节、胸神经节、副性腺和储精囊中表达, 其中肝胰腺中表达水平比储精囊中高6.4倍左右, 血淋巴Es-FAD9-mRNA相对表达水平最低, 整体上, 不同组织中Es-FAD9-mRNA相对表达水平差异小于Es-FAD6b。就Es-FABP3而言, 肝胰腺中表达水平显著高于其他组织(P<0.05, 图 4), 其次主要在肌肉、副性腺、生精区、胸神经节和储精囊中表达, 这些组织中Es-FABP3-mRNA相对表达水平均大于300, 肠道、心脏、脑神经节、鳃、胃和三角膜表达水平在25—144, 血淋巴中相对表达水平最低; 就Es-FABP9而言, 主要在副性腺、储精囊和肝胰腺、鳃和生精区中表达, 其余组织中相对表达水平均低于10, 也是血淋巴中表达水平最低; 就Es-FABP10而言, 肝胰腺中表达水平显著高于其他组织(P<0.05,图 6), 其余依次为肌肉>胸神经节>血淋巴>肠道>生精区>胃>脑神经节>鳃>储精囊>三角膜>副性腺>心脏, Es-FABP10在这些组织中的表达水平依次显著下降, 其中心脏中Es-FABP10表达水平最低。

表 3 各基因的荧光定量PCR引物序列和来源Tab. 3 Nucleotide sequences and source of the primers used for qRT-PCR

表 4 目标基因和内参基因定量PCR反应体系的试剂添加量Tab. 4 The setup for qRT-PCR of target gene and β-actin (μL)
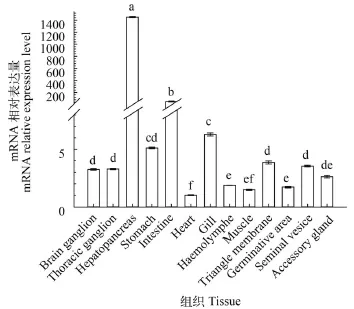
图 1 河蟹十三种组织中的Es-FAE-mRNA表达差异分析Fig. 1 The expression of Es-FAE-mRNA in thirteen tissues of E. Sinensis

图 2 河蟹13种组织中的Es-FAD6-mRNA表达差异分析Fig. 2 The expression of Es-FAD6-mRNA in thirteen tissues of E. sinensis
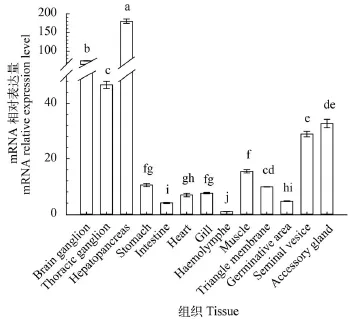
图 3 河蟹13种组织中的Es-FAD9-mRNA表达差异分析Fig. 3 The expression of Es-FAD9-mRNA in thirteen tissues of E. sinensis
2.2 育肥饲料中鱼油替代水平对肝胰腺中Es-FAE和Es-FAD基因表达的影响
育肥饲料中不同鱼油替代水平对肝胰腺中Es-FAE和Es-FAD6b的mRNA表达水平影响显著(P<0.05), 对Es-FAD9-mRNA表达水平无显著影响(图 7)。就Es-FAE而言, 饲料5#组表达水平最高, 饲料1#组表达水平最低, 饲料3#和4#组中表达水平接近, 但与饲料5#组差异不显著(P>0.05), 整体上, 随着鱼油替代水平的增加, Es-FAE-mRNA表达水平有增加趋势; 就Es-FAD6b而言, 饲料3#组显著高于饲料2#组, 其余各组间差异不显著(P>0.05); 饲料1#—3#组中肝胰腺中的Es-FAD9-mRNA表达水平也有增加趋势, 但是表达水平差异不显著。
2.3 育肥饲料中鱼油替代水平对肝胰腺中Es-FABP基因表达水平的影响
育肥饲料中不同鱼油替代水平仅对肝胰腺中Es-FABP3-mRNA表达水平影响显著(P<0.05), 对Es-FABP9和Es-FABP10的mRNA表达水平无显著影响(图 7)。就Es-FABP3而言, 饲料2#和饲料3#组肝胰腺中表达水平最高且显著高于饲料1#组(P<0.05), 其余各组间差异不显著(P>0.05); 就Es-FABP9而言, 饲料5#组肝胰腺表达水平最低, 饲料2#和4#组Es-FABP9-mRNA表达水平相对较高, 但各组间表达水平差异不显著(P>0.05); 就肝胰腺中Es-FABP10-mRNA而言, 饲料1#—3#组肝胰腺中Es-FABP10-mRNA表达水平有增加趋势, 饲料3#—5#组中有下降趋势, 但是各组间表达水平差异均不显著(P>0.05)。

图 4 河蟹13种组织中的Es-FABP3-mRNA表达差异分析Fig. 4 The expression of Es-FABP3-mRNA in thirteen tissues of E. sinensis

图 5 河蟹13种组织中的Es-FABP9-mRNA表达差异分析Fig. 5 The expression of Es-FABP9-mRNA in thirteen tissues of E. sinensis
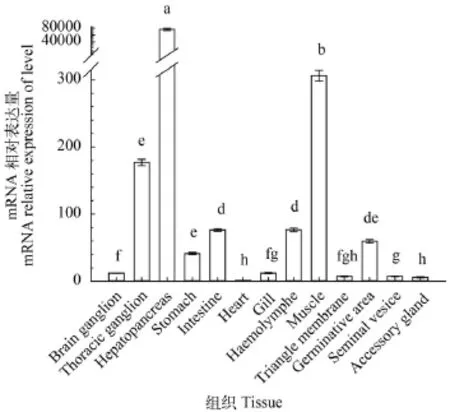
图 6 河蟹13种组织中的Es-FABP10-mRNA表达差异分析Fig. 6 The expression of Es-FABP10-mRNA in thirteen tissues of E. sinensis
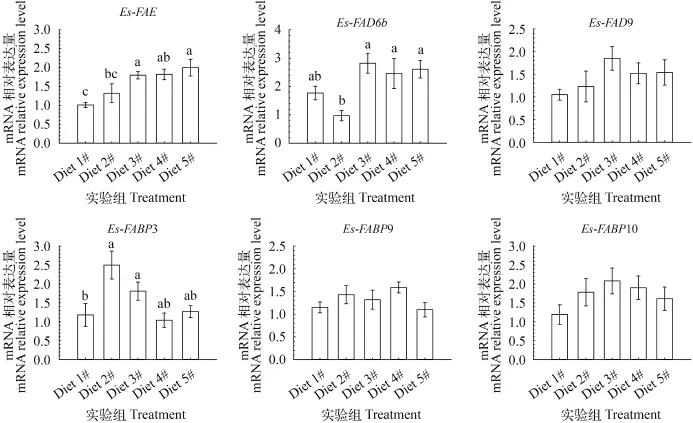
图 7 不同鱼油替代水平对河蟹雄体肝胰腺脂质代谢相关基因(Es-FAE、Es-FAD6bb、Es-FAD9、Es-FABP3、Es-FABP9及Es-FABP10)表达的影响Fig. 7 Effects of different fish oil level on the expression of hepatopancreas fatty acid metabolism-related genes (Es-FAE, Es-FAD6b, Es-FAD9, Es-FABP3, Es-FABP9 and Es-FABP10)
3 讨论
3.1 基因表达的组织特异性及其可能功能
本实验中的6个脂质代谢相关基因在河蟹脑神经节、胸神经节、肝胰腺、胃、肠道、心脏、鳃、血淋巴、肌肉、三角膜、生精区、储精囊和副性腺中广泛表达, 但是各基因在不同组织中的表达模式有所不同, 这也暗示这些基因在不同组织中的生理功能可能具有一定差异。肝胰腺是甲壳动物脂质代谢的主要场所, 河蟹体内长链多不饱和脂肪酸(LC-PUFA)可能主要在肝胰腺中合成[26, 27], 因此, 参与LC-PUFA合成的FAE和FAD可能在肝胰腺中高度表达, 因此河蟹肝胰腺中FAE和FAD表达水平最高。FAD除了参与脂肪酸合成外, 可能还具有其他生理功能, 如消化吸收和渗透压调节等[33]。肠道、鳃和胃中Es-FAE-mRNA表达水平处于中高等水平, 可能因为这些器官是河蟹的能量代谢和消化吸收器官, 能量代谢旺盛。
FAD6是动物体由18:2n6和18:3n3合成HUFA一类关键去饱和酶, FAD9是饱和脂肪酸到单不饱和脂肪酸的重要去饱和酶, 它们对于MUFA和HUFA的合成至关重要[34, 35]。河蟹Es-FAD6b和Es-FAD9主要在肝胰腺、胸神经节、脑神经节和储精囊表达, 胸神经节和脑神经节等神经组织中具有较高含量的HUFA, 推测FAD6和FAD9高表达水平可能 是为了维持其组织中较高水平的HUFA[36]。此外, 在河蟹三角膜和肌肉中也具有较高的Es-FAD6b表达水平, 这暗示这两种组织可能也具有一定的HUFA合成能力, 且三角膜和肌肉通常也具有较高含量的EPA和ARA, 以维持细胞膜的流动性和免疫性能[7, 26], 因此也需要较高水平的Es-FAD6bmRNA来参与HUFA的合成。类似的现象在虹鳟(Oncorhynchus mykiss)和草鱼(Ctenopharyngodon idellus)中也有报道[37, 38]。整体而言, 不同FAD在不同组织中的表达模式并不完全一致, 这可能是由于他们在各组织中的作用不同造成的。
FABPs主要参与脂肪酸的运输和转录调控, 他们通过与脂肪酸结合将脂肪酸由细胞内运输到各个细胞器或细胞核上, 进行氧化代谢或者脂类合成等[39, 40]。先前对鱼类的研究表明, 大西洋鲑的红肌和白肌FABP3表达量最高, 主要是负责细胞内脂肪酸β-氧化的运送蛋白, 在肝脏中表达水平较低[41];关于肺鱼(Lepidosiren paradoxa)的研究发现, FABP10 和18:1n9结合力较高且主要在肝胰腺中表达[42]。本研究结果表明, 三种河蟹FABP均在肝胰腺中表达水平较高, 但是其在其他组织中的表达情况也存在较大差异, 如Es-FABP3和Es-FABP9在雄体生殖系统中表达水平相对较高, Es-FABP3和Es-FABP10在肌肉中表达水平也较高。Es-FABPs在河蟹肝胰腺中表达水平较高, 可能是因为肝胰腺中脂类吸收、转运和氧化供能比较旺盛, 这些过程需要FABPs的广泛参与, 类似的现象在拟穴青蟹(Scylla paramamosain)中也有发现[43]。Es-FABP9和Es-FABP3在河蟹副性腺、储精囊和和生精区中表达水平较高, 可能因为精子发生需要较多的脂肪酸参与, 尤其是ARA和DHA对于精子发生、精巢发育和维持精子活力具有多种生理功能[44], 推测Es-FABP9和Es-FABP3在河蟹雄体精子发生和精巢发育中具有重要的功能, 因此在雄体生殖系统中这两种基因的表达水平较高。Es-FABP3和Es-FABP10在河蟹肌肉中表达水平也较高, 这可能与其参与免疫调节, 与RXRs(类视黄醇X受体)和PPARs(过氧化物酶体增殖物激活受体)等核受体竞争性结合有关[29, 45]。
3.2 鱼油替代对脂肪酸合成基因表达调控的影响
本研究结果表明, 随着鱼油替代水平的增加,Es-FAE-mRNA表达水平有增加趋势, 推测是饲料中低水平的n-3 LC-PUFA诱导FAE基因表达量的升高[46], 类似的现象在大西洋鲑(Atlantic salmon)肝脏中也有发现[47]。LC-PUFA合成过程受FAE影响较大, FAE主要功能是将C18脂肪酸延长为C20脂肪酸, 对不同碳链长度的脂肪酸结合效率依次为C18>C20>C22[48], 饵料中存在较多的LC-PUFA,抑制了脂肪酸碳链延长酶(FAE)和去饱和酶(FAD)的活性和催化效率[49]。FAD9动物体最常见的一种去饱和酶, 其主要功能是将饱和脂肪酸转变为Δ-9单不饱和脂肪酸[31, 35, 50]。FAD9基因的表达水平受发育情况、饲料、激素和环境等多种因素的影响, 通常其表达水平随着饵料中LC-PUFA和C18-PUFA的升高而降低[51]。FAD6是LC-PUFA合成路径中的主要限速酶, 通常在海水鱼类和甲壳动物中表达水平较低[52, 53], 因此需要在其饲料中添加适量的LCPUFA才能保证其正常生长发育和免疫调节等功能[54]。本研究结果表明, 在50%以上的鱼油替代水平时, 河蟹肝胰腺中的FAD6和FAD9的基因表达水平均有增加趋势, 当替代水平超过50%时, 其表达水平略有下降。这可能是因为适量植物油替代鱼油, 可以促进FAD6和FAD9的基因表达水平提高,有利于LC-PUFA的合成, 但是过量植物油替代鱼油, 饲料中的C18:2n6和C18:3n3含量显著升高, 这些C18-PUFA抑制了这两种去饱和酶基因的表达。
3.3 鱼油替代对Es-FABP的表达调控的影响
由于不同FABPs可能与不同脂肪酸的结合力不同, 且饲料中植物油替代鱼油导致饲料中脂肪酸组成发生变化, 故饲料中植物油替代鱼油可能会影响FABPs的基因表达情况[11, 42]。斑马鱼(Danio rerio)的FABP3主要介导脂肪酸的转运过程, 将脂肪酸运送到相关组织进行β-氧化为机体提供能量[55]; 鲶(Silurus asotus)的FABP10与18:1n-9具有较高亲和力, 因此其表达水平容易受到饲料中18:1n-9水平的影响[42]。目前, 有关饲料中鱼油替代对水生动物FABP表达影响的研究较少, 且结论并不一致, 如大西洋鲑肝脏中的FABP10基因的表达水平不受饲料脂肪源影响[41, 56]; 但饲料中豆油替代鱼油可以显著提高团头鲂(Megalobrama amblyce-phala)和日本沼虾(Macrobrachium nipponense)的FABP基因表达水平[56, 57]。造成这种差异的原因可能与FABP种类、鱼油替代脂肪源和不同水生动物脂代谢的特性有关。本研究结果表明, 豆油和菜籽油混合替代鱼油后, 河蟹肝胰腺中FABP3、FABP9和FABP10-mRNA表达水平均出现先上升后下降趋势, 但是仅Es-FABP3-mRNA水平出现显著变化, 这可能与这三种FABP与不同脂肪酸的结合效率有关,因此其mRNA表达水平对饲料中脂肪酸变化的响应有所不同。本研究中, 随着鱼油替代水平的升高,饲料中18:1n-9、C18:2n6和C18:3n3含量均显著上升, 人类H-FABP与18:1n-9亲和力较高[58], 推测这些脂肪酸含量的上升促进了其Es-FABP3-mRNA表达水平的提高。
综上所述, 河蟹脂肪酸代谢和转运相关基因在肝胰腺中表达水平最高, 肝胰腺中脂肪酸去饱和酶和碳链延长酶受饲料中不同鱼油替代水平的影响较大, 不同脂肪酸结合蛋白的mRNA表达水平对饲料中鱼油替代水平的响应有所不同。进一步研究需要探明河蟹关键脂肪酸合成酶和转运蛋白对不同脂肪酸的作用效率和优先顺序, 从而为河蟹饲料中植物油合理替代鱼油提供科学依据。
[1]The People's Republic of China Ministry of Agriculture,Fisheries Bureau. China Fishery Statistical Yearbook [R]. Beijing: China Agriculture Press. 2015 [农业部渔业渔政管理局编.中国渔业统计年鉴. 北京: 中国农业出版社,2015]
[2]Wu X G, Cheng Y X, Sui L X, et al. Biochemical composition from pond-reared and lake-stocked adult Eriocheir sinensis [J]. Aquaculture Research, 2007a, 38:1459—1467
[3]Shao L C, Wang C, He J, et al. Hepatopancreas and gonad quality of Chinese mitten crab fattened with natural and formulated diets [J]. Food Quality, 2013, 36(3):217—227
[4]Wu X G, Cheng Y X, Shen H, et al. Effect of dietary phospholipid and highly unsaturated fatty acids on fattening and ovarian development of Chinese mitten-handed crab (Eriocheir sinensis) [J]. Journal of Shanghai Normal University (Natural Sciences), 2004, 33(Suppl):33—41 [吴旭干, 成永旭, 沈竑, 等. 饲料中磷脂和高度不饱和脂肪酸对中华绒螯蟹育肥和卵巢发育的影响.上海师范大学学报(自然科学版), 2004, 33(增刊):33—41]
[5]Gao X C, Wang X C, Gu S Q, et al. The contribution of crab gonad lipids to gonad aroma [J]. Guangdong Agricultural Sciences, 2014, 41(2): 128—132 [高先楚, 王锡昌, 顾赛麒, 等. 蟹性腺中的脂质对性腺香气的作用. 广东农业科学, 2014, 41(2): 128—132]
[6]Wen X B, Chen L Q, Ai C X, et al. Reproduction response of Chinese mitten-handed crab (Eriocheir sinensis) fed different sources of dietary lipid [J]. Comparative Biochemistry and Physiology A-molecular and Integrative Physiology, 2002, 131A (3): 675—681
[7]Wu X G, Cheng Y X, Nan T Z, et al. Effect of dietary supplementation of phospholipid and highly unsaturated fatty acids on reproductive performance and offspring quality of the Chinese mitten crab (Eriocheir sinensis) broodstock [J]. Aquaculture, 2007b, 273(4): 602—613
[8]Tacon A J, Metian M. Global overview on the use of fish meal and fish oil in industrially compounded aquafeeds:Trends and future prospects [J]. Aquaculture, 2008,285(14):146—158
[9]Nasopoulou C, Zabetakis I. Benefits of fish oil replacement by plant originated oils in compounded fish feeds. A review [J]. LWT-Food Science and Technology, 2012,47(2): 217—224
[10]Zhou J X, Torstensen B E, Stubhaug I, et al. Effects of replacing fish oil with soybean oil on fatty acid metabolism in hepatocytes of Atlantic Salmon (Salmo Salar L.) [J]. Chinese Journal of Animal Nutrition, 2013, 25(11):2623—2632 [周继术, Torstensen B E, Stubhaug I, 等. 饲料中大豆油替代鱼油对大西洋鲑肝细胞脂肪酸代谢的影响. 动物营养学报, 2013, 25(11): 2623—2632]
[11]Zhou J X, Torstensen B E, Stubhaug I. Oleic acid transmembrane uptake in hepatocytes of Atlantic salmon (Salmo salar L.) and effects of replacing fish oil with vegetable oil [J]. Acta Hydrobiologica Sinica, 2014, 38(1):121—128 [周继术, Torstensen B E, Stubhaug I. 饲料中植物油替代鱼油对大西洋鲑肝细胞油酸跨膜吸收的影响. 水生生物学报, 2014, 38(1): 121—128]
[12]Gunstone F D. The world's oils and fat. In: Turchini G M,Ng W K, Tocher D R (Eds.), Fish Oil Replacement and Alternation Lipid Sources in Aquaculture Feeds [M]. CRC Press, Boca Roton, FL. 2011, 61—98
[13]Glencross B D, Turchini G M. Fish oil replacement in starter, grow-out, and finishing feed for farmed aquatic animal. In: Turchini G M, NG W K, Tocher D R (Eds.),Fish Oil Replacement and Alternation Lipid Sources in Aquaculture Feeds [M]. CRC Press, Boca Roton, FL. 2011, 373—404
[14]Bogevik A S, Rathore R M, Arjona Y, et al. Dietary plant oils delay early sexual maturation compared with marine fish oil in male European seabass (Dicentrarchus labrax)-Effects on testis histology and key reproductive hormones [J]. Aquculture, 2014, 431: 73—84
[15]Brown P B, Hart S D. Soybean oil and other n-6 polyunsaturated fatty acid-rich vegetable oils. In: Turchini G M,Ng W K, Tocher D R. Fish Oil Replacement and Alternation Lipid Sources in Aquaculture Feeds [M]. CRC Press,Boca Roton, FL. 2011, 133—160
[16]Turchini G M, Francis D S, Senadheera S P S D, et al. Fish oil replacement with different vegetable oils in Murray cod: Evidence of an “omega-3 sparing effect” by other dietary fatty acids [J]. Aquaculture, 2011, 315(34):250—259
[17]Esteves A, Ehrlich R. Invertebrate intracellular fatty acid binding proteins [J]. Comparative Biochemistry and Physiology C-toxicology and Pharmacology B, 2006,142: 262—274
[18]Morais S, Pratoomyot J, Taggart J B, et al. Genotype-spe-cific responses in Atlantic salmon (Salmo salar) subject to dietary fish oil replacement by vegetable oil: a liver transcriptomic analysis [J]. Bmc Genomics, 2011, 12(21):255—272
[19]Stubhaug I, Fryland L, Torstensen B E. β-oxidation capacity of red and white muscle and liver in Atlantic salmon (Salmo salar L.) - effects of increasing dietary rapeseed oil and olive oil to replace capelin oil [J]. Lipids, 2005a,40: 39—47
[20]Stubhaug I, Tocher D R, Bell J G, et al. Fatty acid metabolism in Atlantic salmon (Salmo salar L.) hepatocytes and influence of dietary vegetable oil [J]. Biochimica et Biophysica Acta-molecular and Cell Biology of Lipids,2005b, 1734: 277—288
[21]Zheng X Z, Torstensen B E, Tocher D R, et al. Environmental and dietary influences on highly unsaturated fatty acid biosynthesis and expression of fatty acyl desaturase and elongase genes in liver of Atlantic salmon (Salmo salar) [J]. Biochimica et Biophysica Acta-molecular and Cell Biology of Lipids, 2005b, 1734: 13—24
[22]Moya-Falcón C, Hvattum E, Tran T N, et al. Phospholipid molecular species, β-oxidation, desaturation and elongation of fatty acids in Atlantic salmon hepatocytes:effects of temperature and 3-thia fatty acids [J]. Comparative Biochemistry and Physiology, 2006, 145B: 68—80
[23]Kaikaus R M, Bass N M, Ockner R K. Functions of fatty acid binding proteins [J]. Experimetia, 1990, 46(6):617—630
[24]Qiu R J, Cheng Y X, Wu X G, et al. Effect of dietary lipid sources on immune function, metabolism and resistance to hypoxia in Chinese mitten crab (Eriocheir sinensis) [J]. Chinese Journal of Zoology, 2012, (1): 78—87[邱仁杰, 成永旭, 吴旭干, 等. 投喂不同油脂饲料对中华绒螯蟹免疫、代谢及耐低氧性能的影响. 动物学杂志,2012, (1): 78—87]
[25]Chen Y L, Li E C, Yu N, et al. Effects of replacing fish oil with soybean oil on growth, nonspecific immune response, and resistance to Aeromonas hydrophila challenge in Chinese mitten crab (Eriocheir sinensis) [J]. Journal of Fishery Sciences of China, 2014, 21(3):511—521 [陈彦良, 李二超, 禹娜, 等. 豆油替代鱼油对中华绒螯蟹幼蟹生长、非特异性免疫和抗病力的影响.中国水产科学, 2014, 21(3): 511—521]
[26]Wu X G, Chang G L, Cheng Y X, et al. Effects of dietary phospholipid and highly unsaturated fatty acids on the gonadal development, tissue proximate composition, lipid class and fatty acid composition of precocious Chinese mitten crab, Eriocheir sinensis [J]. Aquaculture Nutrition, 2010, 16(1): 25—36
[27]Yang Z, Guo Z, Ji L, et al. Cloning and tissue distribution of a fatty acyl Δ6-desaturase-like gene and effects of dietary lipid levels on its expression in the hepatopancreas of Chinese mitten crab (Eriocheir sinensis) [J]. Comparative Biochemistry and Physiology, Part B, 2013,165: 99—105
[28]Sui L Y, Sun H X, Wu X G, et al. Effect of dietary HUFA on tissue fatty acid composition and reproductive performance of Chinese mitten crab Eriocheir sinensis (H. Milne-Edwards) broodstock [J]. Aquaculture International, 2011, 19: 269—282
[29]Gong Y N, Li W W, Sun J L, et al. Molecular cloning and tissue expression of the fatty acid-binding protein (Es-FABP) gene in female Chinese mitten crab (Eriocheir sinensis) [J]. BMC Molecular Biology, 2010, 11(2): 71
[30]Li W W, Jin X K, He L, et al. Molecular cloning and tissue expression of the fatty acid-binding protein (Es-FABP9) gene in the reproduction seasons of Chinese mitten crab, Eriocheir sinensis [J]. Molecular Biology Reports, 2011, 38(8): 5169—5177
[31]Guo Z H, Yang Z G, Cheng Y X, et al. Molecular characterization, tissue expression of acyl-CoA Δ9-desaturaselike gene, and effects of dietary lipid levels on its expression in the hepatopancreas of the Chinese mitten crab (Eriocheir sinensis) [J]. Aquaculture, 2013: 58—65
[32]Tan S J, Zhang X, Jin X K et al. Fatty acid binding protein FABP3 from Chinese mitten crab Eriocheir sinensis participates in antimicrobial responses [J]. Fish & Shellfish Immunology, 2015, 43: 264—274
[33]Cameron D J, Tong Z, Yang Z, et al. Essential role of Elovl4 in very long chain fatty acid synthesis, skin permeability barrier function, and neonatal survival [J]. International Journal of Biological Sciences, 2007, 3:111—119
[34]Tocher D R, Bell J G, Dick J R, et al. Effects of dietary vegetable oil in Atalntic salmon hepatocyte fatty acid desaturation and liver fatty acid composition [J]. Lipids,2003, 38: 723—732
[35]Zhang D D, Lu K L, Dong Z J, et al.The effect of exposure to a high-fat diet on microRNA expression in the liver of blunt snout bream (Megalobrama amblycephala)[J]. Plos One, 2014, 9(5): e96132
[36]Gonzalezrovira A, Mourente G, Zheng X, et al. Molecular and functional characterization and expression analysis of a Delta 6 fatty acyl desaturase cDNA of European Sea Bass (Dicentrarchus labrax L.) [J]. Aquaculture,2009, 298: 90—100
[37]Seiliez I, Panserat S, Kaushik S, et al. Cloning, tissue distribution and nutritional regulation of a delta-6 desaturase-like enzyme in rainbow trout [J]. Comparative Biochemistry and Physiology Part B, 2001, 130: 83—93
[38]Chang B E, Hsieh S L, Kuo C M. Molecular cloning of full-length cDNA encoding delta-9 desaturase through PCR strategies and its genomic organization and expression in grass carp (Ctenopharyngodon idella) [J]. Molecular Reproduction and Development, 2001, 58: 245—254
[39]Yamamoto T, Yamamoto A, Watanabe M, et al. Classi-fication of FABP isoforms and tissues based on quantitative evaluation of transcript levels of these isoforms in various rat tissues [J]. Biotechnology Letters, 2009,31(11): 1695—1701
[40]Ozawa S, Ueda S, Li Y, et al. Fatty acid binding protein 3 as a potential mediator for diabetic nephropathy in eNOS deficient mouse [J]. Biochemical & Biophysical Research Communications, 2014, 454(4): 531—536
[41]Jordal A, Hordvik I, Pelsers M, et al. FABP3 and FABP10 in Atlantic salmon (Salmo salar L.)-general effects of dietary fatty acid composition and life cycle variations [J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2006, 145(2):147—158
[42]Di Pietro S M, Santomé J A. Structural and biochemical characterization of the lungfish (Lepidosiren paradoxa)liver basic fatty acid binding protein [J]. Archives of Biochemistry & Biophysics, 2001, 388(1): 81—90
[43]Zeng X, Ye H, Yang Y, et al. Molecular cloning and functional analysis of the fatty acid-binding protein (Sp-FABP) gene in the mud crab (Scylla paramamosain) [J]. Genetics & Molecular Biology, 2013, 36(1): 140—147
[44]Abayasekara D R E, Wathes D C. Effect of altering dietary fatty acid composition on prostaglandin synthesis and fertility [J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 1999, 61(5): 275—287
[45]Schroeder F, Petrescu A D, Huang H, et al. Role of fatty acid binding proteins and long chain fatty acids in modulating nuclear receptors and gene transcription [J]. Lipids,2008, 43: 1—17
[46]Mateos H T, Lewowski P A, Su X Q. Effects of dietary fish oil replacement with flaxseed oil on tissue fatty acid composition and expression of desaturase and elongase genes [J]. Journal of the Science of Food & Agriculture,2012, 92(2): 418—426
[47]Agaba M, Tocher D R, Dickson C, et al. A zebrafish cDNA encoding a multifunctional enzyme involved in the elongation of polyunsaturated, monounsaturated and saturated fatty acids [J]. Marine Biotechnology, 2004, 6:251—261
[48]Zheng X Z, Tocher D R, Dickson C A, et al. Effects of diets containing vegetable oil on expression of genes involved in polyunsaturated fatty acid biosynthesis in liver of Atlantic salmon (Salmo salar) [J]. Aquaculture, 2004,236(1): 467—483
[49]Tocher D R, Fonseca-Madrigal J, Dick J R, et al. Effects of water temperature and diets containing palm oil on fatty acid desaturation and oxidation in hepatocytes and intestinal enterocytes of rainbow trout (Oncorhynchus mykiss) [J]. Comparative Biochemistry and Physiology,Part B, 2004, 137: 49—93
[50]Eigenheer A L, Young S, Blomquist G J, et al. Isolation and molecular characterization of Musca domestica delta-9 desaturase sequences [J]. Insect Molecular Biology,2002, 11(6): 533—542
[51]Ntambi J M, Miyazaki M. Regulation of stearoyl-CoA desaturases and role in metabolism [J]. Progress in Lipid Research, 2004, 43: 91—104
[52]Brenner R R. Nutritional and hormonal factors influencing desaturation of essential fatty acids [J]. Progress in Lipid Research, 1981, 20: 41—47
[53]González A. Molecular and functional characterization and expression analysis of a Δ6 fatty acyl desaturase cDNA of European Sea Bass (Dicentrarchus labrax L.)[J]. Aquaculture, 2009, 298(1): 90—100
[54]Turchini G M, Torstensen B E, Wing-Keong N. Fish oil replacement in finfish nutrition [J]. Reviews in Aquaculture, 2009, 1(1): 10—57
[55]Liu R Z, Denovan-Wright E M, Wright J M. Structure,linkage mapping and expression of the heart-type fatty acid-binding protein gene (fabp3) from zebrafish (Danio rerio) [J]. European Journal of Biochemistry, 2003a, 270:3223—3234
[56]Li Y, Liang X, Zhang Y, et al. Effects of different dietary soybean oil levels on growth, lipid deposition, tissues fatty acid composition and hepatic lipid metabolism related gene expressions in blunt snout bream (Megalobrama amblycephala) juvenile [J]. Aquculture, 2016, 451:16—23
[57]Ding Z L, Chen L Q, Qin J G, et al. Molecular cloning,characterization and expression analysis of the fatty acidbinding protein (MnFABP), involved in dietary lipid sources response in oriental river prawn, Macrobrachium nipponense [J]. Aquaculture Nutrition, 2014, 20(4):399—409
[58]Veerkamp J H, van Moerkerk H T B, Prinsen C F M, et al. Structural and functional studies on different human FABP types [J]. Molecular & Cellular Biochemistry,1999, 192(12): 137—142
EFFECTS OF FISH OIL REPLACEMENT BY VEGETABLE OILS IN FATTENING DIETS ON THE RELATED GENE EXPRESSION OF FATTY ACID METABOLISM OF ADULT MALE CHINESE MITTEN CRAB, ERIOCHEIR SINENSIS
LIU Ze-Hua1, WU Xu-Ga1, 2, LONG Xiao-Wen1, ZHAO Lei1, LI Jia-Yao1, 2and CHENG Yong-Xu1, 2
(1. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University,Shanghai 201306, China; 2. Collaborative Innovation Center of Aquatic Animal Breeding Center Certificated by Shanghai Municipal Education Commission, Shanghai Ocean University, Shanghai 201306, China)
Fish oil is one of the major aquafeed ingredients, however, the world fish oil production could not meet the demand of global aquafeed industry. Thus, fish oil replacement have became a hot topic for the research and development of aquaculture. Chinese mitten crab Eriocheir sinensis is an important aquaculture species in China, and the previous study has shown the dietary substitution of fish oil with vegetable oil negatively impact the gonadal development and nutritional quality of this species possibly via lipid metabolism. The present study investigated the expression pattern of fatty acid metabolism-related genes, including fatty acyl elongase (Es-FAE), Δ9 fatty acyl desaturase (Es-FAD9), Δ6 fatty acyl desaturase (Es-FAD6b), fatty acid-binding protein 3 (Es-FABP3), fatty acid-binding protein 9 (Es-FABP9) and fatty acid-binding protein 10 (Es-FABP10), and their expression by different fish oil replacement levels (i.e. 0, 25%, 50%, 75% and 100%) in the hepatopancreas of E. sinensis. The results indicated that Es-FAE, Es-FAD9 and Es-FAD6b had the highest expression levels in hepatopancreas but low expression levels in heart and haemolymph, and that Es-FABP3, Es-FABP9 and Es-FABP10 were mainly distributed in hepatopancreas, muscle, seminal and accessory gland whereas the relatively low expression levels in stomach, intestine and heart. The Es-FAE-mRNA expression level in hepatopancreas significantly increased with the increasing dietary fish oil replacement levels. Diet 2# treatment had significantly higher Es-FAD6b-mRNA expression level than the Diet 3# treatment but no significant difference among other treatments. Decreasing dietary fish oil contents reduced the expression of the Es-FAD9 in hepatopancreas but without significant difference. (3) Diet 2# and Diet 3# but not other treatments significantly induced Es-FABP3-mRNA expression in hepatopancreas (P<0.05). Dietary fish oil replacement did not significantly regulate Es-FABP9 and Es-FABP10-mRNA expression but had trend of ‘low-high-low' in the hepatopancreas among the five treatments. These results indicated that hepatopancreas had the highest mRNA expression of the genes related to fatty acid metabolism and transportation, and that dietary fish oil replacement had significant effects on their expression.
Eriocheir sinensis; Fish oil replacement; Fattening diet; Fatty acid metabolism; Fatty acid-binding protein
S917
A
1000-3207(2016)04-0767-12
10.7541/2016.101
2016-01-25;
2016-04-25
上海市科学技术委员会科研项目(13320502100, 13231203504); 科技部港澳台科技合作专项项目(2014DFT30270); 国家自然科学基金项目(31472287, 31302159); 上海高校水产学一流学科建设项目(2012-62-0908)资助 [Supported by the Projects (13320502100 and 13231203504) from Shanghai Municipal Science and Technology Commission; the Hongkong, Macao and Taiwan Science and Technology Cooperation Projects (2014DFT30270); a Grant from Nature Science Foundation of China (31472287 and 31302159) and the Shanghai Universities First-class Disciplines Project of Fisheries (No.2012-62-0908) from Shanghai Municipal Education Committee]
刘泽华(1991—), 女, 黑龙江人; 在读研究生; 研究方向为水产动物营养与生理。E-mail: 626288766@qq.com
吴旭干(1978—), 男, 副教授; E-mail: xgwu@shou.edu.cn
