双去甲氧基姜黄素抑制肝癌细胞增殖并诱导凋亡的机制
2016-08-10熊书名李建平
景 发,熊书名,李建平
(南通大学医学院 外科学,江苏 南通,226000)
双去甲氧基姜黄素抑制肝癌细胞增殖并诱导凋亡的机制
景发,熊书名,李建平
(南通大学医学院 外科学,江苏 南通,226000)
摘要:目的探讨双去甲氧基姜黄素(BDMC)对肝癌细胞的作用及其机制。方法不同BDMC (0、20、40、80μmol/L)干预肝癌细胞株HEPG2 72 h,MTT评价细胞增殖,Tunel分析细胞凋亡,ELISA检测活性氧(ROS)水平和p-STAT3水平,Western blot检测AMPK。采用ROS抑制剂N-乙酰-L半胱氨酸(NAC 2.5 mmol/L)处理30 min后BDMC再干预24 h,评价细胞凋亡能力。结果BDMC可诱导肝癌细胞凋亡,增加ROS生成和AMPK磷酸化水平,抑制p-STAT3表达。抑制ROS生成可抑制BDMC诱导HEPG2凋亡的能力。结论BDMC通过ROS/AMPK/STAT3信号通路诱导肝癌细胞凋亡。
关键词:双去甲氧基姜黄素; 肝癌; 增殖; 凋亡
姜黄色素主要包括姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素,其中主要成分姜黄素具有广谱的抗肿瘤作用,能抑制体内外多种肿瘤细胞的生长。肝癌是威胁中国人生命健康的常见肿瘤之一,患者总体预后不是十分满意。本实验研究探讨双去甲氧基姜黄素抑制肝癌细胞生长及促进其凋亡的机制,现报告如下。
1材料与方法
1.1材料与试剂
人肝癌细胞株HEPG2购自中国科学院上海细胞研究所。双去甲氧基姜黄素购自美国Sigma生物有限公司。RPMI-1640培养液和胎牛血清购自美国Gibco公司。MTT试剂盒、抗氧化剂N-乙酰-L半胱氨酸(NAC)、活性氧(ROS)检测试剂盒购自南京碧云天生物科技公司。P-AMPK,p-STAT3抗体购自美国Santa Cruz Biotechnology公司。TUNEL 绿色荧光检测试剂盒购自南京碧云天生物科技有限公司。
1.2细胞培养
HEPG2细胞培养于10%胎牛血清的RPMI-1640培养液,置于37 ℃、5% CO2孵箱中,隔天更换培养基,细胞铺满培养瓶70%~80%时,用0.25%胰蛋白酶消化后传代继续培养。
1.3MTT实验检测细胞增殖能力
细胞经胰蛋白酶消化后,调整细胞浓度至1×105个/L,种植于96孔板,每孔100 μL,24 h后加无血清DMEM培养液培养48 h,使细胞同步化于静止期。弃上清,加不同浓度双去甲氧基姜黄素(20、40、80 μmol/L),每组设5个复孔,培养72 h,弃上清,每孔加10 μL MTT和100 μL无血清DMEM培养液,继续培养 4 h,去培养液,加100 μL二甲亚砜37 ℃孵育10 min完全溶解,酶标仪以测量波长490 nm测吸光度值。抑制率(%)=[1-(药物组吸光度值/对照组吸光度值)] ×100%。
1.4荧光TUNEL检测细胞凋亡率P
不同浓度姜黄素作用(20、40、80 μmol/L)后,PBS或HBSS洗涤1次,用4%多聚甲醛固定细胞30~60 min,用PBS或HBSS洗涤1次,加入含0.1% Triton X-100的PBS或碧云天生产的免疫染色洗涤液(P0106),冰浴孵育2 min。在样品上加50 μL TUNEL检测液,37 ℃避光孵育60 min。PBS或HBSS洗涤3次。用抗荧光淬灭封片液封片后荧光显微镜下观察。可以使用的激发波长为450~500 nm,发射波长范围为515~565 nm(绿色荧光)。
1.5ROS生成检测
按照1∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。细胞收集后悬浮于稀释好的DCFH-DA中,细胞浓度为104/mL,37 ℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一下,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。收集细胞后,流式细胞仪检测。
1.6Western Blot鉴定
各组细胞处理后提取总蛋白,加入上样缓冲液,12%SDS-PAGE电泳,结束后转膜,125 mA电流下4 ℃转膜120 min,封闭2 h,一抗(1∶200)稀释后37℃孵育1.5 h,漂洗3次,每次5 min,孵育二抗1.5 h后漂洗,用Pierce ECL发光液(Pierce公司)显影,凝胶成像仪成像。β-actin检测作为内对照。
2结果
2.1双去甲氧基姜黄素对HEPG2细胞增殖的影响
不同浓度BDMC (20、40、80 μmol/L)作用于HEPG2细胞后,细胞增殖受限,随着药物浓度的增加和作用时间的延长,细胞的生长抑制率也呈现明显下降的趋势,即与药物浓度和作用时间成正相关。见图1。HEPG2细胞在80 μmol/L BDMC作用48 h左右时达到半数抑制率。同一时间点高浓度BDMC作用的细胞抑制率显著大于低浓度的抑制率(P<0.05)。

图1 双去甲氧基姜黄素抑制HEPG2细胞增殖
2.2双去甲氧基姜黄素对HEPG2细胞凋亡的影响
不同浓度BDMC (20、40、80 μmol/L)作用于HEPG2细胞72 h后,荧光TUNEL检测发现低浓度的BDMC(20 μmol/L)仅见少量绿色荧光,细胞发生凋亡率仅为3.1%左右。40 μmol/L BDMC作用HEPG2细胞72 h后荧光TUNEL染色提示细胞出现少量凋亡(13.5%)。而80 μmol/L BDMC可明显诱导抑制HEPG2细胞发生凋亡约37.6%。见图 2。不同浓度BDMC组间细胞凋亡率存在显著差异(P<0.05)。
2.3双去甲氧基姜黄素对ROS生成影响
采用碧云天公司的ROS生成检测试剂盒检测不同浓度BDMC (20、40、80 μmol/L) 作用于HEPG2细胞12 h内细胞ROS生成的相对表达量见图3。结果提示BDMC可明显诱导HEPG2细胞ROS生成,并且ROS生成量与BDMC浓度成正相关,80 μmol/L BDMC诱导ROS生成量要显著高于低浓度各组(P<0.05)。
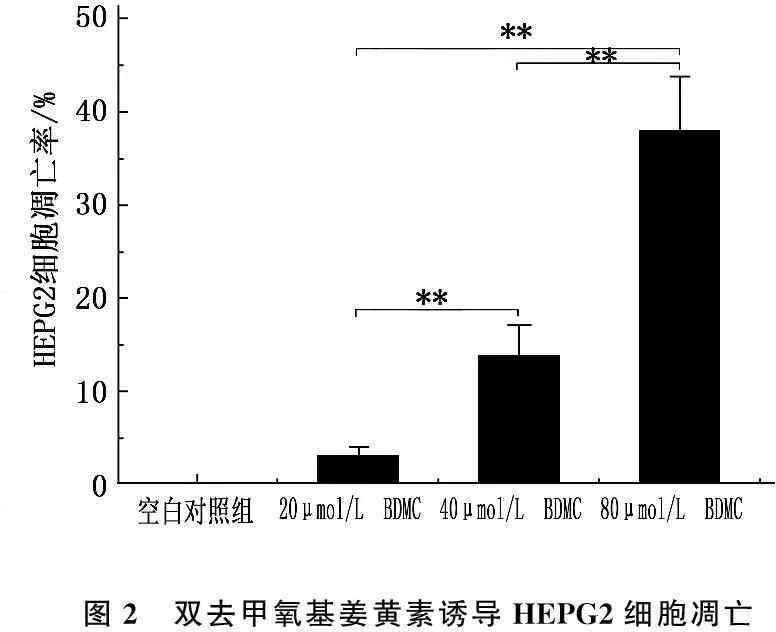
图2 双去甲氧基姜黄素诱导HEPG2细胞凋亡

图3 双去甲氧基姜黄素促进ROS生成
2.4Western Blot检测ROS下游p-AMPK和p-STAT3蛋白表达
上述研究表明BDMC可明显促进ROS生成,进一步利用80 μmol/L BDMC 处理肝癌细胞48 h后,Western Blot检测ROS下游下游信号通路蛋白的表达。本研究表明p-AMPK表达明显增加,而p-STAT3表达明显下降。提示BDMC抗肿瘤可能与ROS/AMPK/STAT3信号通路,作者利用ROS抑制剂NAC抑制ROS生成,其下游的p-AMPK明显下降,而p-STAT3表达明显升高。见图4。
2.5ROS抑制剂NAC阻断BDMC抗肿瘤作用
利用ROS抑制剂NAC阻断BDMC诱导的ROS生成后,作者发现不同浓度BDMC (20、40、80 μmol/L)作用72 h后HEPG2细胞生长抑制率较无NAC组明显下降,凋亡也出现减少。见图5。
3讨论
肝癌在中国癌症死亡率中排名第2位,发病率为全球最高,严重威胁人们的身体健康[1]。随着手术水平的提高及化疗药物的改进、放疗技术的进步,肝癌治疗得到一定的进展,但放化疗目前副作用较大,肝癌患者的总体预后仍然不佳[2]。
姜黄色素主要包括姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素,而其中双去甲氧基姜黄素仅占主要成分的3%[3]。目前关于双去甲氧基姜黄素的抗肿瘤研究报道很少[4]。Yu和Xu等[5-6]研究表明,双去甲氧基姜黄素可有效抑制肺癌细胞的侵袭和迁移。Yu和Song等[7]研究表明,双去甲氧基姜黄素可诱导肺癌细胞凋亡。Luo等[8]发现双去甲氧基姜黄素可通过抑制线粒体功能抑制胃腺癌的生长。

图4 BDMC对p-AMPK和p-STAT3蛋白表达影响


图5添加NAC后BDMC对HEPG2增殖和凋亡的影响
双去甲氧基姜黄素对肝癌细胞作用至今研究报道仍然很少。本研究发现双去甲氧基姜黄素是一种有效的天然抗肿瘤药物,可有效抑制肝癌细胞增殖,高浓度时可诱导细胞凋亡,并且这种作用效果与双去甲氧基姜黄素作用的时间和药物浓度是呈正相关的。Li等[9]研究报道发现,人乳腺癌细胞在加入双去甲氧基姜黄素后细胞生长明显受到抑制,其机制可能与ROS聚集有关。因此,作者推测双去甲氧基姜黄素抑制肝癌细胞增殖和诱导其凋亡与肝癌细胞内ROS生成增加也有关。在肝癌HEPG2细胞中加入双去甲氧基姜黄素后,作者发现ROS生成水平明显增加,利用Western Blot证明ROS大量生成后AMPK磷酸化明显增加,表明ROS生成增加后,AMPK被激活。Nerstedt等[10]研究发现,在肝细胞中STAT3是AMPK活化后的靶点,研究表明AMPK活化可抑制STAT3磷酸化。进一步Western Blot证明双去甲氧基姜黄素干预后肝癌细胞中的STAT3磷酸化明显下降,而研究认为p-STAT3表达下降,可促使Bax从胞浆迁移至线粒体,导致线粒体膜电位崩解,Cyt C释放至胞浆,激活caspase 3级联反应,从而诱导凋亡[11-12]。因此,作者推测双去甲氧基姜黄素的抗肝癌作用通过ROS/AMPK/STAT3信号通路实现。作者利用ROS抑制剂NAC阻断BDMC诱导的ROS生成后,双去甲氧基姜黄素的抗肿瘤作用明显下降,其下游信号通路p-AMPK和p-STAT3表达水平改变出现相反的变化,表明ROS/AMPK/STAT3信号是双去甲氧基姜黄素的抗肝癌重要作用机制。
参考文献
[1]谢玉宏.中晚期原发性肝癌介入治疗的疗效及预后[J].实用临床医药杂志,2014,18(3):93-94,97.
[2]郭兴军,郑艳红,关强,等.肝动脉化疗栓塞联合射频消融术治疗原发性肝癌的疗效分析 [J].实用临床医药杂志,2015,19(5):44-47.
[3]蔡颖,宋珅,徐杰,等.不同来源莪术中姜黄素类成分的含量差异研究 [J].药学与临床研究,2014,22(6):502-505.
[4]何太平,莫丽儿,梁念慈.3种姜黄素类似物对重组人促肝细胞再生磷酸酶-3活性的影响[J].时珍国医国药,2011,22(5):1164-1166.
[5]Yu C C,Yang M D,Lin H Y,et al.Bisdemethoxycurcumin (BDMC) Alters Gene Expression-associated Cell Cycle,Cell Migration and Invasion and Tumor Progression in Human Lung Cancer NCI-H460 Cells [J].In Vivo,2015,29(6):711-728.
[6]Xu J,Yang H,Zhou X,et al.Bisdemethoxycurcumin suppresses migration and invasion of highly metastatic 95D lung cancer cells by regulating E-cadherin and vimentin expression,and inducing autophagy [J].Mol Med Rep,2015,12(5):7603-7608.
[7]Song W,Qiao X,Liang W F,et al.Efficient separation of curcumin,demethoxycurcumin,and bisdemethoxycurcumin from turmeric using supercritical fluid chromatography:From analytical to preparative scale [J].J Sep Sci,2015,38(19):3450-3453.
[8]Luo C,DU Z,Wei X,et al.Bisdemethoxycurcumin attenuates gastric adenocarcinoma growth by inducing mitochondrial dysfunction [J].Oncol Lett,2015,9(1):270-274.
[9]Li Y B,Gao J L,Zhong Z F,et al.Bisdemethoxycurcumin suppresses MCF-7 cells proliferation by inducing ROS accumulation and modulating senescence-related pathways [J].Pharmacol Rep,2013,65(3):700-709.
[10]Nerstedt A,Johansson A,Andersson C X,et al.AMP-activated protein kinase inhibits IL-6-stimulated inflammatory response in human liver cells by suppressing phosphorylation of signal transducer and activator of transcription 3 (STAT3) [J].Diabetologia,2010,53(11):2406-2416.
[11]Li H,Lee J,He C,et al.Suppression of the mTORC1/STAT3/Notch1 pathway by activated AMPK prevents hepatic insulin resistance induced by excess amino acids [J].Am J Physiol Endocrinol Metab,2014,306(2):E197-209.
[12]张毅,张君薇,谢淑丽,等.RNAi沉默STAT3基因联合mTOR抑制剂rapamycin诱导BEL-7402肝癌细胞凋亡 [J].吉林大学学报:医学版,2013,39(5):903-908.
收稿日期:2016-03-21
基金项目:江苏省无锡市科技局科技支撑计划(CSE31N1311)
通信作者:李建平,教授,E-mail:rober824919@sina.com
中图分类号:R 735.7
文献标志码:A
文章编号:1672-2353(2016)15-043-04
DOI:10.7619/jcmp.201615012
Mechanism of bisdemethoxycurcumin inhabits proliferation of hepatocellular carcinoma cell and induces apoptosis
JING FA,XIONG Shuming,LI Jianping
(Surgery,Medical College of Nantong University,Nantong,Jiangsu,226000)
ABSTRACT:ObjectiveTo investigate the effect and mechanism of bisdemethoxycurcumin (BDMC) on hepatocellular carcinoma cells.MethodsHepatoma cell line HEPG2 cells were treated with different concentrations of BDMC (0,20,40,80 μmol/L) for 72 h,and then the cell proliferation was measured by MTT.Cell apoptosis was evaluated by TUNEL analysis.ELISA was used to detect the level of intracellular reactive oxygen species (ROS) and STAT3 phosphorylation (p-STAT3),and Western blot was used to detect the expression of AMPK.Processed by ROS inhibitor N- acetyl -L cysteine (2.5 mmol/L NAC) for 30 min,cells were treated with BDMC for 24 h,and the ability of cell apoptosis was evaluated.ResultsBDMC was able to induce apoptosis of hepatocellular carcinoma cells,increase the intracellular ROS production and AMPK phosphorylation levels,and inhibit the expression of p-STAT3 protein.Inhibition of ROS formation could effectively inhibit the ability of BDMC in inducing apoptosis of HEPG2 cells.ConclusionBDMC induces apoptosis in hepatocellular carcinoma cells by ROS/AMPK/STAT3 signaling pathway.
KEYWORDS:bisdemethoxycurcumin; hepatocellular carcinoma; proliferation; apoptosis
